透性化嗜酸乳杆菌细胞转化亚油酸为共轭亚油酸的反应动力学
2010-10-16魏明崔玮薛正莲
魏明,崔玮,薛正莲
安徽工程科技学院生物化学工程系 微生物发酵安徽省工程技术中心,芜湖 241000
透性化嗜酸乳杆菌细胞转化亚油酸为共轭亚油酸的反应动力学
魏明,崔玮,薛正莲
安徽工程科技学院生物化学工程系 微生物发酵安徽省工程技术中心,芜湖 241000
本实验旨在研究透性化嗜酸乳杆菌细胞生物转化共轭亚油酸的反应动力学。探讨了细胞浓度、底物浓度、反应体系pH值和温度等因素对生物转化共轭亚油酸反应速度的影响;建立了透性化嗜酸乳杆菌细胞生物转化共轭亚油酸的动力学模型。结果表明,透性化嗜酸乳杆菌细胞有利于共轭亚油酸的生物转化,最适细胞浓度、pH值和反应温度分别为10×1010ufc/mL、4.5和45℃;生物转化共轭亚油酸存在底物抑制现象,当亚油酸的浓度为0.6 mg/mL时,反应速度达到最大值17.8 µg/(mL·min)。在低亚油酸浓度下,反应初始阶段的反应规律与经典米氏方程相符,而在高亚油酸浓度下,存在底物抑制现象。在最适反应条件下建立了动力学模型,模型基本反映了共轭亚油酸的生物转化特性。
嗜酸乳杆菌,透性化,生物转化,共轭亚油酸,动力学
Abstract:In this study, we analyzed the kinetics of bioconversion of conjugated linoleic acid(CLA)by permeabilizedLactobacillus acidophiluscells.The effects of cell mass, linoleic acid(LA)concentration, reaction pH and temperature on the bioconversion of CLA by permeabilized cells were investigated and the model system of bioconversion of CLA was established.The results showed that the production of CLA was increased by permeabilized cells.The optimal cell mass, pH and temperature of bioconversion of CLA were 10×1010ufc/mL, 4.5 and 45°C, respectively.A marked LA inhibition phenomenon existed, and the early reaction rate of producing CLA reached the maximum(17.8 µg/mL·min)when LA concentration was 0.6 mg/mL.Michaelis constant was obtained by double-reciprocal plot and Hanes-Woolf plot.The reaction rate equation followed the classic Michaelis-Mentent equation at the low LA concentration, while there was a marked LA inhibition phenomenon at the high LA concentration.With the evaluated model parameters, the model system appeared to provide a description for the bioconversion of CLA by permeabilizedLactobacillus acidophiluscells.
Keywords:Lactobacillus acidophilus, permeabilized cells, bioconversion, conjugated linoleic acid, kinetics
共轭亚油酸(Conjugated linoleic acid,CLA)是亚油酸(Linoleic acid,LA)的共轭双烯酸的多种位置和几何异构体的总称[1],其中顺-9/反-11和反-10/顺-12两种异构体被证实具有很强的生理活性[2]。共轭亚油酸具有降血压、抑制肿瘤、调节脂质代谢、抑制脂肪积累沉积、抗动脉粥样硬化、抗氧化、抗糖尿病、抗霉变、调节机体免疫力等功能[3-5]。目前主要用化学方法合成共轭亚油酸,但得到的是一系列位置和几何异构体的混合物,而用酶法合成能专一性地得到具有较高活性的共轭亚油酸的异构体[2]。
乳酸菌含有亚油酸异构酶[6],能把亚油酸转化为共轭亚油酸[7]。亚油酸异构酶属于胞内酶,通常采用超声波破碎提取粗酶进行催化反应。由于超声波破碎不彻底或者破碎过程中造成酶的损失,导致酶法转化亚油酸为共轭亚油酸的产率较低[8]。完整的细胞是酶催化反应的天然环境,能够保持酶的较高活性;利用菌体转化时,虽然能够增加酶的耐受性,但细胞膜成为亚油酸和共轭亚油酸进出细胞的障碍,亚油酸异构酶的表观活力较低,共轭亚油酸的产率不高[9]。透性化处理可以提高细胞内酶的表观活力加速产物的合成,Gough等利用透性化技术提高了细胞内葡萄糖酸氧化酶的活力[10],Abraham和 Bhat用透性化酵母生产十二烷基肌氨酸取得了很好的效果[11]。目前,利用透性化嗜酸乳杆菌细胞转化亚油酸为共轭亚油酸的研究尚未见报道。通过研究透性化嗜酸乳杆菌细胞转化亚油酸为共轭亚油酸的动力学过程,为共轭亚油酸的生物转化开辟了新途径。
1 材料和方法
1.1 实验材料
嗜酸乳杆菌产亚油酸异构酶突变株:对嗜酸乳杆菌Lactobacillus acidophilus(购于中国科学院微生物研究所)进行激光诱变和筛选得到。具体方法如下:在添加5 µg/mL亚油酸的MRS固体培养基上接种嗜酸乳杆菌,激光照射10 min,功率20 mW,距离25 cm,得到一株亚油酸异构酶高产菌株,突变菌株经传代实验产酶稳定。
1.2 培养基及培养条件
以MRS为基本培养基,以1%(V/V)接种量接入到一定体积的 MRS培养基中,37℃诱导培养(5 µg/mL亚油酸诱导)36 h,培养结束后离心(5000×g,10 min,4℃)收集菌体,并用 0.1 mmol/L的磷酸二氢钾缓冲液(pH 6.5)洗涤2次。
1.3 细胞的透性化处理
把收集到的菌体加入到磷酸二氢钾缓冲液中,添加渗透剂溴化十六烷三甲基铵(CTAB)至终浓度为1%,渗透时间为20 min,然后离心收集菌体用磷酸二氢钾缓冲液洗涤备用。
1.4 共轭亚油酸的检测方法
共轭亚油酸(CLA)在波长 233~234 nm之间有特殊吸收峰,而亚油酸(LA)却没有。在50 mL三角瓶中加入一定量的透性化细胞、LA和吐温 80,在37℃下振荡反应一段时间,然后加入正己烷 20 mL萃取CLA;离心之后取正己烷层,在233 nm处用紫外分光光度计测其吸光值,对照CLA标准曲线可求得CLA的含量,CLA标准品购于Sigma公司,CLA标准曲线为:y=10.2x−0.69,R2=0.998。
1.5 透性化细胞、非透性化细胞及粗酶液转化共轭亚油酸的比较实验
分别取 10 mL细胞悬浮液(细胞浓度 10×1010ufc/mL),分别进行透性化处理(添加CTAB于细胞悬浮液中至终浓度为1%,渗透20 min)、不处理和研磨超声处理获得粗酶液(首先用石英砂在冰浴中研磨,然后用超声波处理,功率为300 W,超声时间10 min,离心后获得粗酶液),然后分别加入等量的LA至终浓度0.5 mg/mL,反应体系的pH值为4.0,于37℃、150 r/min条件下反应3 h,提取脂肪酸测定CLA的含量。
1.6 对生物转化速度的影响实验
1.6.1 细胞浓度对生物转化速度的影响
将透性化细胞用磷酸二氢钾缓冲液稀释成不同浓度的细胞悬浮液(1×1010、3×1010、5×1010、7×1010、9×1010、10×1010、12×1010、15×1010ufc/mL),取 10 mL菌悬液于50 mL三角瓶中,添加LA至终浓度为0.5 mg/mL,反应体系pH值为4.0,于37℃、150 r/min条件下反应,每隔一段时间提取CLA进行分析。
1.6.2 底物浓度对生物转化速度的影响
分别取10 mL透性化处理的细胞悬浮液(细胞浓度为10×1010ufc/mL)置于50 mL三角瓶中,添加不同浓度的 LA(0、0.1、0.2、0.4、0.6、0.8、1.0、1.5、2.0、2.5、3.0、4.0 mg/mL),反应体系pH值为4.0,于37℃、150 r/min条件下反应,每隔一段时间提取CLA进行分析。
1.6.3 反应缓冲液的pH值对生物转化速度的影响
将透性化处理的细胞用不同 pH值(pH 3、pH 4、pH 4.5、pH 5、pH 6、pH 7、pH 8)的磷酸盐缓冲液悬浮,分别取 10 mL悬浮液(细胞浓度为10×1010ufc/mL)放入50 mL三角瓶中,添加LA至终浓度0.5 mg/mL,于37℃、150 r/min条件下反应,每隔一段时间提取CLA进行分析。
1.6.4 反应温度对生物转化速度的影响
分别取透性化处理的细胞悬浮液(细胞浓度为10×1010ufc/mL)10 mL于50 mL三角瓶中,添加LA至终浓度为0.5 mg/mL,反应体系pH值为4.5,分别在不同温度(20℃、30℃、40℃、45℃、50℃、55℃、60℃、70 ℃)150 r/min 下反应,每隔一段时间提取CLA进行分析。
1.7 模型建立及动力学参数测定
取10 mL透性化细胞悬浮液加入不同浓度(0~4 mg/mL)的LA,在45℃、150 r/min下反应,每隔一段时间提取 CLA进行分析,以双倒数(Doublereciprocal plot)和Hanes-Woolf法作图,得到反应的动力学参数并建立不同底物浓度范围的速度方程,对拟合的速度方程进行验证。
2 结果与分析
2.1 透性化细胞、非透性化细胞及粗酶液转化CLA的比较
从表 1可以看出,透性化处理的嗜酸乳杆菌细胞CLA转化率和反应速度都最大。经过透性化处理的嗜酸乳杆菌细胞,底物 LA可以顺利进入细胞被酶催化生成CLA,因而大大缩短反应时间,加快了反应速度;未经透性化处理的细胞,由于细胞膜阻碍了底物与酶的有效结合,细胞内亚油酸异构酶的表观活力较低,因而CLA的转化率也较低[9,12];而经过研磨及超声等步骤提取粗酶液会引起酶的损失或降低酶活,因而在同等条件下催化能力降低[7]。
2.2 细胞浓度对生物转化速度的影响
酶催化反应的速度与酶浓度有关,在透性化嗜酸乳杆菌细胞催化反应中,可以通过改变细胞浓度来调节参与反应的酶量,进而影响催化反应的速度。从图1中可以看出,当细胞浓度较低时,反应速度增加缓慢,当细胞浓度在4×101~10×1010ufc/mL时,随着细胞浓度的增加,反应速度快速增加;当细胞浓度达到10×1010ufc/mL以后,反应速度趋于平稳,所以细胞浓度为10×1010ufc/mL时为饱和浓度。这种现象是由于在低细胞浓度下存在底物抑制,因此反应速度上升较慢,随着细胞浓度的增加,相对底物的抑制作用减弱,反应速度呈线性增加,当细胞浓度达到一定值时,反应速度最大[9]。
2.3 亚油酸浓度对生物转化速度的影响
由图2可知,底物浓度对初始反应速度影响很大,初始反应速度随LA浓度的增加而增加,当LA的浓度为 0.6 mg/mL时,反应速度达到最大值为17.8 µg/(mL·min);当LA浓度大于0.6 mg/mL时,反应速度随着 LA浓度的增加而下降。由此可知,在LA浓度大于0.6 mg/mL时,反应存在明显的底物抑制现象,结果与Peng等[13]从梭状芽孢杆菌中分离到的亚油酸异构酶的酶反应动力学相似。
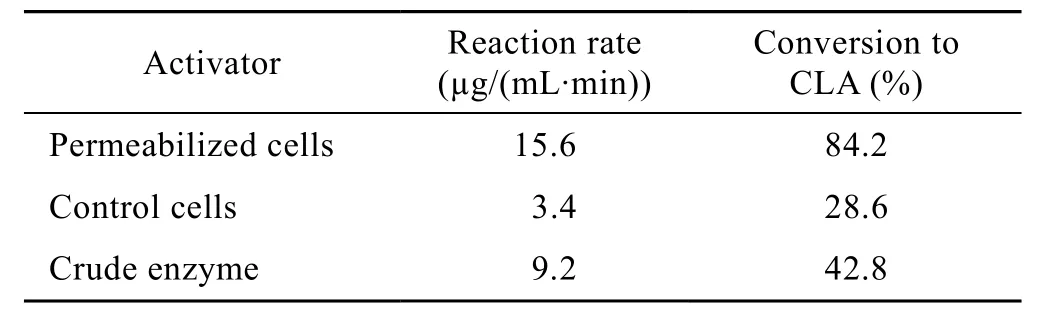
表1 透性化细胞、非透性化细胞及粗酶液转化CLA的比较Table 1 Comparison of bioconversion of LA to CLA by permeabilized cells, control cells and crude enzyme

图1 细胞浓度对反应初速度的影响Fig.1 Effect of cell concentration on the early reaction rate.
2.4 反应体系的pH值对生物转化速度的影响
酶促反应的速度受反应介质的 pH值影响,pH值影响酶的活性,由图3可知,嗜酸乳杆菌透性化细胞生物转化CLA的最适pH值在4.5左右。
2.5 反应温度对生物转化速度的影响
温度越高酶促反应的速度越快,同时温度又影响细胞内酶的活性,由图4可知,酶催化初始反应速度随着温度的升高而加快,当温度为 45℃~50℃时,反应速度较大,继续升高温度反应速度反而下降。高温使酶分子的构象发生变化,从而导致酶的活性降低,因此透性化嗜酸乳杆菌细胞生物转化共轭亚油酸的最适温度为45℃左右。

图2 亚油酸浓度对反应初速度的影响Fig.2 Effect of LA concentration on the early reaction rate.
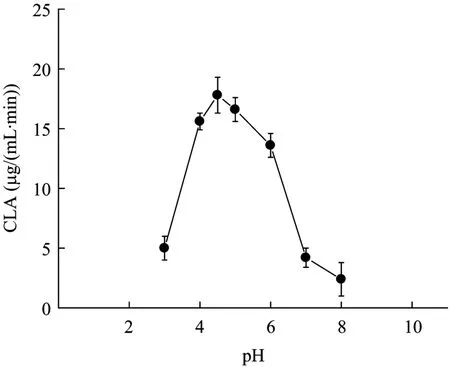
图3 反应pH值对反应初速度的影响Fig.3 Effect of pH value on the early reaction rate.

图4 反应温度对反应初速度的影响Fig.4 Effect of reaction temperature on the early reaction rate.
2.6 生物转化共轭亚油酸的动力学模型建立
由于透性化嗜酸乳杆菌转化CLA存在明显的底物抑制现象,因此对速度方程分两段考察: 底物非抑制浓度范围和底物抑制浓度范围内的速度方程。当LA浓度在(0~0.6 mg/mL)时,透性化细胞反应规律遵循经典米氏方程:

(Vmax为最大反应速度,Km为米氏常数)。
对式(1)进行变形为:

采用双倒数作图法对1/V与1/S作图,拟合出一条线性方程y=0.0115x+0.042。将直线延长与坐标轴相交,在横轴上截距为−1/Km,在纵轴上截距为1/Vmax,从而求得米氏常数和最大反应速度分别为:Km=0.27 mg/mL,Vmax=23.81 µg/(mL·min)。所以,在低底物浓度范围内,透性化嗜酸乳杆菌细胞反应规律可用米氏方程来描述:

当亚油酸浓度大于0.6 mg/mL时,由2.3可知,底物抑制明显,可用经典的底物抑制速率方程来描述:

(Ki是底物抑制的解离常数)对式(4)进行变形得下式:

采用Hanes-Woolf作图法对S/V与S作图,拟合出一条非线性回归方程:y=0.0811x2+0.0887x−0.048对照式(5)可以求得 Km=0.54 mg/mL;Vmax=11.27 µg/(mL·min);Ki=1.09 mg/mL。因此,在高底物浓度范围内,透性化嗜酸乳杆菌细胞反应速度方程为:

2.7 模型的验证
对非底物抑制范围内的速度方程式(3)进行验证,结果如图5A所示,亚油酸浓度在0~0.6 mg/mL之间时,实验值与模拟值相对偏差低于 5%,反应速度方程与经典的米氏方程相吻合,方程拟合较好。

图5 实验值与模型值的对比Fig.5 Comparison of experimental result with model result.(A)At low LA concentration.(B)At high LA concentration.
对底物抑制范围内的速度方程式(6)进行验证,结果如图5B所示,亚油酸浓度在0.6~3 mg/mL之间实验值与模拟值相对偏差低于 5%,这与底物抑制方程相吻合。
3 结论
经过透性化处理的嗜酸乳杆菌细胞,细胞膜的通透性增加,底物亚油酸可以顺利进入细胞被酶催化,大大缩短了反应时间,同时透性化细胞内酶比提取液中酶的热稳定性有所提高[6],加快了反应速度。透性化嗜酸乳杆菌生物转化共轭亚油酸的最佳底物浓度为0.6 mg/mL,最佳细胞浓度为10×1010ufc/mL,最佳pH值为4.5,最佳温度为45℃。通过透性化嗜酸乳杆菌转化亚油酸为共轭亚油酸的动力学研究,建立了不同底物浓度范围的速度方程,建立的模型较好地反映了透性化嗜酸乳杆菌生物转化共轭亚油酸的特性,为利用透性化嗜酸乳杆菌大规模生物转化共轭亚油酸提供了依据。
REFERENCES
[1]Adolf R, Lammt T.Fractionation of cis-oleic and tran-oleic, linoleic, and conjugated linoleic fatty acid methyl esters by silver ion high-performance liquid chromatography.J Chromatogr A, 1998, 799(1/2):329−332.
[2]Pariza MW, Park Y, Cook ME.The biologically active isomers of conjugated linoleic acid.Prog Lipid Res, 2001,40(4): 283−298.
[3]Park Y, Albright KJ, Storkson JM,et al.Effect of conjugated linoleic acid on body composition in mice.Lipids, 1997, 32(8): 853−858.
[4]Hur SJ, Park GB, Joo ST.Biological activities of conjugated linoleic acid(CLA)and effects of CLA on animal products.Livestock Sci, 2007, 110(3): 221−229.
[5]Hubbard NE, Lim D, Erickson KL.Effect of separate conjugated linoleic acid isomers on murine mammary tumorigenesis.Cancer Lett, 2003, 190(1): 13−19.
[6]Cao J, Wei M, Zeng S,et al.Purification and characterization of linoleate isomerase fromLactobacillus acidophilus.Food Ferm Ind, 2004, 30(2): 48−52.曹健, 魏明, 曾实, 等.一株嗜酸乳杆菌突变株亚油酸异构酶的纯化及性质.食品与发酵工业, 2004, 30(2):48−52.
[7]Lin TY, Lin CW, Wang YJ.Production of conjugated linoleic acid by enzyme extract ofLactobacillus acidophilusCCRC14079.Food Chem, 2003, 83(1): 27−31.
[8]Lin TY.Conjugated linoleic acid production by cells and enzyme extract ofLactobacillus delbrueckiissp.bulgaricuswith additions of different fatty acids.Food Chem, 2006, 94(3): 437−441.
[9]Lee SO, Kim CS, Cho SK,et al.Bioconversion of linoleic acid into conjugated linoleic acid during fermentation and by washed cells ofLactobacillus reuteri.Biotechnol Lett,2003, 25(12): 935−938.
[10]Gough S, Deshpande M, Scher M,et al.Permeabilization ofPichia pastorisfor glycolate oxidase activity.Biotechnol Lett, 2001, 23(18): 1535−1537.
[11]Abraham J, Bhat SG.Permeabilization of baker’s yeast with N-lauroyl sarcosine.J Ind Microbiol Biotechnol,2008, 35(8): 799−804.
[12]Wang LM, Lv JP, Chu ZQ,et al.Production of conjugated linoleic acid byPropionibacterium freudenreichii.Food Chem, 2007, 103(2): 313−318.
[13]Peng SS, Deng MD, Gund AD,et al.Purification and characterization of a membrane-bound linoleic acid isomerase fromClostridium sporogenes.Enzyme Microb Technol, 2007, 40(4): 831−839.
Kinetics of bioconversion of linoleic acid to conjugated linoleic acid by permeabilized Lactobacillus acidophilus cells
Ming Wei, Wei Cui, and Zhenglian Xue
Anhui Engineering Technology Research Center of Microbial Fermentation, Department of Biology and Chemistry, Anhui University of Technology and Science, Wuhu 241000, China
Received:November 9, 2009;Accepted:March 10, 2010
Supported by:Natural Science Research Program of the Educational Office of Anhui Province(No.KJ2008B205), Talent Recruitment Program of Anhui University of Technology and Science(No.2007YQQ008).
Corresponding author:Ming Wei.E-mail: wmrainbow@yahoo.com.cn安徽省教育厅自然科学基金项目(No.KJ2008B205),安徽工程科技学院人才引进基金(No.2007YQQ008)资助。
