分阶段pH调控提高2-酮基-L-古龙酸生产
2010-10-16张静周景文刘立明刘杰陈克杰堵国成陈坚
张静,周景文,刘立明,刘杰,陈克杰,堵国成,陈坚
1 江南大学 工业生物技术教育部重点实验室,无锡 214122 2 江南大学生物工程学院 生物系统与生物加工工程研究室,无锡 214122 3 江苏江山制药有限公司,靖江 214500
分阶段pH调控提高2-酮基-L-古龙酸生产
张静1,2,周景文1,2,刘立明1,2,刘杰3,陈克杰1,2,堵国成2,陈坚1,2
1 江南大学 工业生物技术教育部重点实验室,无锡 214122 2 江南大学生物工程学院 生物系统与生物加工工程研究室,无锡 214122 3 江苏江山制药有限公司,靖江 214500
为了提高酮古龙酸菌Ketogulonicigenium vulgare和巨大芽胞杆菌Bacillus megaterium生产 2-酮基-L-古龙酸(2-KLG)的生产效率,分析了pH对K.vulgare和B.megaterium生长和产酸的影响,发现K.vulgare和B.megaterium的最适生长pH值分别为6.0和8.0,但是K.vulgare的糖酸转化活力在pH 7.0时达到最大值,因此提出了三阶段pH控制策略(第一阶段:0~8 h,pH 8.0;第二阶段:8~20 h,pH 6.0;第三阶段:20 h至发酵结束,pH 7.0)以促进K.vulgare生长和2-KLG生产。结果表明,三阶段pH控制策略的实施进一步提高了2-KLG的产量(77.3 g/L)、生产强度(1.38 g/(L·h))和L-山梨糖消耗速率(1.42 g/(L·h)),分别比恒定pH 7.0时提高了9.7%、33.2%和25.7%。
pH调控策略,酮古龙酸菌,巨大芽胞杆菌
Abstract:The aim of this study was to improve the 2-keto-L-gulonic acid(2-KLG)production efficiency byKetogulonicigenium vulgareandBacillus megateriumby using multi-stage pH control strategy.The effect of pH on the cell growths and 2-KLG production showed that the optimum pH forK.vulgareandB.megateriumcell growth were 6.0 and 8.0, respectively, while the optimum pH for 2-KLG production was 7.0.Based on the above results, we developed a three-stage pH control strategy: the pH was kept at 8.0 during the first 8 h, then decreased to 6.0 for the following 12 h, and maintained at 7.0 to the end of fermentation.With this strategy, the titer, productivity of 2-KLG and L-sorbose consumption rate were achieved at 77.3 g/L, 1.38 g/(L·h)and 1.42 g/(L·h),respectively, which were 9.7%, 33.2% and 25.7% higher than the corresponding values of the single pH(pH 7.0)control model.
Keywords:pH control strategy,Ketogulonicigenium vulgare,Bacillus megaterium
以酮古龙酸菌Ketogulonicigenium vulgare[1]和巨大芽胞杆菌Bacillus megaterium为生产菌株,采用 L-山梨糖为底物合成维生素 C前体—2-酮基-L-古龙酸(2-keto-L-gulonic acid,2-KLG)是一典型的混菌发酵体系。其中,K.vulgare是产酸菌,含有转化L-山梨糖为2-KLG的完整酶系,但其单独生长微弱,产酸较少。B.megaterium作为K.vulgare的伴生菌,在形成芽胞的过程中裂解释放活性物质促进K.vulgare生长和产酸[2]。我国科研工作者已在发酵优化[3-13]、两菌关系[14]、酶学性质[15-16]等方面开展了大量卓有成效的研究工作。然而,制约 2-KLG产量、转化率和生产强度进一步提高的关键在于如何调控两菌之间的关系。尽管有研究表明分子量在30~50 kDa范围内和大于100 kDa的大菌胞外液组分都具有促进K.vulgare转化 L-山梨糖生成2-KLG的作用。赵世光等分离纯化了一种58 kDa的B.megaterium胞外蛋白,明显促进K.vulgare关键酶L-山梨糖脱氢酶的转化效率[17]。但实际工业化生产中更希望发展一种高效、简单、易于操作的调控手段,使B.megaterium适时地、定向地释放胞内活性物质,以促进K.vulgare生长和产酸。由于K.vulgare和B.megaterium分属不同的微生物种属,相应的生理需求也不尽相同。基于这一思路,本研究在透彻研究pH对K.vulgare和B.megaterium生长影响的基础上,导向性地采用分阶段pH控制策略,实现了2-KLG的高效生产。这一针对混菌发酵体系中不同菌株提供不同pH需求的发酵控制策略,有别于以往的单菌发酵系统的分阶段控制策略,为提高混菌发酵体系的生产效率,提供了新的研究思路。
1 材料与方法
1.1 菌种
K.vulgare和B.megaterium由江苏江山制药有限公司提供。
1.2 培养基
种子和斜面培养基(g/L):L-山梨糖 20,酵母膏3,蛋白胨 10,牛肉膏 3,玉米浆粉1.5,尿素1,碳酸钙1,硫酸镁0.2,磷酸二氢钾1;琼脂 20(斜面培养基),定容至 1 L,pH 6.7~7.0,121℃灭菌 15 min。
发酵培养基(g/L):L-山梨糖 80,尿素12,碳酸钙 5,硫酸镁 0.1,磷酸二氢钾 1,玉米浆 5,定容至1 L,pH 6.7~7.0,121℃灭菌15 min。
1.3 培养条件
单独K.vulgare培养:将菌种接种到液体种子培养基中于30℃、200 r/min培养32 h后,按体积浓度10%的接种量接种于装有1.5 L发酵培养基的3 L发酵罐中培养72 h,搅拌转速为400 r/min,通气量为1.5 L/min,pH分别控制在5.0、6.0、7.0、8.0。
单独B.megaterium培养:将菌种接种到液体种子培养基中于30℃、200 r/min培养9 h后,按体积浓度10%的接种量接种于装有1.5 L发酵培养基的3 L发酵罐中培养72 h,搅拌转速为400 r/min,通气量为 1.5 L/min,pH 分别控制在 5.0、6.0、7.0、8.0。
混菌培养:将K.vulgare和B.megaterium以3∶1的比例接种于种子培养基中于30℃、200 r/min培养18 h后,按体积浓度10%的接种量接种于装有1.5 L发酵培养基的3 L发酵罐中培养72 h,搅拌转速为400 r/min,空气通气量为1.5 L/min,pH根据实验设计控制。
1.4 分析方法
2-KLG和L-山梨糖的浓度用HPLC分析。发酵样品用流动相 10倍稀释,0.45 μm 滤膜过滤。Agilent 1100 system,BioRad公司Aminex HPX-87H色谱柱;流动相:2.75 μmol/L浓硫酸;柱温:35℃;流速:0.6 mL/min;进样量:5 μL;检测器:示差折光检测器。
细胞浓度测定采用血球计数法:取发酵液经适度稀释,滴入血球计数板,在油镜下分别计量两菌数量。
糖酸转化活力:在10 mL含2% L-山梨糖的磷酸氢二钠-磷酸二氢钾缓冲液(pH分别为5.0、6.0、7.0、8.0)中,加入一定量的K.vulgare细胞,制成终浓度约为1×109CFU/mL的休止细胞悬液,30℃振荡培养1 h,立即终止反应,用HPLC法测定2-KLG的生成量。糖酸转化活力定义为:30℃每小时转化L-山梨糖生成1 mg 2-KLG为一个糖酸转化活力单位(U)。
2 结果
2.1 不同pH值对K.vulgare细胞生长的影响
采用3 mol/L Na2CO3或4 mol/L HCl将发酵过程中 pH值分别控制在 5.0、6.0、7.0、8.0以考察pH值对K.vulgare生长的影响(图1)。结果表明,K.vulgare在pH 6.0时达到最大比生长速率的时间(22 h)比pH 5.0、pH 7.0和pH 8.0分别缩短了5 h、2 h、2 h。pH 6.0时K.vulgare最大比生长速率为0.098 h−1,比pH 5.0、pH 7.0和pH 8.0时的最大比生长速率分别提高了68%、14%和73%。pH为6.0时K.vulgare细胞达到对数末期(细胞比生长速率<0.02)仅用了35 h,与其他pH条件下比较,缩短了4~6 h。这一结果表明,pH是影响K.vulgare生长的一个重要环境因素,其最适生长pH为6.0,过低或过高pH值均不利于细胞生长。
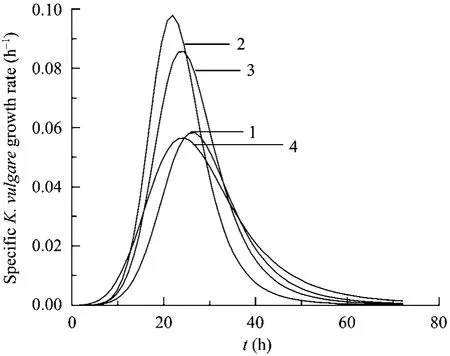
图1 pH对K.vulgare生长的影响Fig.1 Effect of pH on theK.vulgaregrowth.curve 1: pH 5.0;curve 2: pH 6.0; curve 3: pH 7.0; curve 4: pH 8.0.
2.2 不同pH值对B.megaterium细胞生长和芽胞形成的影响
不同pH值对B.megaterium细胞生长的影响如图2A所示。随着发酵液中 pH不断增加,B.megaterium最大比生长速率逐渐增加,pH 8.0时达到最大值,为0.74 h−1(4 h),而pH 5.0时这一数值仅为0.29 h−1(12 h)。比生长速率的提高显著缩短了细胞生长所需时间,因此,发酵液中pH为8.0时,B.megaterium培养仅8 h后就达到其对数生长末期。
B.megaterium在达到最大细胞浓度后迅速自溶或形成芽胞,导致营养细胞的数量剧减(图2A)。在所研究的pH(pH 5.0~8.0)范围内,B.megaterium衰亡速率随着发酵液中pH的增加而逐渐降低,pH 8.0时细胞衰亡速率(0.10 h−1)为 pH 5.0(0.29 h−1)时的 36%(图2A)。
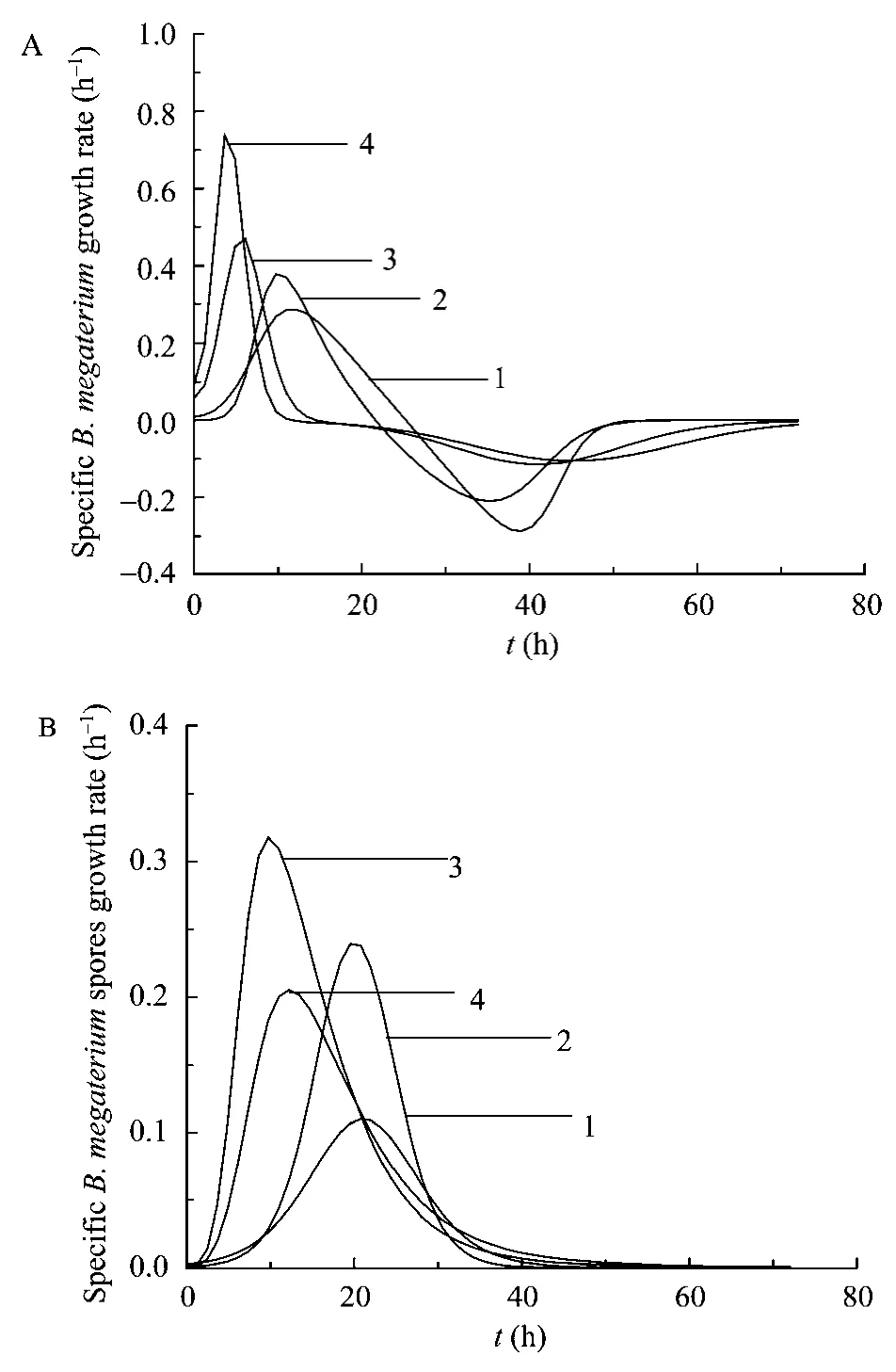
图2 pH对B.megaterium(A)和 B.megaterium芽胞(B)生长的影响Fig.2 Effect of pH on theB.megateriumgrowth(A)and the sporulation (B).curve 1: pH 5.0; curve 2: pH 6.0; curve 3:pH 7.0; curve 4: pH 8.0.
图2B表明pH 7.0时B.megaterium达到最大芽胞比形成速率的时间仅为10 h(0.32 h−1)。另一方面,最大芽胞数量与其最大细胞浓度的比值随着发酵液中pH的增加而增加,如pH 5.0时为3%,而pH 8.0时则升至21%。上述阐述表明,酸性pH值明显抑制了B.megaterium芽胞形成率。在利用混菌发酵生产2-KLG的过程中,K.vulgare需要B.megaterium提供其赖以生长和合成 2-KLG的营养物质。若B.megaterium裂解后形成大量的芽胞,则不利于K.vulgare生长和2-KLG生产。这是因为B.megaterium在形成芽胞过程中,部分胞内活性物质残存于芽胞中,导致其释放的胞内活性物质减少。因此,为了进一步提高2-KLG的生产效率,宜将芽胞形成阶段的pH值控制为酸性。
2.3 pH对糖酸转化能力的影响
2-KLG的合成途径主要涉及K.vulgare的3个关键酶:L-山梨糖脱氢酶、L-山梨酮脱氢酶和2-KLG还原酶。然而,上述三者的最适 pH值相差较大,其中L-山梨糖脱氢酶的最适pH值为6.86[18],L-山梨酮脱氢酶的最适pH值大于9.0,2-KLG还原酶的最适pH为6.5[19]。其中L-山梨糖脱氢酶可以直接转化L-山梨糖为2-KLG,是维生素C二步发酵的关键酶,而2-KLG还原酶可以催化 2-KLG还原为L-艾杜糖酸。静息细胞体系中 pH值对K.vulgare糖酸转化活力的影响如图3所示,pH 7.0时,K.vulgare细胞的糖酸转化能力达到最大。而酸性环境(pH<7.0)或者碱性环境(pH>7.0)均使糖酸转化能力受到一定程度的抑制。
2.4 分阶段pH控制策略促进2-KLG生产
综合图1~3,可得出如下结论:1)B.megaterium最适生长pH是8.0;2) 最佳B.megaterium裂解和最低芽胞生成率的pH为6.0以下;3)K.vulgare最适生长 pH是 6.0;4)合成 2-KLG的最佳 pH为7.0。上述结论表明,2-KLG发酵过程始终将pH控制为 7.0的发酵控制策略显然不能高效地发挥微生物细胞的生理功能,导致发酵过程效率降低,而生产成本显著提高。因此,需要在综合考虑下述 3点因素:1)发酵初期使B.megaterium迅速生长并于对数末期后迅速裂解,释放大量胞内活性物质;2)K.vulgare快速生长至最大细胞浓度;3)进一步产酸阶段时2-KLG合成能力的基础上,发展最适的pH控制策略:发酵初期(0~8 h)控制pH为8.0以促进B.megaterium生长;发酵中期(8~20 h)控制pH为6.0促进B.megaterium裂解,降低芽胞形成率和缩短K.vulgare生长延滞期;发酵后期(20 h至发酵结束)控制pH为7.0以提升2-KLG的合成能力,从而提高2-KLG产量和生产强度(图4)。采用这一分阶段pH值调控策略,显著提高了2-KLG的合成能力和底物L-山梨糖的消耗能力。使2-KLG产量(77.3 g/L)、生产强度(1.38 g/(L·h))和 L-山梨糖消耗速率(1.42 g/(L·h))比单一 pH值(7.0)控制模式下相应数据分别提高了9.7%、33.2%和25.7%(表1)。然而,这一 pH控制策略并不能显著提高 L-山梨糖消耗的总量及其转化为2-KLG的转化率。

图3 pH对K.vulgare糖酸转化活力的影响Fig.3 Effect of pH on conversion ability ofK.vulgare.

表1 分阶段控制策略与恒定pH发酵的特征发酵参数比较Table 1 Fermentation properties of 2-KLG fermentation in constant pH 7.0 and in pH control by stages
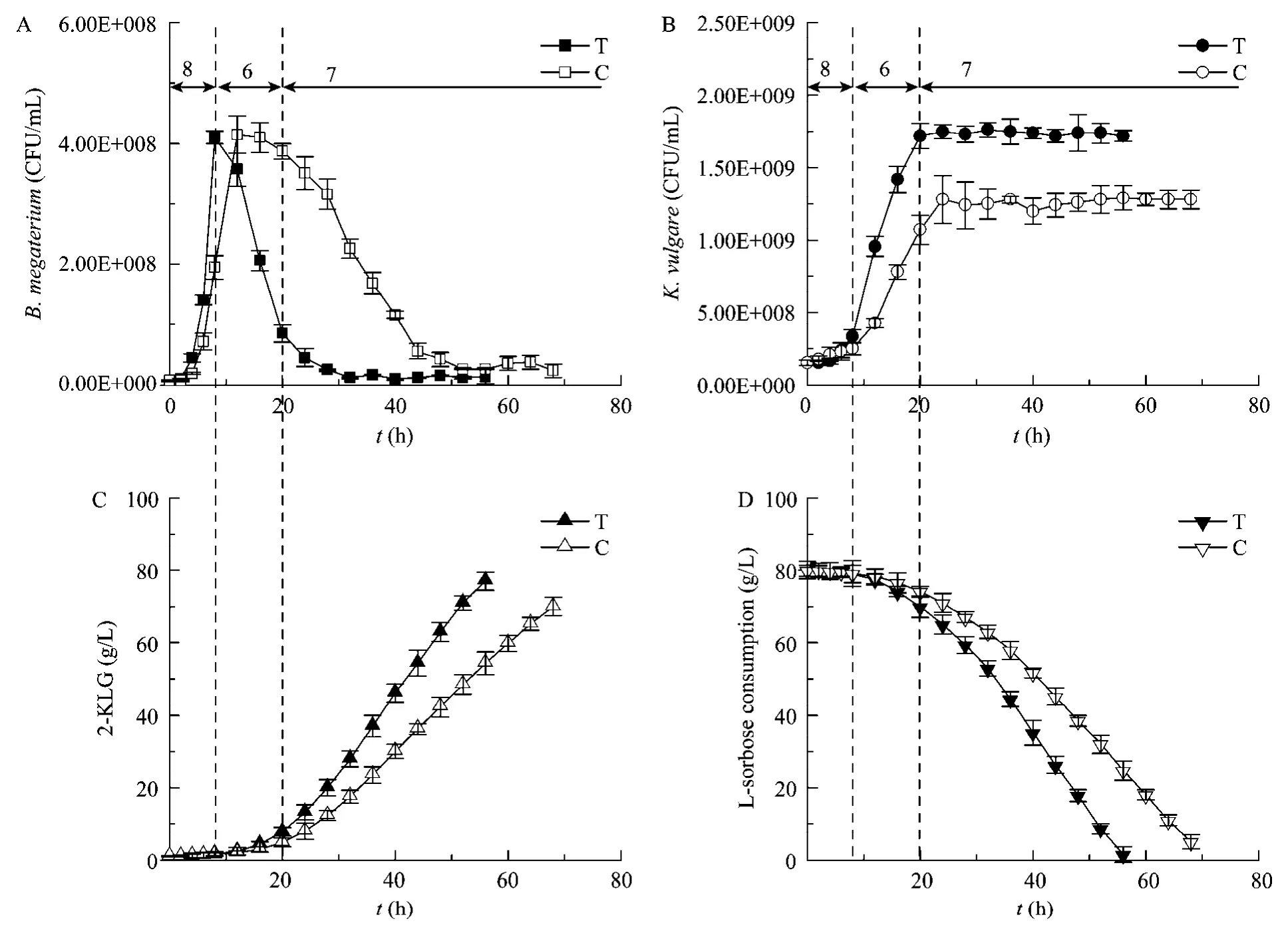
图4 不同pH控制策略对2-KLG发酵的影响Fig.4 Comparison of time courses between three-staged pH strategy(T)and constant pH strategy(C).(A)B.megaterium.(B)K.vulgare.(C)2-KLG.(D)L-sorbose consumption.
3 结论
本文在详尽分析2-KLG发酵过程中pH如何影响B.megaterium和K.vulgare生长及2-KLG合成的基础上,为进一步提高 2-KLG生产效率,针对性地提出0~8 h控制pH为8.0,8~20 h控制pH为6.0,发酵20 h后切换至7.0的pH分阶段控制策略,使 2-KLG的产量、生产强度和 L-山梨糖消耗速率比控制pH为7.0模式下分别提高了9.7%、33.2%和25.7%。
REFERENCES
[1]Urbance JW, Bratina BJ, Stoddard SF,et al.Taxonomic characterization ofKetogulonigenium vulgaregen.nov.,sp.nov.andKetogulonigenium robustumsp.nov., which oxidize L-sorbose to 2-keto-L-gulonic acid.Int J Syst Evol Microbiol, 2001, 51: 1059−1070.
[2]Feng S, Sun CB, Zhang ZZ,et al.Effects ofBacillus megateriumon growth and 2KGA synthesizing ofGluconobacteroxydansin vitamin C two-step fermentation process.J Microbiol, 1998, 18(1): 6−9.冯树, 孙传宝, 张忠泽, 等.维生素 C二步发酵中巨大芽孢杆菌对氧化葡萄糖酸杆菌生长和产酸的影响.微生物学杂志, 1998, 18(1): 6−9.
[3]Zhang J, Liu LM, Liu J,et al.Progress in biotechnological production of vitamin C.J Food Sci Biotech, 2008, 27(5):1−7.张静, 刘立明, 刘杰, 等.生物技术法生产维生素 C的研究进展.食品与生物技术学报, 2008, 27(5): 1−7.
[4]Cui B, Lü H, Chen HQ,et al.Study on sorbose adding technology of vitamin C two-step fermentation.Food Ferment Ind, 2006, 32(7): 63−64.崔波, 吕慧, 陈宏权, 等.VC二步发酵流加糖工艺的研究.食品与发酵工业, 2006, 32(7): 63−64.
[5]Ren SX, He JM, Song Q,et al.Production of vitamin C precursor-2-keto-L-gulonic acid from L-sorbose by a novel bacterial component system of SCB329-SCB933.Ⅱ.High sorbose fermentation by installment-batch method.Ind Microbiol, 1997, 27(2): 5−9.任双喜, 何建明, 宋祺, 等.新组合菌系 SCB329—SCB933利用 L-山梨糖发酵生产维生素 C前体—2-酮基-L-古龙酸的研究 II.利用 L-山梨糖批加技术实现高糖发酵.工业微生物, 1997, 27(002): 5−9.
[6]Zhang YJ, Liang BC, Li HT.Studies on a fed-batch technology of high concentration L-sorbose in Vc two-step fermentation.Hebei Chem Eng Ind, 2006, 29(8):37−39.张亚军, 梁丙辰, 李海涛.VC二步发酵高糖流加工艺的研究.河北化工, 2006, 29(8): 37−39.
[7]Takagi Y, Sugisawa T, Hoshino T.Continuous 2-Keto-L-gulonic acid fermentation by mixed culture ofKetogulonicigenium vulgareDSM 4025 andBacillus megateriumorXanthomonas maltophilia.Appl Microbiol Biotech, 2010, 86(2): 469−480.
[8]Yang LN, Zhao SH, Liu C.Study of fed-batch L-sorbose fermentation production of 2- KLG.Hebei Chem Eng Ind,2008, 31(6): 33−35.杨丽宁, 赵士豪, 刘冲.间歇流加L-山梨糖发酵生产2-酮基-L-古龙酸研究.河北化工, 2008, 31(6): 33−35.
[9]Lin WC, Ye Q, Qiao CH,et al.Study on the fermentation condition producing 2-keto-L-gulonic acid by using mixed culture of microorganism.Microbiol China, 2002, 29(4):37−41.林文楚, 叶晴, 乔春红, 等.微生物混合培养从 D-山梨醇生产维生素 C前体-2-酮基-L-古龙酸发酵条件的研究.微生物学通报, 2002, 29(4): 37−41.
[10]Leduc S, de Troostembergh JC, Lebeault JM.Folate requirements of the 2-keto-L-gulonic acid-producing strainKetogulonigenium vulgareLMP P-20356 in L-sorbose/CSL medium.Appl Microbiol Biotech, 2004,65(2): 163−167.
[11]Yang T, Zhu XJ, Zhang ZX,et al.The effect of MgSO4on 2-keto-L-gulonic acid fermentation.J Shanghai Jiaotong Univ, 2008, 42(9): 1458−1460.杨涛, 朱欣杰, 张志雄, 等.MgSO4对 2-酮基-L-古龙酸发酵影响的实验研究.上海交通大学学报, 2008, 42(9):1458−1460.
[12]Zhou B, Li Y, Liu YP,et al.Microbiological eco-regulation in Vc two-step fermentation.Chin J Appl Ecol, 2002,13(11): 1452−1454.周彬, 李义, 刘耀平, 等.Vc二步发酵中的微生物生态调控.应用生态学报, 2002, 13(11): 1452−1454.
[13]Takagi Y, Sugisawa T, Hoshino T.Continuous 2-keto-L-gulonic acid fermentation from L-sorbose byKetogulonigenium vulgareDSM 4025.Appl Microbiol Biotech, 2009, 82(6): 1049−1056.
[14]Feng S, Zhang Z, Zhang CG,et al.Effect ofBacillus megateriumonGluconobacter oxydansin mixed culture.Chin J Appl Ecol, 2000, 11(1): 119−122.冯树, 张舟, 张成刚, 等.混合培养中巨大芽胞杆菌对氧化葡萄糖酸杆菌的作用.应用生态学报, 2000, 11(1):119−122.
[15]Jiang ZH, Xiong XH, Zhang WC,et al.Cloning and expression of an alcohol/aldehyde dehydrogenase gene ofKetogulonigenium vulgare.Lett Biotech, 2009, 20(5):629−631.姜泽慧, 熊向华, 张惟材, 等.酮古龙酸菌醇醛脱氢酶基因的克隆及表达.生物技术通讯, 2009, 20(5):629−631.
[16]Hao AY, Jia Q, Wu HT,et al.Isolation and characteristics research of L-sorbose dehydrogenase inKetogulonigeniumsp.WB0104.Ind Microbiol, 2008, 38(1): 10−14.郝爱鱼, 贾茜, 吴洪涛, 等.酮古龙酸菌 WB0104中 L-山梨糖脱氢酶的分离和性质研究.工业微生物, 2008,38(1): 10−14.
[17]Zhao SG, Yao LM, Su CX,et al.Purification and properties of a new L-sorbose dehydrogenase accelerative protein fromBacillus megateriumbred by ion-beam implantation.Plasma Sci Technol, 2008, 10(3): 398−402.
[18]Zhang W, Yan B, Wang J,et al.Purification and characterization of membrane-bound L-sorbose dehydrogenase fromGluconobacter oxydansGO112.Enzyme Microb Technol, 2006, 38(5): 643−648.
[19]Jiang YY, Guo ZY, Zhang CG.Study on the purification of 2-keto-L-gulonate reductase and its physical, chemical and enzymic properties.Chin J Biotech, 1997, 13(4): 400−405.蒋雨杨, 郭振勇, 张成刚.2-酮-L-古龙酸还原酶分离纯化及其理化、酶学性质的研究.生物工程学报, 1997,13(4): 400−405.
Enhancement of 2-keto-L-gulonic acid production using three-stage pH control strategy
Jing Zhang1,2, Jingwen Zhou1,2, Liming Liu1,2, Jie Liu3, Kejie Chen1,2, Guocheng Du2,and Jian Chen1,2
1 Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China 2 Biological Systems and Bio-processing Laboratory, School of Biotechnology, Jiangnan University, Wuxi 214122, China 3 Jiangsu Jiangshan Pharmaceutical Co., Ltd., Jingjiang 214500, China
Received:January 29, 2010;Accepted:April 27, 2010
Supported by:National Science Fund for Distinguished Young Scholars(No.20625619), National Basic Research and Development Program of China(973 Program)(No.2007CB 714306), Innovative Research Team for University of Jiangsu Province, National High Technology Research and Development Program of China(863 Program)(No.2006AA020303), Key Projects in the National Science and Technology Pillar Program during the Eleventh Five-Year Plan Period(No.2007BAI46B02).
Corresponding author:Jian Chen.Tel: +86-510-85918309; E-mail: jchen@jiangnan.edu.cn Liming Liu.Tel: +86-510-85918307; E-mail: mingll@jiangnan.edu.cn国家杰出青年基金(No.20625619),国家重点基础研究发展计划(973计划)(No.2007CB 714306),江苏高等学校优秀科技创新团队项目,国家高技术研究发展计划(863计划)(No.2006AA020303),“十一五”国家科技支撑计划(No.2007BAI46B02)资助。
