微生物发酵产二十二碳六烯酸代谢机理的研究进展
2010-10-16冯云任路静魏萍仝倩倩纪晓俊黄和
冯云,任路静,魏萍,仝倩倩,纪晓俊,黄和
南京工业大学生物与制药工程学院 材料化学工程重点实验室,南京 210009
微生物发酵产二十二碳六烯酸代谢机理的研究进展
冯云,任路静,魏萍,仝倩倩,纪晓俊,黄和
南京工业大学生物与制药工程学院 材料化学工程重点实验室,南京 210009
二十二碳六烯酸(简称 DHA)是一种重要的长链多不饱和脂肪酸,对人体具有重要的生理功能。微生物发酵生产的DHA与鱼油来源的DHA相比,具有诸多优点,其发展前景广阔。以下从发酵菌株、代谢途径、关键酶以及油脂积累机制等方面进行了综述,为通过代谢工程等技术手段进一步提高DHA产量提供了参考。
DHA,发酵,代谢途径,机理
Abstract:Docosahexenoic acid(DHA)is an important polyunsaturated fatty acid which is beneficial to human health.Compared with the DHA derived from fish oil, DHA by microbial production possesses many advantages, and has a bright prospect.In this article, we reviewed strains, metabolic pathway, key enzymes and mechanism of lipid accumulation for microbial production of DHA.Those information would be greatly helpful for further improving DHA production by metabolic engineering.
Keywords:DHA, fermentation, metabolic pathway, mechanism
多不饱和脂肪酸(PUFAs)是指含有2个或2个以上双键且碳链长度为18或18个以上碳原子的直链脂肪酸。根据第一个双键位置的不同,多不饱和脂肪酸可以分为ω-3型、ω-6型和ω-9型。其中,二十二碳六烯酸(Docosahexenoic acid,22:6△4,7,10,13,16,19,简称 DHA)俗称“脑黄金”,属 ω-3型多不饱和脂肪酸,具有多种重要的生理功能。DHA是人类大脑和视网膜组织中细胞膜的组成成分,对婴幼儿视觉和神经系统的发育有至关重要的作用;同时它在预防高血压、动脉硬化、关节炎以及癌症等疾病方面具有显著功效[1]。一些国家的科研机构建议,人们摄入的多不饱和脂肪酸至少应占摄入总脂的3%[2],应提高膳食中ω-3型多不饱和脂肪酸的比例。因此,DHA被作为功能性因子添加到保健食品和功能食品饮料中。
长期以来,DHA主要来源于深海鱼油,但存在诸多缺点,如鱼油质量会随着鱼的种类、捕捞季节和地点的不同而不同,含 EPA、易受环境污染、有鱼腥味、纯化成本高等。20世纪提出的“单细胞油脂”、“微藻油”是以微生物作为来源发酵得到的含多不饱和脂肪酸的油脂,已成为当前人们关注的热点。通过微生物发酵法制备DHA,与传统鱼油来源相比,具有微生物生长快,易于大规模培养;多不饱和脂肪酸含量高;不饱和脂肪酸成分单一,不含EPA或EPA含量低,易于分离纯化;氧化稳定性较好等优点,因此微生物发酵生产DHA可替代鱼油来源的DHA,具有广泛的应用前景。
1 生产DHA的微生物
目前,用于生产DHA的微生物主要是破囊壶菌Thraustochytrium、裂殖壶菌Schizochytrium和隐甲藻Crypthecodinium cohnii,研究情况见表1。

表1 发酵产DHA微生物研究情况Table 1 Strains for microbial production of DHA
破囊壶菌和裂殖壶菌都是属于Straminipila界、Heterokonta门、Labyrinthulea 纲、Thraustochytriales目、Thraustochytriales科的异养海洋原生生物[14],隐甲藻是属于双鞭藻类Dinoflagellate的异养海洋生物。其中裂殖壶菌分裂快、发酵周期短,是商业化生产DHA理想的生产菌之一。美国Martek公司利用Schizochytrium生产DHA,通过对发酵过程的优化调控,生物量干重达到170~210 g/L,其中50%是脂质,脂质中至少50%是DHA,最终DHA的产量高达40 g/L[15],是至今报道的最高水平。本课题组利用1 500 L发酵罐,采取分阶段溶氧调控策略,DHA产量达到37.75 g/L,产率为119 mg/(L·h),在国内处于领先水平[7]。
2 DHA合成途径
目前,提高生产菌合成含DHA油脂的能力主要是通过传统的生化工程途径来实现,即通过控制营养条件和环境条件使代谢流流向脂质合成的方向。而随着现代生物技术的迅速发展,对生产菌进行遗传改造为从根本上提高DHA合成能力提供了可能。但遗传改造的前提是明确这些生产菌中 DHA的合成途径,因此微生物体内DHA合成途径及其机制一直是研究的热点和重点内容。
2.1 脂肪酸合成酶(FAS)途径
在细胞质中脂肪酸合成酶 FAS(Fatty acid synthase)的作用下,由乙酰-辅酶A和丙二酸单酰-辅酶A经过缩合、还原、脱水、还原的循环,先合成16碳或18碳的饱和脂肪酸,然后在线粒体或微粒体上经过一系列延长酶和去饱和酶的交替作用最终合成长链多不饱和脂肪酸,如 γ-亚麻酸、花生四烯酸、DHA等(图1)。

图1 DHA合成的脂肪酸合成酶途径[16]Fig.1 Fatty acid synthase pathway for DHA biosynthesis[16].
脂肪酸合成酶是一个由多种酶构成的多酶复合体,包括酰基转移酶、烯酰ACP还原酶、脱水酶、酮酰ACP还原酶、酮酰ACP合成酶、磷酸泛酰巯基乙胺转移酶和酰基载体蛋白ACP。不同生物组织内该酶的结构形式略有不同,在动物中,该多酶复合体包含的所有酶定位于一个多肽链上;而在真菌中,这些酶分别定位为 2个功能的多肽链上。通过氨基酸序列对比发现,DHA生产菌中的脂肪酸合成酶与真菌中脂肪酸合成酶具有较高的同源性[17]。
此外,该途径中的延长酶和多种去饱和酶已经得到克隆、纯化和表达,如高山被孢霉Mortierella alpina中将 γ-亚麻酸(18:3ω-6)转化成双高亚麻酸(20:3ω-6)的延长酶[18],鲁西毛霉Mucor rouxii中的△ 6 去饱和酶[19],其中还包括一直备受争议的△4去饱和酶。为了探究△4去饱和酶是否存在,研究者们采用能够在体内积累 DHA(22:6ω-3)和 DPA(22:5ω-6)的破囊壶菌为研究对象进行了一系列研究,最终证明了△4去饱和酶的存在并阐明了其功能[20-24]。Thraustochytriumsp.的fad4基因编码△4去饱和酶,将fad4基因与表达载体连接构建出重组表达载体,分别导入酿酒酵母细胞和毕赤酵母进行表达,结果转化后的细胞可以利用外源添加的底物生成DHA。同时,放射性同位素标记实验也进一步证实Thraustochytriumsp.中确实存在△4去饱和酶,可以把外源提供的14C标记的 22:5(ω-3)转化成DHA。但是Thraustochytriumsp.中的△4去饱和酶是位于微粒体还是线粒体仍不确定,有待继续研究[25]。
2.2 多不饱和脂肪酸(PUFA)合成酶途径
Thraustochytriales科的裂殖壶菌不能将外源标记的22:5(ω-3)转化成DHA[21],因此裂殖壶菌可能不是通过传统的FAS途径合成DHA。Metz等[26]对ShewanellaSCRC2738和Schizochytriumsp.的基因组成进行研究,结果表明,ShewanellaSCRC2738的一段基因上存在5个开放阅读框,框中至少11个区域是编码酶的功能域,其中有8个功能域与PKS合成酶(Polyketide synthase)密切相关,Schizochytriumsp.的基因片段中也存在同样的结构域,由此提出Schizochytrium合成 DHA的途径类似于细菌中的PKS途径,称为PUFA合成酶途径。
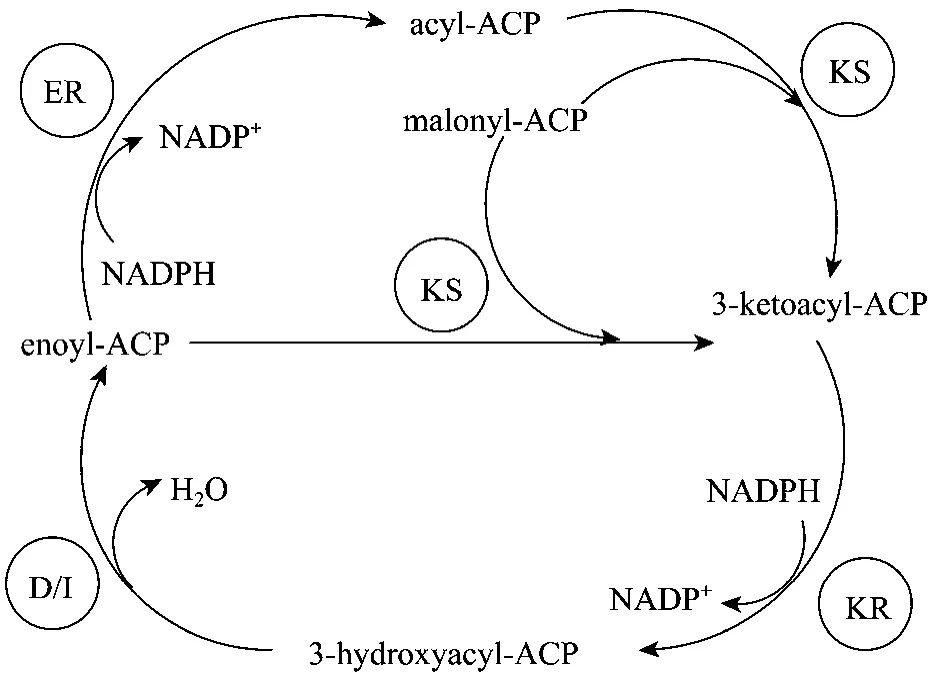
图2 DHA合成的多不饱和脂肪酸合成酶途径[25]Fig.2 Polyunsaturated fatty acid synthase pathway for DHA biosynthesis[25].KS: β-ketoacyl synthase; KR: β-ketoacyl-ACP reductase; D/I: dehydrase/isomerase; ER: enoyl reducatase.
该途径中也存在一个类似于脂肪酸合酶的多酶复合体——PKS合成酶,主要存在于海洋细菌和一些能合成多不饱和脂肪酸的真菌中[27],它包括β-酮酰合成酶、β-酮酰-ACP还原酶、烯酰还原酶、脱水酶/异构酶、酰基转移酶和酰基载体蛋白。在该多酶复合体作用下,乙酰-辅酶 A和丙二酸-单酰辅酶 A作为基本单位,通过缩合、还原、脱水、还原/异构的循环,合成DHA(图2)。与FAS途径一样,该途径也是以酰基载体蛋白(ACP)作为延长碳链的共价结合位点。但由于PKS合成酶与FAS合成酶在酶的组成上略有不同,PKS合成酶中存在一个脱水酶/异构酶,因此PKS途径不存在需氧去饱和引入双键的过程,而是在碳链延长过程中直接形成双键。
从表 2中列举的相关研究可以看出,Schizochytrium中DHA确实是通过PUFA合成酶途径合成,但是仍有许多问题没有解决,如裂殖壶菌中DPA(ω-6)是如何形成的;分类地位非常接近的破囊壶菌和裂殖壶菌中DHA合成途径不相同,而二者的脂肪酸组成却很相似[16],因此确切的 DHA合成机制还有待深入研究。

表2 多不饱和脂肪酸合成酶途径的研究概况Table 2 Studies of polyunsaturated fatty acid synthase pathway
3 DHA油脂积累机制
了解微生物油脂积累机制,特别是DHA合成途径中的关键酶,从而在分子水平上调控关键酶,对于发酵过程中脂质含量和 DHA产量的提高是极其重要的。
3.1 前提条件
乙酰辅酶A是脂肪酸合成的前体物质,在细胞质中持续产生乙酰辅酶A是油脂积累的前提条件之一。发酵过程中为了达到油脂积累的目的,通常将微生物培养在碳氮比高的培养基中,当氮源耗尽后,微生物可以继续吸收碳源,用于脂质合成。在产油酵母和部分真菌的培养过程中氮源的减少,可以引起细胞内的一系列反应(图3)[16],本课题组通过对代谢通量的分析也发现,氮减少后引起代谢流的迁移,使细胞内大量积累的乙酰辅酶A进入脂肪酸的合成[31]。
油脂积累的另一个前提条件是在细胞质中产生足够的NADPH,为脂肪酸合成提供还原力。本课题组在前期研究中发现,通过在发酵过程中添加苹果酸,可以促进 NADPH的生成,产生的总油脂与未添加相比提高了15%,脂肪酸中DHA含量从35%提高到60%[1]。
此外,本课题组利用亚硝基胍(NTG)和紫外照射对Schizochytriumsp.CCTCC M209059进行复合诱变,得到突变株Schizochytriumsp.HX-308M,通过对突变株的酶活分析可以看出,与野生型菌株相比,突变株中产乙酰辅酶A和NADPH的酶活力提高,细胞内乙酰辅酶A和NADPH的量显著增加,脂肪酸中DHA含量高达56.22%,比野生型菌株提高了38.88%[32]。由此可以看出,尽管破囊壶菌和裂殖壶菌中 DHA合成途径不同,但乙酰辅酶 A和NADPH是油脂有效积累的关键因素。

图3 氮限制引起的生理生化反应Fig.3 Physiological and biochemical responses to nitrogen limitation.
3.2 关键酶
柠檬酸裂解酶(ACL,EC 4.1.3.8)、乙酰辅酶A羧化酶(ACC,EC 6.4.1.2)和苹果酸酶(ME,EC 1.1.1.40)是启动脂肪酸合成的3个关键酶(图4)。
ACL催化柠檬酸裂解,反应如下,该酶催化的反应是脂肪酸合成所需乙酰-CoA的来源。
柠檬酸 + CoA + ATP →乙酰-CoA+草酰乙酸+ADP+Pi
ACC催化乙酰-CoA生成丙二酸单酰-CoA,是脂肪酸合成的起始步骤。分离编码ACC的基因并使其在受体菌中过表达,ACC活性显著升高并且丙二酸单酰-CoA大量增加,脂肪酸合成速率提高但是含量并没有显著增加,说明该酶催化的反应的确是脂肪酸合成的限速步骤,但脂肪酸含量的提高还受其他步骤的制约。
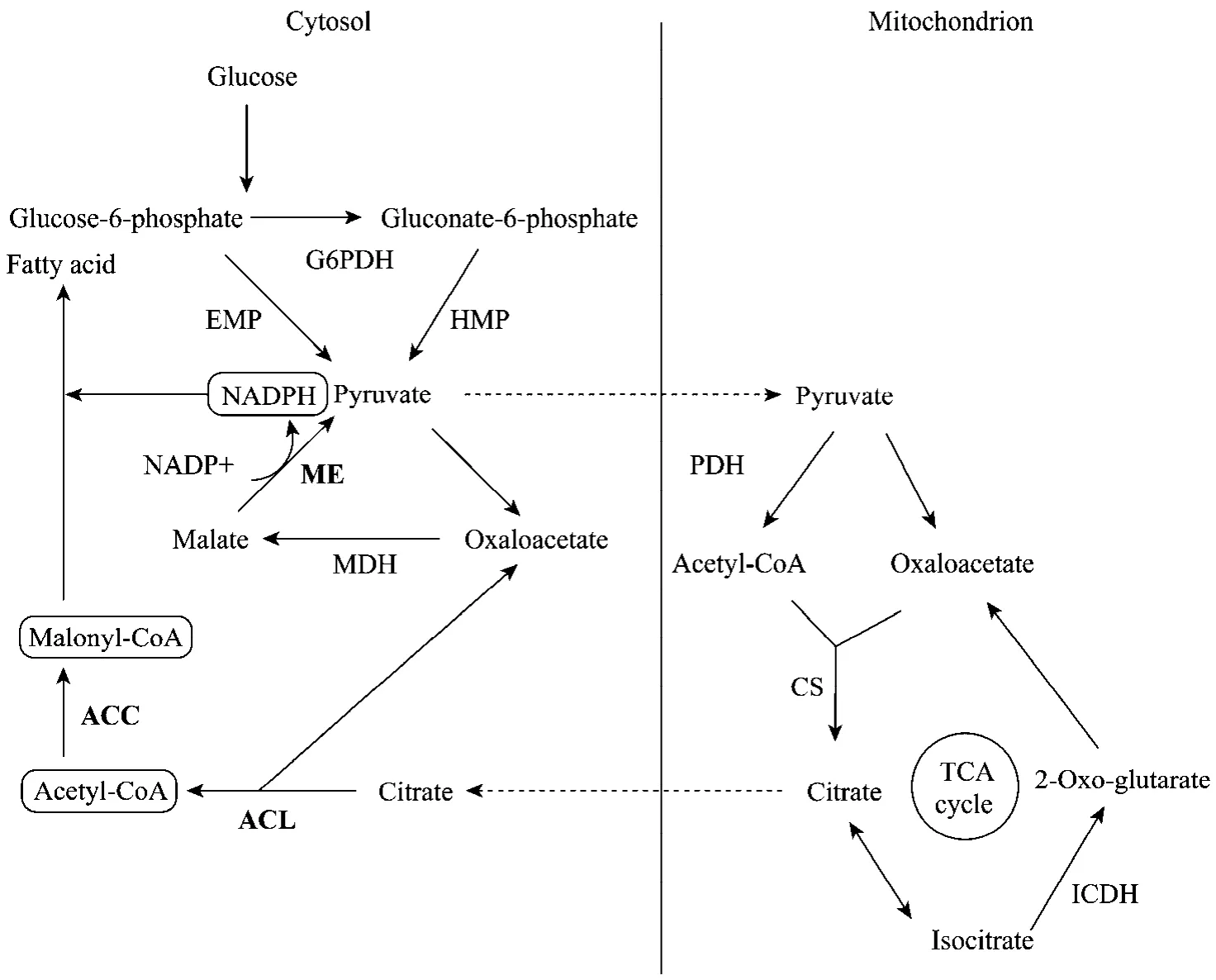
图4 脂肪酸合成的前体及涉及的关键酶Fig.4 Precursors for fatty acid synthesis and key enzymes involved in fatty acid synthesis.MDH: malate dehydrogenase; PDH:pyruvatedehydrogenase; CS: citrate synthase; ICDH: isocitrate dehydrogenase; G6PDH: glucose-6-phosphate dehydrogenase.
苹果酸酶催化苹果酸分解生成丙酮酸,同时将NADP+还原成NADPH,为脂肪酸合成提供还原力。有相关研究表明,上面提到的2种酶都与脂质的积累程度无关,而苹果酸酶活性的有无以及活性高低都与细胞内脂质积累的程度密切相关[33-34]。Song等[35]对苹果酸酶构型的研究表明,苹果酸酶的6种异构体中构型Ⅳ与脂质积累有关,构型Ⅲ和Ⅳ由同一基因编码,构型Ⅳ是构型Ⅲ在氮限制(以葡萄糖为碳源)或乙酸为唯一碳源的条件下启动的后转录修饰形成的。目前有关研究主要是以产 γ-亚麻酸的丝状真菌——卷枝毛霉为研究对象进行的,日后可以针对裂殖壶菌等产 DHA微生物内的苹果酸酶等关键酶进行研究,进一步明确它们与脂质积累和DHA合成之间的关系,为DHA产量的提高提供理论基础。
4 研究展望
近年来随着对 DHA生理及药用价值的深入研究,其预防心血管疾病、高血压、抗癌等生理功能也广泛为人们所接受,DHA的需求量大幅增加,DHA保健品和含DHA的功能食品、饮料等产品具有巨大的市场潜力。因此只有实现DHA的大规模工业化生产,提高 DHA产量和质量才能满足人们对DHA的需求。
提高DHA产量一直是微生物发酵产DHA研究的重点内容。现阶段的研究主要集中于培养条件和发酵条件的优化,这在一定程度上可以提高DHA的产量,但是效果并不明显,而代谢工程是从根本上提高DHA产量的重要途径。以上有关DHA合成途径、关键酶和油脂积累机理的研究是利用现代生物技术手段提高DHA发酵水平的基础和前提,今后的研究应该从以下几个方面展开:
1)继续深入研究 DHA合成途径,从而有针对性地对现有生产菌进行基因改造,选育DHA高产菌株,使其最大量的合成DHA。
2)进一步研究 DHA合成途径中的关键酶,分离并克隆关键酶基因,在分子水平对其进行调控和表达,从而提高DHA产量。
3)考察环境条件变化对细胞内能荷、还原力、关键代谢酶系酶活以及油脂积累的影响,从而获得DHA高效积累策略,提高DHA产率。
4)利用微生物油脂积累机理指导发酵,优化发酵工艺,从而使代谢流流向所需的目标产物,进一步提高DHA发酵水平。
REFERENCES
[1]Ren LJ, Huang H, Xiao AH,et al.Enhanced docosahexaenoic acid production by reinforcing acetyl-CoA and NADPH supply inSchizochytriumsp.HX-308.Bioproc Biosyst Eng, 2009, 32(6): 837−843.
[2]Gill I, Valivety R.Polyunsaturated fatty acids, part 1:occurrence, biological activities and applications.Trends Biotechnol, 1997, 15(10): 401−409.
[3]Singh A, Wilson S, Ward OP.Docosahexaenoic acid(DHA)production byThraustochytriumsp.ATCC20892.J Microbiol Biotechnol, 1996, 12(1): 76−81.
[4]Singh A, Ward OP.Production of high yields of docosahexaenoic acid byThraustochytrium roseumATCC 28210.J Ind Microbiol Biotechnol, 1996, 16(6): 370−373.
[5]Burja AM, Radianingtyas H, Windust A,et al.Isolation and characterization of polyunsaturated fatty acid producingThraustochytriumspecies: screening of strains and optimization of omega-3 production.Appl Microbiol Biotechnol, 2006, 72(6): 1161−1169.
[6]Perveen Z, Ando H, Ueno A,et al.Isolation and characterization of a novel thraustochytrid-like microorganism that efficiently produces docosahexaenoic acid.Biotechnol Lett, 2006, 28(3): 197−202.
[7]Ren LJ, Ji XJ, Huang H,et al.Development of a stepwise aeration control strategy for efficient docosahexaenoic acid production bySchizochytriumsp.Appl Microbiol Biotechnol, 2010, DOI: 10.1007/s00253-010-2639-7.
[8]Chi ZY, Pyle D, Wen ZY,et al.A laboratory study of producing docosahexaenoic acid from biodiesel-waste glycerol by microalgal fermentation.Process Biochem,2007, 2(11): 1537−1545.
[9]Naoki N, Yousuke T, Daisuke H.Optimization of culture conditions for growth and docosahexaenoic acid production by a marine Thraustochytrid,Aurantiochytrium limacinummh0186.J Oleo Sci, 2009, 58(12): 623−628.
[10]Silvina MR, Marcelo AS, Carlos GV,et al.Improvement of a two-stage fermentation process for docosahexaenoic acid production byAurantiochytrium limacinumSR21 applying statistical experimental designs and data analysis.Bioresource Technol, 2010, 101(7): 2367−2374.
[11]de Swaaf ME, de Rijk TC, Eggink G,et al.Optimization of docosahexaenoic acid production in batch cultivationsbyCrypthecodinium cohnii.J Biotechnol, 1999, 70(1):185−192.
[12]de Swaaf ME, Pronk JT, Sijtsma L.Fed-batch cultivation of the docosahexaenoic acid-producing marine algaCrypthecodinium cohniion ethanol.Appl Microbiol Biotechnol, 2003, 61(1): 40−43.
[13]de Swaaf ME, Sijtsma L, Pronk JT.High-cell-density fed-batch cultivation of the docosahexaenoic acid producing marine algaCrypthecodiniumcohnii.Biotechnol Bioeng, 2003, 81: 666−672.
[14]Raghukumar S.Ecology of the marine protists, the Labyrinthulomycetes(Thraustochytrids and Labyrinthulids).Europ J Protistol, 2002, 38(2): 127−145.
[15]Bailey RB, DiMasi D, Hansen JM,et al.Enhanced production of lipids containing poloyunsaturated fatty acids by very high density cultures of eukaryotic microbes in fermentors: US, 6607900.2003-08-19.
[16]Ratledge C.Fatty acid biosynthesis in microorganisms being used for single cell oil production.Biochimie, 2004,86(11): 807−815.
[17]Metz JG, Weaver CA, Kuner J.Schizochytrium fatty acid synthase(FAS)and products and methods related thereto:US, 0191679.2005-09-01.
[18]Parker-Barnes JM, Das T, Bobik E,et al.Identification and characterization of an enzyme involved in the elongation of n-6 and n-3 polyunsaturated fatty acids.Proc Natl Acad Sci USA, 2000, 97(15): 8284−8289.
[19]Laoteng K, Mannontarat R, Tanticharoen M,et al.Δ6-desaturase ofMucor rouxiiwith high similarity to plant Δ6-desaturase and its heterologous expression inSaccharomyces cerevisiae.Biochem Bioph Res CO, 2000,279(1): 17−22.
[20]Qiu X, Hong HP, MacKenzie SL.Identification of a Δ4 fatty acid desaturase fromThraustochytriumsp.involved in the biosynthesis of docosahexanoic acid by heterologous expression inSaccharomyces cerevisiaeandBrassica juncea.J Biochem, 2001, 276(34): 31561−31566.
[21]Meyer A, Cirpus P, Ott C,et al.Biosynthesis of docosahexaenoic acid inEuglena gracilis: biochemical and molecular evidence for the involvement of a Δ4-fatty acyl group desaturase.Biochemistry, 2003, 42: 9779−9788.
[22]Chen JQ, Jiang XZ, Liu LX,et al.Expression ofThraustochytriumsp.FJN-10 Δ4-desaturase gene inSaccharomyces cerevisiae.Microbiol China, 2007, 34(6):1154−1157.陈金卿, 江贤章, 刘丽霞, 等.海洋破囊壶菌Δ4-脂肪酸脱饱和酶基因在酿酒酵母中的表达.微生物学通报,2007, 34(6): 1154−1157.
[23]Liu LX, Jiang XZ, Tan WX,et al.Identification of the Δ4 fatty acid desaturase gene fromThraustochytriumsp.FJN10.Ind Microbiol, 2006, 36(1): 1−6.刘丽霞, 江贤章, 覃文新, 等.海洋真菌Thraustochytriumsp.FJN-10 Δ4脱饱和酶基因的 cDNA 克隆及结构分析.工业微生物, 2006, 36(1): 1−6.
[24]Kang DH, Anbu P, Kim WH,et al.Coexpression of Elo-like enzyme and ∆5, ∆4-desaturases derived fromThraustochytrium aureumATCC 34304 and the production of DHA and DPA inPichia pastoris.Biotechnol Bioproc E, 2008, 13(4): 483−490.
[25]Qiu X.Biosynthesis of docosahexaenoic acid(DHA,22:6-4,7,10,13,16,19): two distinct pathways.Prostag Leukotr Ess, 2003, 68(2): 181−186.
[26]Metz JG, Roessler P, Facciotti D,et al.Production of polyunsaturated fatty acids by polyketide synthases in both Prokaryotes and Eukaryotes.Science, 2001, 293:290−293.
[27]Weaver CA, Zirkle R, Doherty DH,et al.Chimeric PUFA polyketide synthase systems and uses thereof: US,0022422.2008-01-24.
[28]Huang JZ, Jiang XZ, Zhang XW,et al.Expressed sequence tag analysis of marine fungusSchizochytriumproducing docosahexaenoic acid.J Biotechnol, 2008, 138: 9−16.
[29]Hauvermale A, Kuner J, Rosenzweig B,et al.Fatty acid production inSchizochytriumsp.: involvement of a polyunsaturated fatty acid synthase and a type I fatty acid synthase.Lipids, 2006, 41(8): 739−747.
[30]Lippmeier JC, Crawford KS, Owen CB,et al.Characterization of both polyunsaturated fatty acid biosynthetic pathways inSchizochytriumsp.Lipids, 2009,44(7): 621−630.
[31]Jin MJ, Huang H, Zhang K,et al.Metabolic flux analysis on arachidonic acid fermentation.J Chem Eng Chin Univ,2007, 21(2): 316−321.金明杰, 黄和, 张昆, 等.应用代谢通量法分析花生四烯酸的合成过程.高校化学工程学报, 2007, 21(2):316−321.
[32]Lian M, Huang H, Ren LJ,et al.Increase of docosahexaenoic acid production bySchizochytriumsp.through mutagenesis and enzyme assay.Appl Biochem Biotechnol, DOI 10.1007/s12010-009-8865-8.
[33]Wynn JP, Hamid AA, Ratledge C.The role of malic enzyme in the regulation of lipid accumulation in filamentous fungi.Microbiology, 1999, 145: 1911−1917.
[34]Ratledge C, Wynn JP.The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms.Adv Appl Microbiol, 2002, 51: 1−51.
[35]Song Y, Wynn JP, Li Y,et al.A pre-genetic study of the isoforms of malic enzyme associated with lipid accumulation inMucor circinelloides.Microbiology,2001, 147: 1507−1515.
Progress in metabolic mechanism of docosahexenoic acid production by fermentation
Yun Feng, Lujing Ren, Ping Wei, Qianqian Tong, Xiaojun Ji, and He Huang
State Key Laboratory of Materials-Oriented Chemical Engineering, College of Biotechnology and Pharmaceutical Engineering, Nanjing University of Technology, Nanjing 210009, China
Received:May 9, 2010;Accepted:July 12, 2010
Supported by:Key Program of National Natural Science Foundation of China(No.20936002), National Basic Research and Development Program of China(973 Program)(Nos.2007CB707805, 2009CB724700), the Fifth of Six Projects Sponsoring Talent Summits of Jiangsu Province(No.2008-D-63),College Industrialization Project of Jiangsu Province(No.JH09-30).
Corresponding author:He Huang.Tel: +86-25-83172094; E-mail: biotech@njut.edu.cn国家自然科学基金重点项目(No.20936002),国家重点基础研究发展计划(973计划)(Nos.2007CB707805, 2009CB724700),江苏省六大人才高峰项目(No.2008-D-63),江苏省高校科研成果产业化推进项目(No.JH09-30)资助。
