两种人参皂苷糖苷酶的酶性质比较
2010-09-27陈娇娇,孙亚娟,金凤燮,鱼红闪
陈 娇 娇, 孙 亚 娟, 金 凤 燮, 鱼 红 闪
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
人参中含量较高的人参皂苷一般是多糖基的,如Rb1、Rc、Re等;低糖基的人参皂苷一般为稀有人参皂苷,如C-K、Rh2、Rh3、Rg4、Rg5等[1]。其中稀有人参皂苷具有重要的生物学功能,可提高其在肠道内的吸收率。稀有人参皂苷C-K等与人参皂苷Rb1都属于四环三萜达玛烷型二醇类皂苷,具有相同的母环结构,差别仅在侧链糖基不同[2]。目前,国内外有目的地改变多糖基人参皂苷的糖基进而制备稀有人参皂苷方面的报道相对较少[3]。本课题组通过多年研究,从微生物中筛选出Absidiasp.G8r产人参皂苷糖苷酶(Glc8)和Absidiasp.G4r产人参皂苷糖苷酶(Glc4),这两种酶可将人参皂苷Rb1水解生成人参皂苷F2。本文将这两种不同菌种所产的两种人参皂苷糖苷酶进行分离纯化,并对其酶学性质以及酶反应特性进行详细的比较研究,为酶法水解人参皂苷,制备高活性的稀有人参皂苷奠定基础。
1 材料与方法
1.1 材 料
菌种Absidiasp.G8r、Absidiasp.G4r ,大连工业大学生物与食品工程学院菌种保藏所提供;人参皂苷Rb1、Rd、F2等标准品,实验室自制;薄层层析板silica gel 60-F254,德国Merk公司生产。
1.2 方 法
1.2.1 培养基的制备
人参液体发酵培养基的制备:称取人参100 g粉碎倒入烧杯中并加入300 mL水,文火加热,熬煮7 h,注意补水。冷却后用纱布过滤,滤液于7 000 r/min下离心10 min,上清为人参浸出液,补水至200 mL制成人参浸出液备用。在12 mL的人参浸出液中加入48 mL 10°的麦芽汁,再加40 mL水补齐到100 mL,制成Glc8和Glc4液体发酵培养基,121 ℃湿热灭菌后待用。
1.2.2 微生物发酵及粗酶液的制备
将菌种Absidiasp.G8r和Absidiasp.G4r分别接种于灭菌后的培养基中,置于全温振荡器内,在30 ℃,160 r/min的条件下培养3~4 d。
将发酵培养好的发酵液,用8 000 r/min高速冷冻离心机离心15 min,收集上清液;在磁力搅拌条件下,缓慢加入已研磨好的硫酸铵粉末至75%饱和度;在4 ℃下静置1~2 h。再用高速冷冻离心机在13 000 r/min下离心20 min,收集蛋白质沉淀。沉淀用10 mL 20 mmol/L pH 5.0醋酸缓冲液溶解,装入透析袋,用相同缓冲液透析24 h,约每2 h更换一次缓冲液。透析结束后取出液体,在13 000 r/min下冷冻离心10 min,所得上清液即为粗酶液,放入冰箱保存待用。
1.2.3 酶液的提纯
分别取两种粗酶液用DEAE-Cellulose DE52离子交换柱进行分离提纯[4]。粗酶液上柱后先用20 mmol/L pH 5.0 HAc-NaAc缓冲液洗脱,然后用由此缓冲液配制的60、90、120、150、180、240 mmol/L的KCl溶液各50 mL进行梯度洗脱,每3 min收集1管,每管收集3 mL,紫外分光光度计280 nm下测定各管的紫外吸光值(OD),确定其蛋白含量。
1.2.4 SDS-聚丙烯酰胺凝胶电泳法测定酶蛋白的分子质量
样品经处理后,采用SDS-聚丙烯酰胺凝胶电泳法[5]测定酶的纯度与分子质量。所选用标准蛋白为:磷酸酶b(97.2 ku)、牛血清蛋白(66.4 ku)、卵清蛋(44.3 ku)、碳酸苷酶(29.0 ku)、胰蛋白酶抑制剂(20.1 ku)、溶菌酶(14.3 ku)。
1.2.5 酶活力的测定
用20 mmol/L pH 5.0 HAc-NaAc缓冲液溶解人参皂苷Rb1,制成5 mg/mL标准品溶液作为酶反应作用的底物。取0.1 mL底物溶液与0.1 mL酶液,于30 ℃下反应22 h,加入0.2 mL水饱和正丁醇终止反应,振荡、离心,取上层液作薄层层析检测,点样量为10 μL,展开剂展开,展开剂的配比为V(氯仿)∶V(甲醇)∶V(水)=7.0∶3.0∶0.5,喷10%H2SO4水溶液后在105 ℃加热10 min显色。应用Band-scan工具软件,进行产物含量分析。每小时生成1 μmol人参皂苷F2所需的酶量定义为1个酶活力单位(U/mL)[6-7]。
2 结果与讨论
2.1 两种人参皂苷糖苷酶的分离纯化及分子质量的测定
将Glc8和Glc4粗酶液经DEAE-Cellulose DE52离子交换柱层析分离提纯,用自动部分收集器收集,将盐梯度细化,把相对纯的酶回收重新上柱,进行反复纯化,最终得到提纯蛋白,进行SDS-聚丙烯酰胺凝胶电泳检测,结果见图1所示。
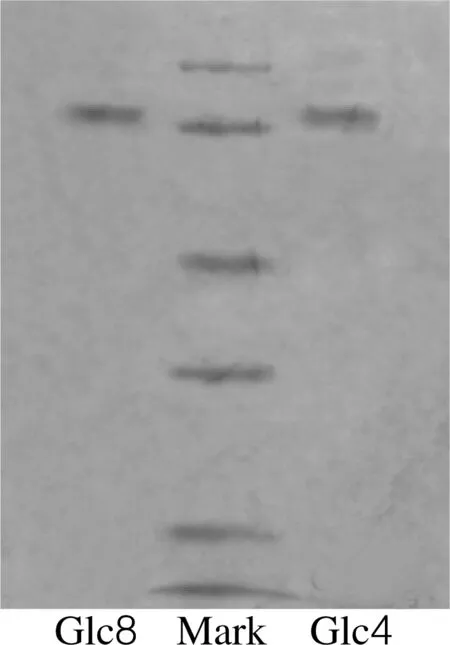
图1 纯化酶的SDS-聚丙烯酰胺凝胶电泳图Fig.1 Polyaerylamide gel SDS electrophoresis of dioscin glycosidase
由图1可以看出,Glc8 和Glc4两种人参皂苷糖苷酶在电泳图上是单带,通过待测蛋白质的迁移率来计算其分子质量,Glc8和Glc4的分子质量均为71~72 ku。
2.2 Glc8和Glc4的酶学性质的研究
2.2.1 pH 值对酶反应的影响
分别取pH 2.2、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0的缓冲溶液配置的质量浓度为5 mg/mL底物溶液 (人参皂苷Rb1) 0.1 mL与0.1 mL酶液均匀混合,在30 ℃下反应,然后加入0.2 mL水饱和正丁醇终止酶反应,取上层液作薄层层析检测,计算相对酶活力,确定酶反应的pH值,其结果如图2所示。由图2可知,Glc8和Glc4在pH值为5.0左右时相对酶活力最高,当pH小于5.0或大于5.0时,相对酶活力随着pH值的变化而下降,说明Glc8和Glc4在中性偏酸的环境下酶活力较高,在过酸或过碱的环境下反应活性很低。因此,将Glc8和Glc4酶反应的最适pH值定为5.0。

图2 pH 值对Glc8和Glc4相对酶活力的影响Fig.2 Effect of pH on Glc8 and Glc4 relative activity
2.2.2 温度对酶反应的影响
在底物质量浓度为5 mg/mL,pH 5.0的反应条件下,取0.1 mL底物溶液(人参皂苷Rb1)与0.1 mL酶液混合,分别于20、30、40、50、60、70、80 ℃下反应。然后加入0.2 mL水饱和正丁醇终止酶反应,振荡、分层,取上层液作薄层层析检测,计算相对酶活力,确定酶反应的最适温度,其结果如图3所示。由图3可知,Glc8和Glc4在30 ℃时相对酶活力最高,说明Glc8和Glc4在30 ℃时反应活性较高,比较耐热;当温度小于30 ℃或温度大于30 ℃时,酶反应活性都随着温度的变化而急剧下降,说明这两种酶在较低温度或较高温度下反应活性很低,受温度影响较大。因此,Glc8和Glc4的最适反应温度为30 ℃。

图3 温度对Glc8和Glc4相对酶活力的影响Fig.3 Effect of temperature on Glc8 and Glc4 relative activity
2.2.3 金属离子对酶反应的影响
以人参皂苷Rb1为酶反应底物,选用6种不同的金属离子(K+、Na+、Mg2+、Zn2+、Ca2+、Cu2+),以不同浓度加入酶反应体系,于30 ℃,pH 5.0 的条件下反应22 h,用水饱和正丁醇终止酶反应,振荡、分层,取上层液作薄层层析检测,计算相对酶活力,可以测定金属离子对Glc8(或Glc4)酶反应的影响,结果见表1。
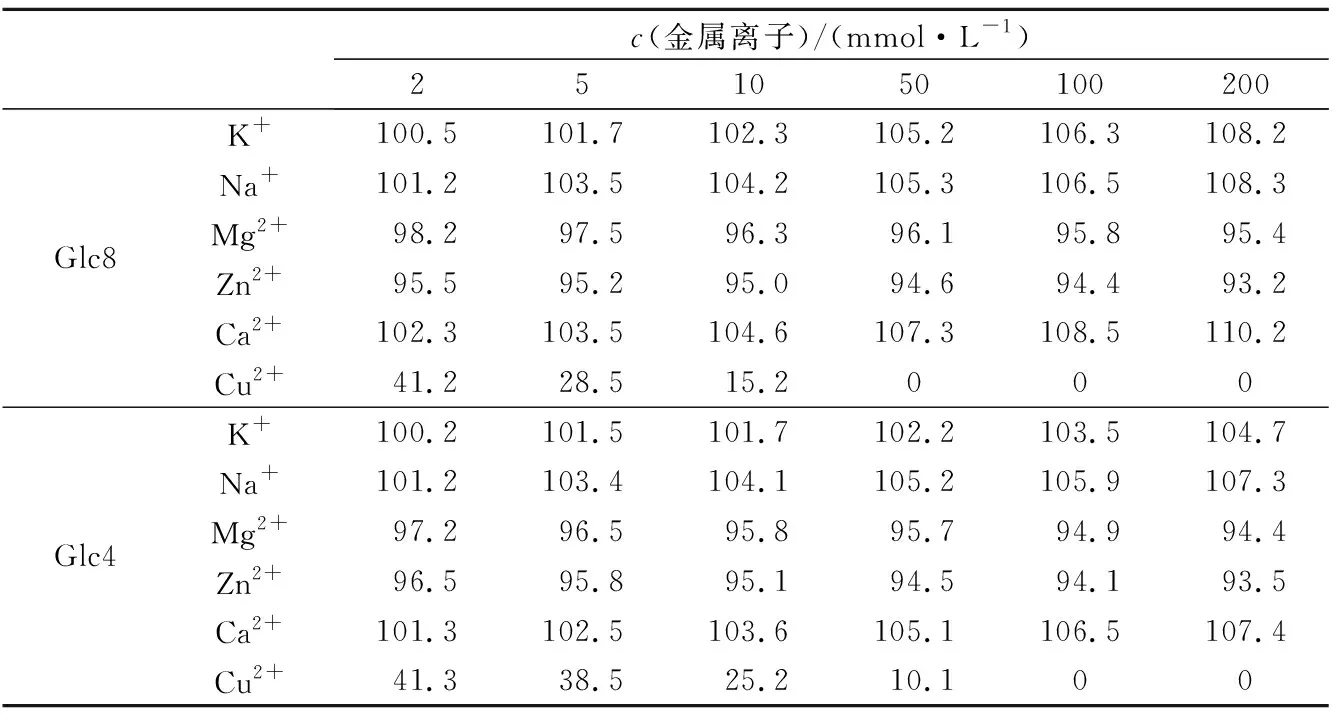
表1 金属离子对Glc8和Glc4的酶活力影响Tab.1 Effect of metal ions on enzyme activity
由表1可知,金属离子K+、Na+、Mg2+、Zn2+、Ca2+对Glc8和Glc4的酶反应影响不大;而Cu2+不同程度地对Glc8G和Glc4有明显的抑制作用。
2.3 Glc8和Glc4的酶反应特性
2.3.1 Glc8和Glc4与苷类物质为底物的反应
将Glc8(或Glc4) 酶液0.1 mL与质量浓度为5 mg/mL的不同底物(金丝桃苷、橙皮苷、槲皮苷、异槲皮苷、柚皮苷、淫羊藿苷、芦丁、柴胡皂苷、虎眼万年青皂苷、白头翁皂苷、朱砂根皂苷、穿山龙薯蓣皂苷、黄芪皂苷) 溶液等体积混合,于30 ℃、pH 5.0的条件下反应22 h,然后用0.2 mL水饱和正丁醇终止酶反应,振荡、分层,取上层液作薄层层析检测,计算转化率,结果见表2。
由表2可知,两种酶液均可水解金丝桃苷C-3位末端上的一个α-Gal,也可水解异槲皮苷、淫羊藿苷、人参皂苷Rb1母环末端的β-Glc,对其他母环侧链末端带有α-Rha的苷类物质均没有水解作用。因此,两种酶具有专一性水解母环末端的α-Gal、β-Glc键的特异性。
2.3.2 Glc8和Glc4与pNP系列底物的反应
由表3可知,两种酶对pNP-β-D-Glc和pNP-α-D-Gal有很好的水解作用,对pNP-β-D-Gal和pNP-α-D-Glc的水解能力极低,对pNP-α-L-Rha完全没有水解作用。这一结果,同上面的与苷类物质为底物的反应结果相似,两种酶均可水解pNP母环末端的α-Gal、β-Glc键。

表2 Glc8和Glc4 的酶反应特性Tab.2 Research of Glc8 and Glc4 reaction characteristics

表3 Glc8和Glc4与pNP系列底物的反应Tab.3 The reaction of Glc8 and Glc4with pNP series
3 结 论
通过将菌种Absidiasp.G8r产的人参皂苷糖苷酶和Absidiasp.G4r产的人参皂苷糖苷酶进行分离纯化和对它们的酶性质和酶学特性的研究,得出二者的分子质量、酶性质和酶学特性相同,最终确定这两种菌种产的是同一种人参皂苷糖苷酶。二者的分子质量均为71~72 ku,最适酶反应pH是5.0,最适酶反应温度30 ℃,金属离子K+、Na+、Mg2+、Zn2+、Ca2+对酶反应的影响不大,Cu2+对人参皂苷糖苷酶有很明显的抑制作用;同时,两种酶液均可水解金丝桃苷C-3位末端上的一个α-Gal,也可水解异槲皮苷、淫羊藿苷、人参皂苷Rb1母环末端的β-Glc,对其他母环侧链末端带有α-Rha的苷类物质均没有水解作用;同时,两种酶均可水解pNP母环末端的α-Gal、β-Glc键。因此,两种酶具有专一性水解母环末端的α-Gal、β-Glc键的特异性。
[1] 王铁生. 中国人参[M]. 沈阳:辽宁科技出版社, 2001:697.
[2] 张树臣. 中国人参[M]. 上海:上海科技教育出版社, 1992:12-17.
[3] 周伟,周珮. 稀有人参皂苷Compound-K研究进展[J]. 药科学报, 2007, 42(9):917-923.
[4] 北京大学生物系生物化学教研室. 生物化学实验指导[M]. 北京:高等教育出版社, 1984:240.
[5] 李建武. 生物化学实验原理和方法[M]. 北京:北京大学出版社, 1997:216-223.
[6] 邵巍, 金凤燮, 鱼红闪. GS0202菌产人参皂苷-β-葡萄糖苷酶条件及其酶的反应条件[J]. 大连工业大学学报, 2008, 27(1):30-33.
(SHAO Wei, JIN Feng-xie, YU Hong-shan. Production and characterization of ginsenoside-β-glucosidase from bacteria GS0202[J]. Journal of Dalian Polytechnic University, 2008, 27(1):30-33.)
[7] YU Hong-shan, MA Xiao-qun, GUO Yong, et al. Production and characterization of ginsenoside-β-glucosidase[J]. Journal of Ginseng Research, 1999, 23(1):50-54.
