海参溶菌酶基因克隆及在毕赤酵母中的表达与纯化
2010-09-27谷跃峰,丛丽娜,骆宁
谷 跃 峰, 丛 丽 娜, 骆 宁
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
溶菌酶(Lysozyme,EC3.2.1.17)是一种碱性球蛋白,该酶主要通过水解细菌细胞壁N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的β-1,4糖苷键,破坏肽聚糖支架,导致细胞壁破裂内容物逸出,从而使细菌溶解的。人和动物细胞无细胞壁结构亦无肽聚糖,故溶菌酶对人体和动物细胞无毒性作用,所以作为天然防腐剂的溶菌酶在食品工业中有广阔的应用价值[1]。溶菌酶的来源十分广泛,已知的可分为6类:c-型、g-型、i-型、植物溶菌酶、细菌溶菌酶和噬菌体溶菌酶[2]。海参溶菌酶即属于i-型溶菌酶。巴斯德毕赤酵母(Pichiapastoris)表达系统是目前分子生物学领域中用于表达重组蛋白的标准工具之一[3],该系统具有高表达、高稳定性、高分泌、表达后加工、高密度发酵培养等优点。目前已有数百种外源蛋白在该表达系统中成功表达[4],其中也有研究者成功表达出了溶菌酶[5-6],但 i-型溶菌酶在毕赤酵母中表达的研究还未见报道。本实验就是研究SJL在毕赤酵母中表达的可行性。
1 材料与方法
1.1 材 料
1.1.1 菌种与试剂
海刺参,由大连獐子岛渔业集团提供;毕赤酵母GS115、表达载体pPIC9K和Trizol试剂等,Invitrogen公司;大肠杆菌DH5α、克隆载体pMD18-T、限制性核酸内切酶(EcoRⅠ、NotⅠ、BglⅡ)、TaKaRa one step RNA PCR Kit (AMV),TaKaRa Biotechnology(大连)公司;普通琼脂糖凝胶DNA回收试剂盒,TIANGEN生化科技(北京)有限公司;G418,德国Merck公司。
1.1.2 培养基
YPD:1%酵母提取物,2%胰蛋白胨,2%葡萄糖,1.5%琼脂粉。用于菌体的生长、筛选及保藏。
MD:1.34%酵母氮源(YNB),2%葡萄糖,4×10-7生物素,1.5%琼脂粉。用于筛选菌株的表现型。
MM:1.34%酵母氮源,0.5%甲醇(体积分数),4×10-7生物素,1.5%琼脂粉。用于筛选菌株的表现型。
BMGY:1%酵母提取物,2%胰蛋白胨,100 mmol/L磷酸钾缓冲液(pH 6.0),1.34%酵母氮源,4×10-7生物素,1%甘油。用于诱导表达前菌体的生长。
BMMY:1%酵母提取物,2%胰蛋白胨,100 mmol/L磷酸钾缓冲液(pH 6.0),1.34%酵母氮源,4×10-7生物素,0.5%甲醇。用于诱导表达。
1.2 方 法
1.2.1 引物设计
根据SJL基因的CDS区序列,使用软件Primer Premier 5.0设计特异性引物,上、下游引物分别命名为HS-1和HS-2,其中分别在上游引物中引入EcoRⅠ酶切位点,下游引物中引入NotⅠ酶切位点,如下:
HS-1:5′--GCAGAATTCATGCAAGTTCCTTCTGATTGC--3′
HS-2:5′--AAGTTTGCGGCCGCTCAGTTGTTGCTCAT--3′
1.2.2 SJL基因的扩增
从新鲜的海参肠组织中利用Trizol试剂法提取总RNA,并以此为模板,利用TaKaRa one step RNA PCR Kit (AMV)试剂盒和设计好的引物,通过一步法RT-PCR扩增SJL基因。PCR循环参数为:50 ℃ 30 min,94 ℃ 2 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。将SJL基因连接到克隆载体pMD18-T上,构建重组质粒pMD18-T-SJL,并将其转化到大肠杆菌DH5α中,挑阳性菌落,经菌落PCR鉴定后送交TaKaRa Biotechnology(大连)公司测序验证。
1.2.3 重组毕赤酵母的构建
从验证正确的菌株中回收pMD18-T-SJL,用EcoRⅠ和NotⅠ双酶切,回收SJL基因,连接到同样经双酶切的表达载体pPIC9K中,构建真核重组表达质粒pPIC9K-SJL。再将pPIC9K-SJL经BglⅡ线性化后,采用PEG1000转化法将其转化至毕赤酵母GS115中,构建重组毕赤酵母,挑取单菌落。同时构建阴性对照菌株,即将不包含SJL基因的表达载体pPIC9K转化至毕赤酵母GS115中。将得到的单菌落分别点在MD和MM培养基上,通过比较生长速度来确定得到的菌株的表型,再经含梯度浓度G418(0.25~4.0 mg/mL)的YPD培养基筛选出高拷贝阳性菌株,从中筛选出有活性的菌株。
1.2.4 SJL的诱导表达发酵分析
将重组毕赤酵母菌株接种于10 mL BMGY液体种子培养基中,30 ℃摇床培养18 h。再按10%接种量转接至25 mL BMGY液体培养基,30 ℃摇床扩大培养18 h,离心收集菌体。将细胞沉淀全部转移至25 mL BMMY液体发酵培养基中,28 ℃摇床培养,每隔24 h取样,并补加甲醇(终体积分数为0.5%)。96 h后结束诱导表达,通过SDS-PAGE电泳分析表达情况。
1.2.5 SJL表达产物纯化
将诱导表达后的发酵液经4 000 r/min离心,收集上清液。在上清液中加入硫酸铵至饱和度达40%,4 ℃沉淀过夜后离心,取上清液,补加硫酸铵至饱和度达到60%,4 ℃沉淀过夜后离心,沉淀用0.02 mol/L的磷酸钠缓冲液(pH 6.0)溶解、透析,得到粗酶液。
称取12 g CM52-纤维素,用蒸馏水浸泡后装柱,经预处理后将粗酶液上柱,先用0.02 mol/L的磷酸钠缓冲液(pH 6.0)洗脱,再用由缓冲液配制的KCl溶液(60、120、180、240、300 mmol/L)进行分级梯度洗脱,体积流量为1 mL/min。用分布收集器收集(每管收集3 mL)。取峰值管中的流出液,用SDS-PAGE电泳检测。采用Bradford方法[7]分别测定诱导表达后和纯化后的蛋白含量,比浊法[8]测定表达后和纯化后的酶活力。
2 结果与讨论
2.1 SJL基因的扩增结果
从新鲜的海参肠组织中提取总RNA,并用1%的琼脂糖凝胶电泳检测,结果见图1。提取的RNA条带清晰,28S rRNA和18S rRNA条带之间没有模糊条带,提取成功,可用作模板进行RT-PCR。RT-PCR产物用1.2%的琼脂糖凝胶电泳检测,结果见图2。在图中约400 bp处有明显的条带,而且条带明亮,扩增成功。

M,500 bp DNA Marker;1,提取的总RNA样品图1 总RNA提取Fig.1 Extraction of total RNA

M,100 bp DNA Marker;1,SJL的PCR产物;2,阴性对照
2.2 重组毕赤酵母的构建
重组表达载体pPIC9K-SJL转化毕赤酵母GS115后,涂布于MD固体培养基上,挑取单菌落,所有菌株均为组氨酸利用正常型,即His+型。再经MD和MM固体培养基确定其表型均为Muts,即甲醇利用缓慢型,与理论相符。经G418筛选,在质量浓度为4.0 mg/mL的YPD平板培养基上,共得到7株有活性的高拷贝转化子,并通过菌落PCR验证,引物为HS-1和HS-2,结果见图3。图中显示泳道2在400 bp处有条带,而作为阴性对照的泳道1在此处没有条带,说明菌株中确实含有SJL基因。

M,100 bp DNA Marker;1,阴性对照;2,重组毕赤酵母
2.3 SJL的诱导表达发酵结果
重组SJL毕赤酵母菌株经甲醇诱导表达液体发酵,并定时取样分析。将处理的样品经12%的SDS-PAGE凝胶电泳检测,结果见图4。泳道1为阴性对照,在14.3 ku处无条带,而泳道2~5分别为24、48、72、96 h时取的样品,在14.3 ku处均有条带,而且72 h时表达量最高。表达出的蛋白分子质量大小与鸡蛋清溶菌酶的相符。
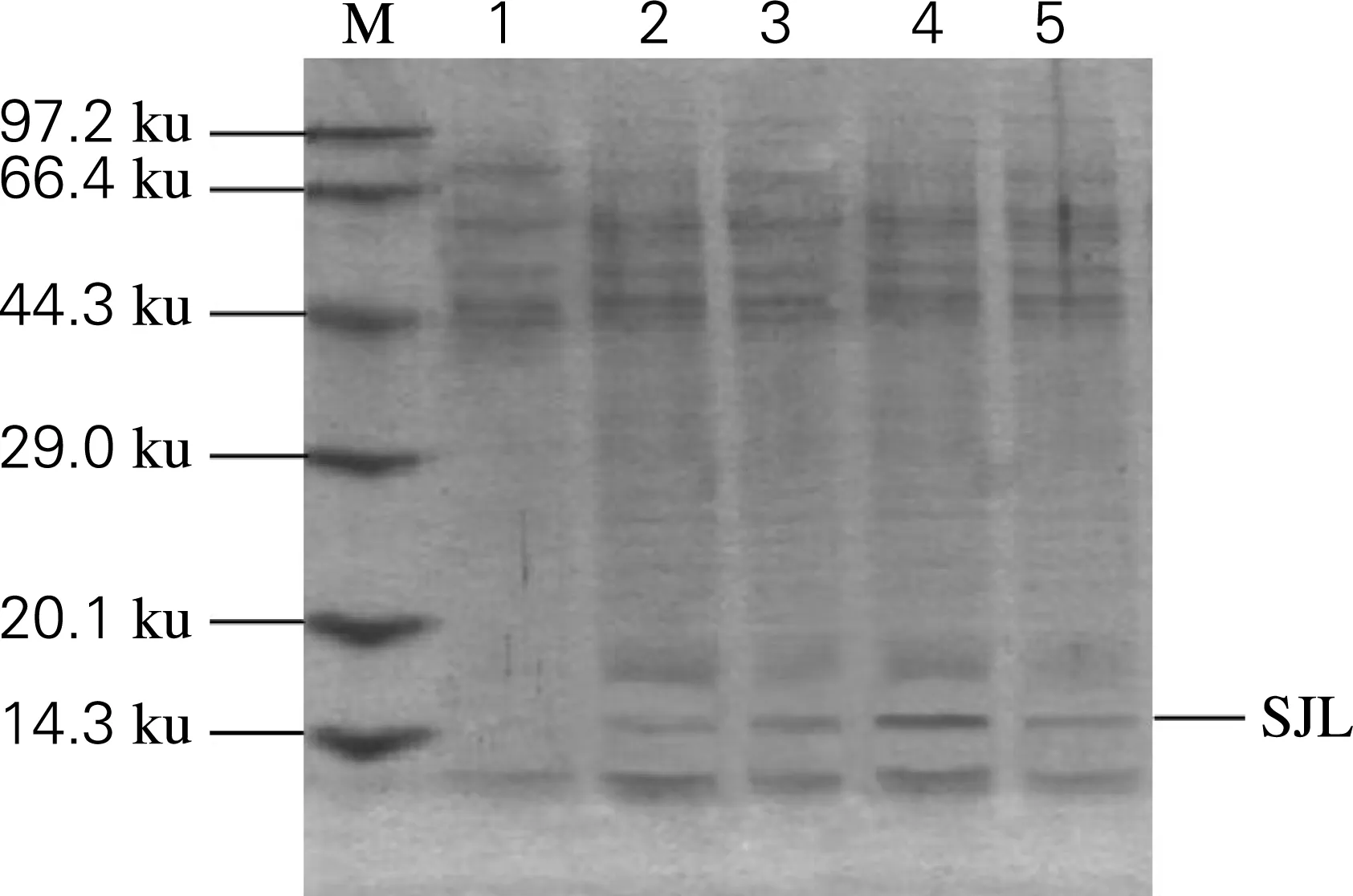
M,Protein MW Marker;1,阴性对照;2~5,诱导24~96 h时发酵上清液图4 SJL诱导表达的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the expressed SJL
2.4 SJL表达产物的纯化
发酵液的上清液经硫酸铵沉淀和离子交换层析后,其纯化结果见图5。利用Bradford方法测得表达后和纯化后的蛋白总量,比浊法测定表达后和纯化后的总活力。经计算,表达后的发酵上清液的比活力为6.3 U/mg,纯化后的SJL比活力为26.9 U/mg,纯化倍数为4.3倍,总活力回收率为28.1%。

M,Protein MW Marker;1,硫酸铵沉淀后粗酶液;2,纯化后的SJL图5 纯化后的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the purified SJL
3 结 论
目前,海参溶菌酶(SJL)基因的全序列测序工作已由本实验室完成并提交到GenBank[9],并且SJL已经在大肠杆菌中得到了成功表达[10],但产品得率较低,原因是SJL在胞内表达以包涵体形式存在,所以纯化步骤较繁琐。由于SJL来源于真核细胞,所以在理论上真核细胞比原核细胞更有利于该酶的表达,而且毕赤酵母的翻译后修饰功能,能够使SJL得到正确的加工和折叠。另外,分泌型表达载体pPIC9K的使用,也促使该纯化过程比原核细胞的胞内表达得到简化。本研究结果表明,SJL已在毕赤酵母中得到成功的表达,纯化后的比活力为26.9 U/mg,比在大肠杆菌中表达纯化后的比活力[10]提高了40%,但与天然SJL相比仍存在一定的差距[11]。影响SJL产量和活性的因素很多,如培养条件、外源基因自身结构特性、蛋白酶降解、糖基化及纯化工艺等。因此,今后还要对发酵条件和纯化工艺作进一步研究,必要时还可对菌种进行改良。
i-型(i-type)溶菌酶作为溶菌酶家族的一个新成员,近年来得到了广泛的研究[12]。该重组海参溶菌酶毕赤酵母工程菌的成功构建为进一步研究海洋生物新型溶菌酶的生物活性及其工业化生产奠定了基础。
[1] 戴清源,陈祥贵,李晓霞,等. 溶菌酶的研究进展[J]. 山东食品发酵, 2005(3):23-25.
[2] PRAGER E M, WILSON A C, ARNHEIM N, et al. Widespread distribution of lysozyme in egg white of birds[J]. The Journal of Biological Chemistry, 1974, 249(22):7295-7297.
[3] LI P, ANUMANTHAN A, GAO X G, et al. Expression of recombinant proteins inPichiaPastoris[J]. Applied Biochemistry and Biotechnology, 2007, 142(2):105-124.
[4] DALY R, HEARN M T. Expression of heterologous proteins inPichiapastoris:a useful experimental tool in protein engineering and production[J]. Journal of Molecular Recognition, 2005, 18(2):119-138.
[5] 胡乔,赵凌侠,唐克轩,等. 在毕赤酵母中表达人溶菌酶蛋白的研究[J]. 上海交通大学学报, 2008, 26(3):233-236.
[6] HAO Wen-jing, LI Gang-qiang, XU Miao-yun, et al. Induction and expression of T4 lysozyme gene inPichiapastoris[J]. Journal of Chinese Pharmaceutical Sciences, 2007, 54(1):33-37.
[7] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72:248-254.
[8] 张树政. 酶制剂工业[M]. 北京:科学出版社, 1998:810-811.
[9] 杨西建,丛丽娜,路美玲,等. 海参i型溶菌酶基因及其编码产物的结构特点[J]. 中国生物化学与分子生物学报, 2007, 23(7): 542-547.
[10] 王秀霞,丛丽娜,王丹,等. 海刺参i型溶菌酶基因的重组表达及抑菌谱分析[J]. 生物工程学报, 2009, 25(2):189-194.
[11] 李英辉,丛丽娜,朱蓓薇. 海参肠中溶菌酶的分离纯化及其酶学性质[J]. 大连工业大学学报, 2008, 27(3):193-196.
(LI Ying-hui, CONG Li-na, ZHU Bei-wei. Purification and characterization of lysozyme from the intestine of sea cucumber[J]. Journal of Dalian Polytechnic University, 2008, 27(3):193-196.)
[12] CALLEWAERT L, MICHIELS CW. Lysozymes in the animal kingdom[J]. Journal of Biosciences, 2010, 35(1):127-160.
