张氏肝细胞胰岛素抵抗模型的建立及鉴定
2010-09-27李铖铖,王际辉,王晗,叶淑红
李 铖 铖, 王 际 辉, 王 晗, 叶 淑 红
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
目前为止,二型糖尿病已经发展成为世界上最流行的代谢疾病之一。导致糖尿病发生的原因很多,包括环境因素、遗传因素和生活习惯[1]。胰岛素抵抗贯穿二型糖尿病的发生发展全过程。针对胰岛素抵抗的研究中,研究者已经成功复制多种胰岛素抵抗细胞模型[2-3]。目前使用的肝细胞模型大多来源于人肝癌细胞(HepG2),种类单一,也有一些研究表明有些肿瘤细胞本身也存在着胰岛素抵抗[4]。张氏肝细胞是人永生化正常肝细胞株,具有人类肝细胞的特征,其表面表达高亲和力的胰岛素受体满足典型胰岛素受体所要求的标准,包括葡萄糖的摄取、糖原合成酶的活性、脂类生成及RNA的合成[5]。本文模拟机体胰岛素抵抗的发病机制及其病理生理学特点,探讨高浓度胰岛素体外诱导培养法建立张氏肝细胞胰岛素抵抗模型的可能性,为研究胰岛素抵抗的发生发展机制及筛选改善胰岛素抵抗的药物提供一种简便可靠的胰岛素抵抗细胞模型。
1 实 验
1.1 实验材料
张氏肝细胞购于中科院上海细胞库;RPMI 1640培养液(250 mL培养液中含300 mg/L谷氨酰胺,2 000 mg/L碳酸氢钠)购于美国Thermo公司;胎牛血清(FBS)、青霉素和链霉素购于美国Gibico公司;四甲基偶氮唑盐(MTT)、牛胰岛素和胰蛋白酶购于美国Sigma公司;葡萄糖测定试剂盒购于上海荣盛生物技术有限公司;二甲基亚砜(DMSO)购于大连沈联化学仪器厂。
1.2 实验方法
1.2.1 细胞培养
张氏肝细胞复苏后用含灭活的15%FBS的RPMI 1640培养液转入玻璃培养瓶中,5% CO2、37 ℃饱和湿度条件下常规方法培养[5],每2天换液,每5天用0.25%胰蛋白酶消化,1∶3比例传代培养,取对数生长期的细胞用于实验。MTT法测定细胞活力[6],张氏肝细胞以2×104个细胞/孔接于96孔板,于含15%FBS的RPMI 1640培养液中培养24 h。将培养液更换为无血清的RPMI 1640培养液中添加10、50、100、500和1 000 nmol/L浓度的牛胰岛素,孵育20 h后,弃培养液并向每孔加入100 μL MTT溶液(将MTT以0.5 mg/mL溶于无血清的RPMI 1640培养液),继续孵育4 h后每孔加入150 μL DMSO溶解结晶甲瓒,振荡10 min,用酶标仪测定570 nm处吸光度值。
1.2.2 张氏肝细胞胰岛素抵抗模型的建立
1.2.2.1 最佳浓度的确定
采用高浓度胰岛素体外诱导培养法建立张氏肝细胞胰岛素抵抗细胞模型[7]。将处于对数生长期的细胞消化后,以1×105个细胞每孔接于24孔板中培养,用含15%FBS的RPMI 1640培养液培养24 h,待细胞贴壁后,更换培养液为1%FBS和含不同浓度(10、50、100、500和1 000 nmol/L)牛胰岛素的RPMI 1640培养液,设不含胰岛素组为对照组,在5% CO2、37 ℃饱和湿度条件下继续培养24 h。
1.2.2.2 最佳作用时间的确定
确定胰岛素作用最佳浓度后,重复“1.2.2.1”方法,设不含胰岛素组为对照组,模型组加入新配制的含有最佳作用浓度的胰岛素培养液,胰岛素作用时间分别为12、24、36和48 h。
1.2.2.3 模型的鉴定
采用葡萄糖测定试剂盒,将“1.2.2.1”和“1.2.2.2”所述细胞更换无血清RPMI 1640培养液,在5% CO2、37 ℃和饱和湿度条件下继续培养24 h后测定培养液中葡萄糖含量,将试剂1和试剂2等比例混合配成1 mL工作液,并充分混匀,24孔板每孔取10 μL培养液加至工作液中,设空白管和标准管,充分混匀,37 ℃保温15 min,于505 nm处测定各管吸光度,根据测定管与标准管吸光空度比值即可算出培养液中葡萄糖含量。培养液中葡萄糖含量与无血清RPMI 1640培养液中葡萄糖含量差值即为每孔细胞葡萄糖消耗量(mmol/L),将此葡萄糖消耗量作为鉴定细胞胰岛素抵抗模型的指标。
1.2.3 模型持续时间的研究
胰岛素抵抗细胞模型持续时间的研究采用“1.2.2.1”和“1.2.2.2”建立的方法,将模型细胞置于不含胰岛素的培养基中孵育48 h后,用葡萄糖测定试剂盒检测培养基的葡萄糖含量,并计算每孔细胞葡萄糖消耗量。
1.2.4 形态学变化
利用倒置相差显微镜观察建模前后细胞形态学变化。
1.2.5 统计学方法
数据用±s表示, 采用SPSS13.0软件进行分析。同组不同浓度间比较采用方差分析,P<0.01为统计学差异显著。
2 结果与讨论
2.1 高浓度胰岛素对张氏肝细胞增值的影响
如图1所示在10、50、100、500和1 000 nmol/L浓度范围内,胰岛素并未对张氏肝细胞增殖产生显著影响。

图1 高浓度胰岛素对细胞增殖的影响Fig.1 Cell viability of Chang liver cells incubated with high concentration of insulin
MTT可以被线粒体内的一些脱氢酶还原生成结晶状的深紫色产物甲瓒(Formazan)。在特定溶剂存在的情况下,可以被完全溶解。通过酶标仪可以测定570 nm波长附近的吸光度。细胞增殖越多越快,则吸光度越高;药物的细胞毒性越大,则吸光度越低。由图1可见,高浓度胰岛素并未改变吸光度值,因此,对细胞增殖无显著影响。
2.2 模型的建立
如图2所示,在细胞培养液中加入胰岛素后,在各浓度胰岛素刺激下张氏肝细胞对胰岛素的敏感性降低,胰岛素诱导各组细胞葡萄糖消耗均显著低于对照组(P<0.001),说明张氏肝细胞已形成胰岛素抵抗。当胰岛素浓度为100 nmol/L时,细胞葡萄糖消耗与对照组比较显著降低了18.77%(P<0.001),表明100 nmol/L浓度胰岛素对张氏肝细胞葡萄糖消耗影响最大,即100 nmol/L为建立张氏肝细胞胰岛素抵抗模型的最佳胰岛素浓度。为进一步确定最佳建模时间,在张氏肝细胞培养液中加入100 nmol/L胰岛素分别孵育12、24、36和48 h。结果如图3所示,张氏肝细胞在含胰岛素的细胞培养液中孵育

图2 胰岛素浓度对张氏肝细胞葡萄糖消耗的影响(*P<0.001)Fig.2 Effect of insulin concentration on inducing IR Chang liver cells

图3 胰岛素孵育时间对张氏肝细胞葡萄糖消耗的影响(**P<0.001, *P<0.01)Fig.3 Effect of insulin incubation time on inducing IR Chang liver cells
12 h细胞葡萄糖消耗并未发生明显变化,当孵育时间延长到24 h时,细胞葡萄糖消耗与对照组相比显著降低了8.96%(P<0.001)。而当孵育时间进一步延长时虽然细胞葡萄糖消耗障碍仍然存在,但持续的低血清孵育对细胞状态影响较大,因此,100 nmol/L胰岛素孵育24 h为建立胰岛素抵抗张氏肝细胞模型的最佳条件。
2.3 模型稳定时间
研究细胞模型的稳定时间,为建立可靠的张氏肝细胞胰岛素抵抗模型提供了依据。如图4所示,将模型细胞置于不含胰岛素的培养基中分别培养12、24、36和48 h使胰岛素受体的数目上调,再测定对照组和模型组细胞的葡萄糖消耗,结果发现36 h内模型细胞的葡萄糖消耗仍然明显低于对照组细胞(P<0.001),即建模36 h后张氏肝细胞仍然存在葡萄糖摄取和利用障碍。说明细胞模型在36 h内具有稳定性。

图4 张氏肝细胞胰岛素抵抗细胞模型持续时间的研究(**P<0.001, * P<0.01)Fig.4 Insulin resistance Chang liver cell model stability
2.4 细胞形态学变化
由图5所示,对照组和模型组细胞在倒置相差显微镜下观察时并未出现显著形态学变化。
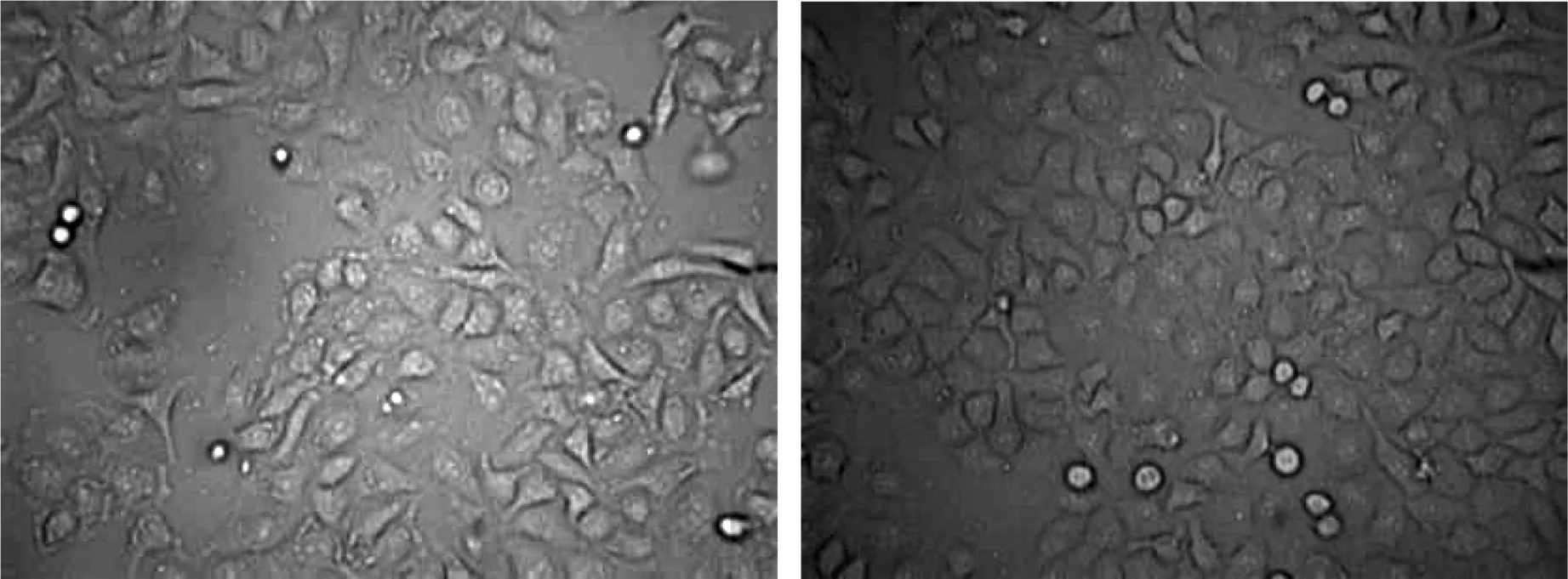
图5 对照组和模型组细胞形态学(×200)Fig.5 Morphocytology of control and model (×200)
3 结 论
本文利用葡萄糖检测试剂盒(GOD-POD法)检测细胞葡萄糖消耗, 较准确的判断细胞是否存在胰岛素抵抗。研究结果显示, 运用高胰岛素诱导培养法可使张氏肝细胞葡萄糖消耗显著降低,且发生葡萄糖摄取和利用障碍, 即发生胰岛素抵抗。研究过程中采用葡萄糖检测试剂盒鉴定胰岛素抵抗, 与目前其他实验室采用的同位素标记2-DG的摄取或糖原合成的判断指标[8]相比, 此法更接近临床糖尿病糖检测手段, 而且污染小、经济、方便, 更重要的是检测后的细胞可用作进一步的研究材料, 这点是同位素标记的糖检测法无法实现的。
本文建立的胰岛素抵抗张氏肝细胞模型, 可广泛用于在细胞水平探讨胰岛素抵抗的形成机制和糖脂代谢障碍的病理生理学环节。同时便于观察干预因素对胰岛素抵抗的直接影响, 更便于筛选改善胰岛素抵抗的药物。由于一些肿瘤细胞本身也存在胰岛素抵抗, 因此本模型的可靠性优于肝肿瘤细胞模型。而且张氏肝细胞保持着与人体内肝细胞基本相同的结构、生物学特性和功能, 既无成瘤性, 又具有持久增殖能力便于体外培养, 与动物模型[9]相比, 此细胞模型具有复制周期短、价格低廉、易于重复、便于控制等优点。
综上所述, 用含100 nmol/L胰岛素的培养液培养24 h的张氏肝细胞产生胰岛素抵抗, 称为胰岛素抵抗张氏肝细胞, 可用于进一步实验研究。
[1] ZIMMET P, ALBERTI K G, SHAW J. Global and societal implications of the diabetes epidemic[J]. Nature, 2001, 414(6865):782-787.
[2] RENSTROM F, BUREN J, SVENSSON M, et al. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate l protein depletion in human adipocytes[J]. Metabolism, 2007, 56(2):190-198.
[3] YAMAMSHITA R, SAITO T, SARAH S, et al. Effects of dehydroepiandrosterone on gluconeogenic enzymes and glucose uptake in human hepatoma cell line, HepG2 [J]. Endocrine Journal, 2005, 52(6):727-733.
[4] 林沪,毛青,王宇明,等. L02细胞人鼠嵌合肝模型的建立[J]. 中华肝病杂志, 2006, 14(8):578-581.
[5] JEFFREY E, ALAN R. Signaling pathways insulin action: molecular targets of insulin resistance[J]. Journal of Clinical Investigation, 2000, 106(2):165-169.
[6] VISTICA D T, SKEHAN P, SCUDIERO D. Tetrazolium-based assays for cellular viability: a critical examination of selected parameters affecting formazan production[J]. Cancer Research, 1991, 51(10):2515-2520.
[7] GAO D, GRIFFITHS H R, BAILEY C J. Oleate protects against palmitate-induced insulin resistance in L6myotubes[J]. British of Journal Nutrition, 2009, 102(11):1557-1563.
[8] 陈秋,夏永鹏,邱宗荫. 吡格列酮对胰岛素抵抗HepG2细胞模型的药理学评价[J]. 中国药理学通报, 2006, 22(2):248-251.
[9] LIU Z, ARONSON J, WAHL E C, et al. A novel rat model for the study of deficits in bone formation in type-2 diabetes[J]. Acta Orthopaedica, 2007, 78(1):46-55.
