一株黄曲霉菌种对土壤氯嘧磺隆残留的降解特性
2010-09-27韩婷婷,孙庆元,宗娟,李阳
韩 婷 婷, 孙 庆 元, 宗 娟, 李 阳
( 大连工业大学 生物与食品工程学院, 辽宁 大连 116034 )
0 引 言
氯嘧磺隆(也称豆磺隆)是80年代初期美国杜邦公司开发的磺酰脲类除草剂,自90年代大面积使用以来,由于其杀草谱广、超高活性、高选择性、可混性强等特点,一直是大豆田化学除草剂的主要品种,在土壤中主要通过水解和微生物降解作用而消失[1-2],但磺酰脲类除草剂在土壤中残留时间长,对后茬敏感作物易造成伤害[3],利用微生物降解可以很好地解决氯嘧磺隆在土壤中的残留问题。已报道的能够高效降解氯嘧磺隆的菌株仅有:睾丸酮丛毛单胞菌、黑曲霉、青霉及酵母菌,不能满足市场的需求。本文筛选驯化得到新的高效降解菌株,并对其降解氯嘧磺隆的特性进行了研究。
1 实 验
1.1 材 料
1.1.1 供试药剂及培养基
供试药剂:20%氯嘧磺隆可湿性粉剂(豆磺隆),大连瑞泽农药股份有限公司。
富集培养基: 蛋白胨 0.5 g,KH2PO40.1 g,MgSO4·7H2O 0.05 g,蒸馏水100 mL。分离培养基[4]:牛肉膏蛋白胨培养基、马丁氏培养基、高氏培养基。其他培养基[4]:麦芽汁液体培养基、PDA培养基。
1.1.2 供试植物
玉米种子,三益种业有限公司;油菜种子,陕西荣华杂交油菜种子有限公司。
1.1.3 供试土壤
供试土壤有两种,均为黑土:①取自大连工业大学玉山(未施用过除草剂) 0~10 cm耕层土壤;②取自黑龙江大西江农场被氯嘧磺隆污染的大豆土壤。
1.2 方 法
1.2.1 降解菌的富集和筛选
1.2.1.1 降解菌的富集
取黑龙江大西江农场被氯嘧磺隆污染的大豆土壤为处理对象,用无菌生理盐水溶解后制得土壤悬浊液,在250 mL三角瓶中,参考瓶培养富集技术[5-7],加入100 mL富集培养基(氯嘧磺隆的质量浓度为100 mg/L),按5%的接种量接种土壤悬浊液,置28 ℃、120 r/min摇床培养4 d后,将培养液按5%接种量接种于质量浓度为200 mg/L的氯嘧磺隆中,28 ℃摇床培养4 d,依此类推10次接种,使最终富集培养液氯嘧磺隆的质量浓度达到1 000 mg/L,得到降解菌的富集种子液。
1.2.1.2 降解菌的分离纯化
降解菌富集过程中,每2次转接后,都将菌液梯度稀释涂布于牛肉膏培养基、马丁氏培养基、高氏培养基上进行分离,根据生长情况不同,28 ℃培养2~4 d,据其不同的外观特征挑取单菌落,反复划线纯化,根据外观特征和显微形态观察的菌体形态特征合并相同的菌种,对菌种编号,将分离所得菌种进行进一步的氯嘧磺隆适应性培养,按5%接种量接种到氯嘧磺隆质量浓度为1 000 mg/L的麦芽汁培养基上,所得菌种于冰箱4 ℃保存。
1.2.2 菌种鉴定
依据《真菌鉴定手册》[8]进行鉴定。
1.2.3 菌液的制备
将所得高效降解菌放置于PDA液体培养基中,在28 ℃下,120 r/min摇床培养2 d。
1.2.4 菌土的制备
向2 000 g过筛风干的未施用氯嘧磺隆的灭菌黑土中加入100 mL菌液以及200 mL麦芽汁培养基,放置于通风良好的培养箱于28 ℃恒温培养2 d。
1.2.5 氯嘧磺隆的生物测定方法
1.2.5.1 氯嘧磺隆标准曲线的制作
参考东北农业大学实验室的生物测定方法[9-10],配制0、0.5、1、5、10、20、30、40、50 μg/kg 9个质量分数的氯嘧磺隆药土,以ln(w+1)为横坐标(w为氯嘧磺隆质量分数),玉米主根长抑制率为纵坐标,剔除氯嘧磺隆质量分数为0.5 μg/kg的点,因为在此点氯嘧磺隆对玉米主根起促进作用,标准曲线为y=20.368x-3.571 3 (R2=0.994 3)。
1.2.5.2 降解率的计算公式
氯嘧磺隆降解率=
(1)
1.2.6 高效降解菌降解实验
1.2.6.1 土壤pH的调节
将100 g土壤溶解于250 mL无CO2蒸馏水中,搅动1 min,放置0.5 h,此时应避免空气中有氨和挥发性酸,用pH计测读pH值,再用硫酸和生石灰调节土壤pH。
1.2.6.2 土壤湿度的调节
称量100 g土样,放入烘箱,(105±2) ℃烘干,烘干前后的质量差值除以烘干前的土样质量,即为土壤的湿度,以此为依据调节土样的湿度。
1.2.6.3 降解能力的测定
取0~10 cm土层的黑土,风干后过8目筛,配制成含10 μg/kg氯嘧磺隆(田间正常用量)的土样,调节含水量至40%,调节pH为7,配好的土样按10%接种菌土,每纸杯100 g此土样,每处理3次重复,分别记录各处理调节含水量后土壤总重量,每3天称量,加水补足,以保持其湿度不变,28 ℃下培养30 d,用生物测定方法[11]测定氯嘧磺隆残留量,计算降解率。
依此方法分别对pH、温度、湿度、接种量、氯嘧磺隆质量分数作单因素试验,以测得最佳降解条件,调节pH分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0,调节温度分别为20、25、28、30、35、40 ℃,调节湿度分别为20%、30%、40%、50%、60%、70%,分别按2%、5%、10%、15%、20%、25%接种菌土,将土样分别配制成5、10、15、20、25、30 μg/kg氯嘧磺隆,测定不同条件下的降解率。
1.2.6.4 降解菌生物量氮的测定
采用氯仿熏蒸法,通过氯仿熏蒸,使土壤中微生物细胞破裂,采用熏蒸-浸提法测定释放出的微生物生物量氮,用0.5 mol/L K2SO4浸提,浸提液中的氮采用凯氏消煮法测定[12]。
1.2.7 高效降解真菌的修复作用对油菜发育的影响
取0~10 cm土层的黑土,过8目筛,配制成含5 μg/kg氯嘧磺隆土样,调节湿度至60%,调节pH为6.5,配好的土样按10%接种菌土;同时设不加氯嘧磺隆的清水对照和加氯嘧磺隆不加菌土的对照,每花盆1 000 g此土样,每处理3次重复,分别记录各处理调节含水量后土壤总重量,每3天称量,加水补足,以保持其湿度不变,28 ℃下培养35 d。将油菜种子在28 ℃温箱中浸种24 h后再催芽20 h,待油菜种子露白后,选取芽长一致的种子播于上述土壤中,观察油菜的出苗和生长发育情况,在7 d后测定其出苗率,在第15、25、35天对其株高,鲜重进行测定。
2 结果与讨论
2.1 降解氯嘧磺隆菌株的筛选及鉴定
富集培养并分离出了一株高效降解除草剂氯嘧磺隆的菌株,命名为Q6,根据《真菌鉴定手册》辅助利用光学显微镜观察其形态及生长特点,发现其菌丝体发达,以分生孢子繁殖,有分隔,分生孢子球形、成链,分生孢子梗顶端膨大,顶囊近球形,基部有厚膜足细胞,菌落初略带黄色,后渐变为黄绿色,终成褐绿色。图1为Q6在PDA培养基中的形态,初步鉴定为丛梗孢目丛梗孢科曲霉属中的黄曲霉。
2.2 土壤pH对Q6生长及氯嘧磺隆降解的影响
图2为土壤pH对Q6生长及降解氯嘧磺隆的影响。由图2可以看出,在pH 5~5.5时,氯嘧磺隆降解率提升缓慢;在pH 5.5~6.5时,降解率快速提升,并在pH 6.5时有最大降解率,生物量氮也在pH 6.5时达到最高点;在pH 6.5~8.0时,降解率大幅度下降,其中,在pH 6.5~7.0时,生物量氮下降较慢,在pH 7.0~8.0时,生物量氮迅速下降;Q6对氯嘧磺隆降解的最适pH为6.5,可能是因为在pH为6.5时,菌体生长最好,加速了氯嘧磺隆的降解。文献[13]指出:除草剂降解的主要途径为酸催化的水解作用和微生物降解,在土壤pH>6.8 时大多数长残留磺酰脲除草剂的微生物降解和水解作用均停止,促使残留严重,这也是氯嘧磺隆在酸性条件下的降解率远远高于碱性条件下的原因。

图1 Q6在PDA培养基中的形态Fig.1 The morphous of Q6 in PDA nutritive medium

图2 土壤pH对Q6生长及降解氯嘧磺隆的影响Fig.2 The effect of edaphic pH on growth of Q6 and chlorimuron-ethyl degradation
2.3 温度对Q6生长及氯嘧磺隆降解的影响
图3为温度对Q6生长及降解氯嘧磺隆的影响。由图3可以看出,在温度为20 ℃时,降解率最低,生物量氮也最小;在温度为20~28 ℃时,降解率迅速提高;在28~40 ℃时,降解率和生物量氮均缓慢下降。氯嘧磺隆降解的最适温度为28 ℃,此时,生物量氮也最大,说明此时Q6生长旺盛,酶活性较高,低温时降解率较低,可以看出,北方的低温天气不利于氯嘧磺隆的降解。
2.4 土壤湿度对Q6生长及氯嘧磺隆降解的影响
图4为土壤湿度对Q6生长及降解氯嘧磺隆的影响。由图4可以看出,土壤湿度为20%时,

图3 温度对Q6生长及降解氯嘧磺隆的影响Fig.3 The effect of temperature on growth of Q6 and chlorimuron-ethyl degradation

图4 土壤湿度对Q6生长及降解氯嘧磺隆的影响Fig.4 The effect of edaphic humidity on growth of Q6 and chlorimuron-ethyl degradation
氯嘧磺隆的降解率最低;在土壤湿度为20%~60%时,氯嘧磺隆降解率逐渐上升,生物量氮也随之上升;在土壤湿度为70%时又有所下降,所以,氯嘧磺隆的最适降解湿度为60%。在低湿度下,降解率较小,一方面是由于干旱条件下氯嘧磺隆容易被土壤吸附,不利于微生物的降解;另一方面可能是由于在较高湿度下有利于菌体生长,加速了氯嘧磺隆的降解。
2.5 接种量对Q6的生长及氯嘧磺隆降解的影响
图5为接种量对Q6的生长及降解氯嘧磺隆的影响。由图5可以看出,接种量越大,降解率越高,生物量氮也越大,但是也可以看出接种量在2%~10%时,降解率快速提高,生物量氮增长迅速;在10%~25%时,降解率有所提高,但提高不大,生物量氮的增长也有所减缓,可能是随着接种量的提高,土壤中的营养物质大量消耗,无法满足过量菌体的生长需要。从多方面考虑,适宜接种量为10%。
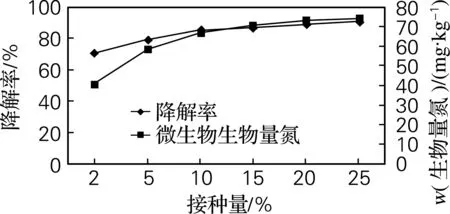
图5 接种量对Q6的生长及降解氯嘧磺隆的影响Fig.5 The effect of inoculum size on growth of Q6 and chlorimuron-ethyl degradation
2.6 氯嘧磺隆质量分数对Q6的生长及氯嘧磺隆降解的影响
图6为氯嘧磺隆质量分数对Q6的生长及降解氯嘧磺隆的影响。由图6可以看出,在氯嘧磺隆质量分数为2~10 μg/kg时,降解率有所增加,在氯嘧磺隆质量分数为10~30 μg/kg时,降解率又有所下降,这可能是因为氯嘧磺隆作为一种复杂的化学物质一方面难以被直接利用而抑制微生物的生长,另一方面又提高了降解酶的活性,如果酶活性的提高大于对生长量的抑制,降解率上升;若生长量的抑制大于酶活性提高的程度,则降解率减小。总的来说,在氯嘧磺隆质量分数在2~30 μg/kg,降解率改变较小,可见,氯嘧磺隆质量分数对降解率的影响不大,仍在10 μg/kg下有较高降解率,氯嘧磺隆质量分数越大生物量氮越小,说明氯嘧磺隆对菌体的生长有抑制作用,但随着氯嘧磺隆质量分数的增大,生物量氮趋于平稳。

图6 氯嘧磺隆质量分数对Q6的生长及降解氯嘧磺隆的影响Fig.6 The effect of chlorimuron-ethyl concentration on growth of Q6 and chlorimuron-ethyl degradation
在pH为6.5、温度为28 ℃、湿度为60%、接种量为10%、氯嘧磺隆质量分数为10 μg/kg条件下,30 d Q6对土壤氯嘧磺隆残留的降解率为94.88%。
2.7 Q6降解土壤氯嘧磺隆残留对油菜生长的影响
在氯嘧磺隆处理中,油菜受害严重,第35天的株高只有清水对照样中的57%,抑制率达到43%,鲜重只有清水对照的52.14%,抑制率达到了47.86%,但经过高效降解菌处理的油菜生长量大大提高,其株高和鲜重分别为清水对照的92.27%和87.74%,说明Q6对氯嘧磺隆有很好的降解作用,如表1所示。

表1 Q6降解土壤氯嘧磺隆残留对油菜生长的影响Tab.1 Effect of Q6 degrading chlorimuron-ethyl residues in soil on rape growth
3 结 论
高效降解菌Q6初步鉴定为丛梗孢目丛梗孢科曲霉属中的黄曲霉;Q6能够高效降解土壤中氯嘧磺隆,培养条件对微生物降解氯嘧磺隆的速率有很大影响,只有在适宜的环境条件下,微生物才能充分发挥其降解能力,Q6在土壤中最适降解pH为6.5,最适温度为28 ℃,最适土壤湿度为60%,适宜接种量为10%,氯嘧磺隆质量分数对氯嘧磺隆降解无显著影响,但仍在氯嘧磺隆质量分数为10 μg/kg时有较高降解率;本研究还发现,菌体生长和降解率有着紧密联系,降解率达到最大时也是菌体生长的最佳值,说明Q6在生长过程中利用了氯嘧磺隆;最后通过Q6对氯嘧磺隆残留土壤修复后种植油菜进一步验证了Q6的高效降解作用。我国对氯嘧磺隆的降解研究较少,主要为东北农业大学分离出的高效降解菌F8,在土壤pH为6.75,温度为28 ℃,土壤含水量20%,接种量2%时,氯嘧磺隆质量分数20 μg/kg,培养30 d的降解率达到80%,与此相比,本文的Q6也为高效降解菌。
[1] 陶波,苏少泉,刘金宇. 农作物对磺酰脲类除草剂耐性的研究[J]. 东北农业大学学报, 1995, 26(2):105-110.
[2] 邓金保. 磺酰脲类除草剂综述[J]. 世界农药, 2003, 25(3):24-32.
[3] 苏少泉. 嗪磺隆在土壤中降解的研究[J]. 杂草学报, 1990, 4(1):1-6.
[4] 袁红莉,王贺祥. 农业微生物学及实验教程[M]. 北京:中国农业大学出版社, 2009:270-271.
[5] 土壤微生物研究会(日). 土壤微生物实验法[M]. 北京:科学出版社, 1983:267-293.
[6] 黄星,何建,潘继杰,等. 甲磺隆降解菌FLDA的分离鉴定及其降解特性研究[J]. 土壤学报, 2006, 43(15):821-827.
[7] 王学东,欧晓明,王慧利,等. 除草剂咪唑烟酸高效降解菌的筛选及其降解性能的研究[J]. 农业环境科学学报, 2006, 22(1):102-105.
[8] 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 495-500.
[9] 陶波,苏少泉. 农得时活性与在水稻田中降解动态的研究[J]. 中国水稻科学, 1995, 9(1):87-59.
[10] 宋小玲,马波,皇甫超河,等. 除草剂生物测定方法[J]. 杂草科学, 2004(3):1-6.
[11] 姚槐应,黄昌勇. 土壤微生物生态学及其实验技术[M]. 北京:科学出版社, 2006: 164-166.
[12] 苏少泉. 长残留除草剂在土壤中的分解及其使用中带来的严重问题[J]. 农化新世纪, 2008(4):24-26.
[13] 滕春红,陶波,赵世君. 高效降解真菌对大豆田除草剂氯嘧磺隆的降解特性研究[J]. 大豆科学, 2006, 25(1):58-61.
