PRRSV天津分离株Nsp2基因的克隆和遗传进化分析*
2010-09-26孙跃辉黄金海郭立力杨爱华粱智选
孙跃辉,黄金海*,郭立力,杨爱华,粱智选,刘 莹
(1.天津大学农业与生物工程学院,天津 300072;2.天津市动物疫病预防控制中心,天津 300402)
猪繁殖与呼吸综合征(Procine rep roductive and respiratory syndrom e,PRRS)是由猪繁殖与呼吸综合征病毒(Procine rep roductive and respiratory synd rome virus,PRRSV)引起的一种以妊娠母猪繁殖障碍以及仔猪的呼吸道症状和高死亡率为特征的传染病[1]。PRRS于1987年首次在美国南部暴发并报道,随后在短短的几年迅速流行于全美,随之加拿大、德国、荷兰等北美洲及欧洲国家也先后报道发生该病[2-3],并已成为危害养猪业最严重的传染病之一。
PRRSV全基因组长约15 kb,包括9个开放阅读框(ORFs),越来越多的研究表明,不同 PRRSV的变异分布于整个基因组,但以N sp2的变异最大[4-5]。Nsp2基因长度 2.9 kb,位于 PRRSV的ORF1a区,在不同的毒株中序列存在着长度不一的缺失,因此对Nsp2的分析在一定程度上可以反映病毒基因组序列的变异情况[6]。本研究从天津市疑似猪蓝耳病病例中分离得到3株PRRSV,其中包括两株N sp2缺失毒株 TJ-S1、TJ-S2,并对其 Nsp2序列进行分析,参考国内外已发表基因序列构建基因系统进化树,以阐明分离株TJ-S1、TJ-S2和 TJ-S3的基因型和遗传进化地位,丰富PRRSV分子流行病学资料,进而为PRRS的防控提供科学依据。
1 材料与方法
1.1 材料
1.1.1 病毒分离株、菌株和细胞 PRRSV分离株TJ-S1株、TJ-S2株、TJ-S3株,分别分离自天津蓟县、静海、河北黄骅发病猪,置-40℃冰箱中保存;E.co li DH5α菌株、Marc-145细胞由本室保存。
1.1.2 主要试剂 TRIzol-A+总RNA提取试剂、Taq DNA聚合酶购自天根生化科技(北京)有限公司;AMV逆转录酶、pGEM-T Easy载体购自Prom ega公司;DNA M arker购自北京普博欣生物科技有限责任公司;DNA胶回收试剂盒购自北京博大泰克生物基因技术有限责任公司。
1.2 方法
1.2.1 引物设计 根据 B J-4、HB-1、HB-2、VR2332以及CH-la毒株的核苷酸序列比对结果,运用O ligo6.0软件根据 BJ-4株序列设计出扩增Nsp2基因高变区部分序列的3条引物,其中r-Nsp2(5′-AAGCCATTCCTGGT-3′)为 反 转 录 引 物,Nsp2-FP (5′-CCTCCGTGGTGCAACAAATCT TG-3′) 和 Nsp2-LP(5′-CGATGATGGCTTGAGCTGAGTAT-3′)是扩增高变区的上下游引物。
1.2.2 病毒RNA的提取 取病毒的细胞培养物250μL,置于DEPC水处理过的1.5 mL灭菌离心管中,然后按照TRIzol-A+总RNA提取试剂说明,提取总RNA。
1.2.3 Nsp2基因的扩增 20μL反转录体系为:总RNA 12.5μL,加入反转录引物(25 pm ol/μL)1μL,dNTP M ixture(10 mmol/L each)1 μL,RNase抑制剂 0.5μL(30 U/μL)、A MV 反转录酶1μL(10 U/μL)及5×RT缓冲液4μL,42 ℃反应2 h,然后95℃变性5 min,即可作为 PCR模板。
PCR反应体系为:反应总体积50μL,内含10×PCR缓冲液 5μL,dNTP Mixture(2.5 mmol/L each)4μL,上下游引物(25 pmo l/μL)各 1μL,Taq DNA 聚合酶(2.5 U/μL)1μL,cDNA 5μL,加水至50μL。PCR程序为:94℃预变性5 min;94℃45 s,56℃45 s,72℃45 s,共35个循环;最后72℃延伸10 min。
取PCR产物5μL,用15 g/L琼脂糖凝胶电泳进行检测,凝胶成像系统观察扩增情况。
1.2.4 目的基因的克隆和鉴定 参照DNA胶回收试剂盒说明,回收目的基因条带,按照pGEM-T Easy载体说明将目的基因连接到pGEM-T载体中,转化E.coli DH 5α感受态细胞,挑取白斑,接种于含有氨苄青霉素(100μg/mL)的LB液体培养基中,37℃振荡培养过夜,提取质粒进行PCR鉴定,筛选出阳性重组菌,交由北京六合华大基因科技股份有限公司测序。
1.2.5 序列分析 测序结果用 BLAST和DNA Star软件分析,并与GenBank中已报道的Nsp2核苷酸序列及其编码的氨基酸序列进行同源性比较,构建系统进化树。
2 结果
2.1 目的基因的克隆及阳性克隆的鉴定
用RT-PCR的方法扩增出Nsp2基因,获得与预期片段大小相符的特异性条带,大小约为1 100 bp(图1)。所选阳性克隆,经过 PCR鉴定,均出现预期的目的片段。
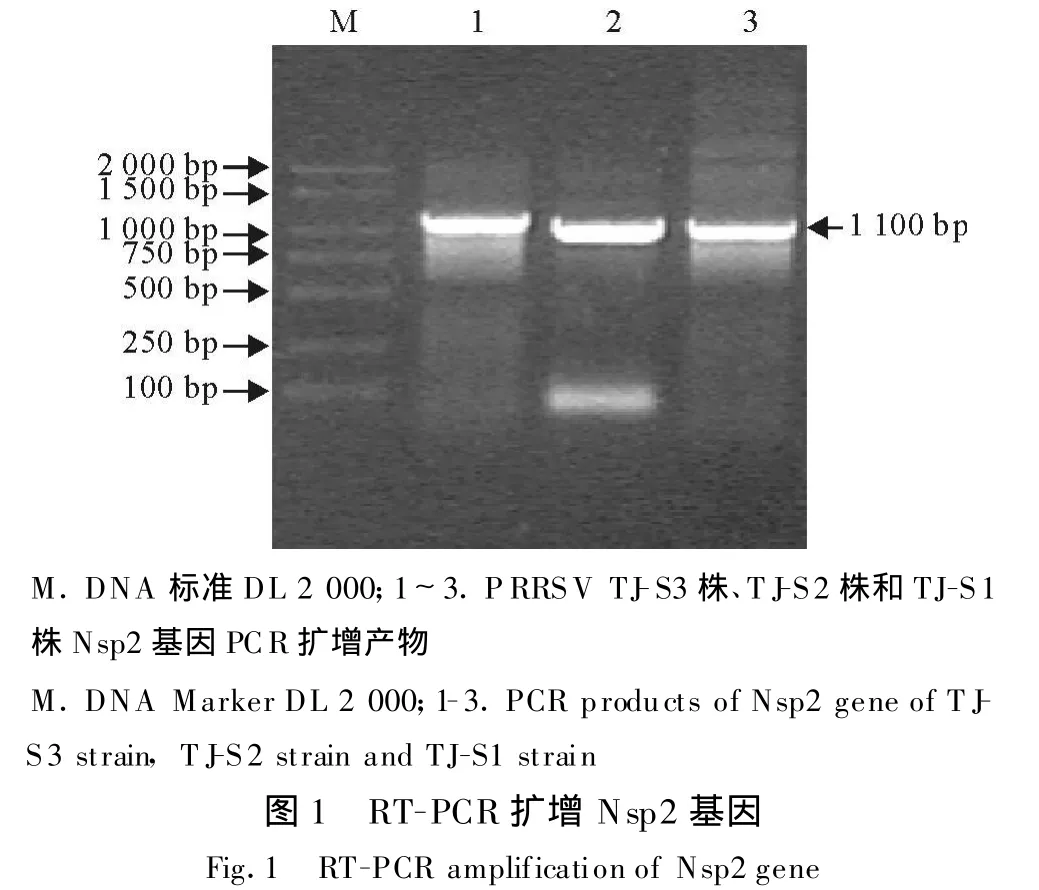
2.2 序列测定
阳性克隆的DH 5α菌液送北京六合华大基因科技股份有限公司测序。通过BLAST分析表明,扩增得到的序列为PRRSV的N sp2基因,与预期结果相符合,并已递交GenBank,分别命名为Nsp2-TJS1(登录号 GQ923891)、Nsp2-TJ-S2株(登录号GQ923892)、N sp2-TJ-S3株(登录号:GQ923893),其中N sp2-TJ-S2、Nsp2-TJ-S3存在30个氨基酸的不连续缺失。
2.3 序列分析结果
3株PRRSV天津分离株的Nsp2基因与已发表的VR2332 株 、HB-1a 株 、SD-14 株 、HuN 株 、BJ-4 株和CH-1a株的核苷酸和氨基酸的同源性比较结果见表1。3株PRRSV天津分离株Nsp2基因核苷酸序列之间的同源性为91.0%~99.5%,推导编码的氨基酸序列之间的同源性为88.1%~99.2%,其中TJ-S1株和 TJ-S2株Nsp2基因高度相似,相比 TJ-S3株、VR2332株、HB-1株、BJ-4株和CH-1a株在第 221位和第272~300位氨基酸发生缺失(图2)。
从遗传进化树(图3)可见,PRRSV可以分为两个类群,以VR-2332为代表的美洲株和以LV为代表的欧洲株,3株天津分离株都属于美洲株,其中TJ-S1株、TJ-S2株与HuN株、SD-14株遗传距离相对较近,TJ-S3株与CH-1a株的遗传距离较近。

表1 PRRSV Nsp2基因核苷酸和氨基酸序列同源性比较结果Table1 The hom ologies of nucleotide and amino acid sequences of Nsp2 gene of PRRSVs %

图2 Nsp2基因推导编码的氨基酸序列与国内外毒株的序列比较Fig.2 A lignm ent of deduced amino acids of obtained Nsp2 gene with other PRRSV isolates
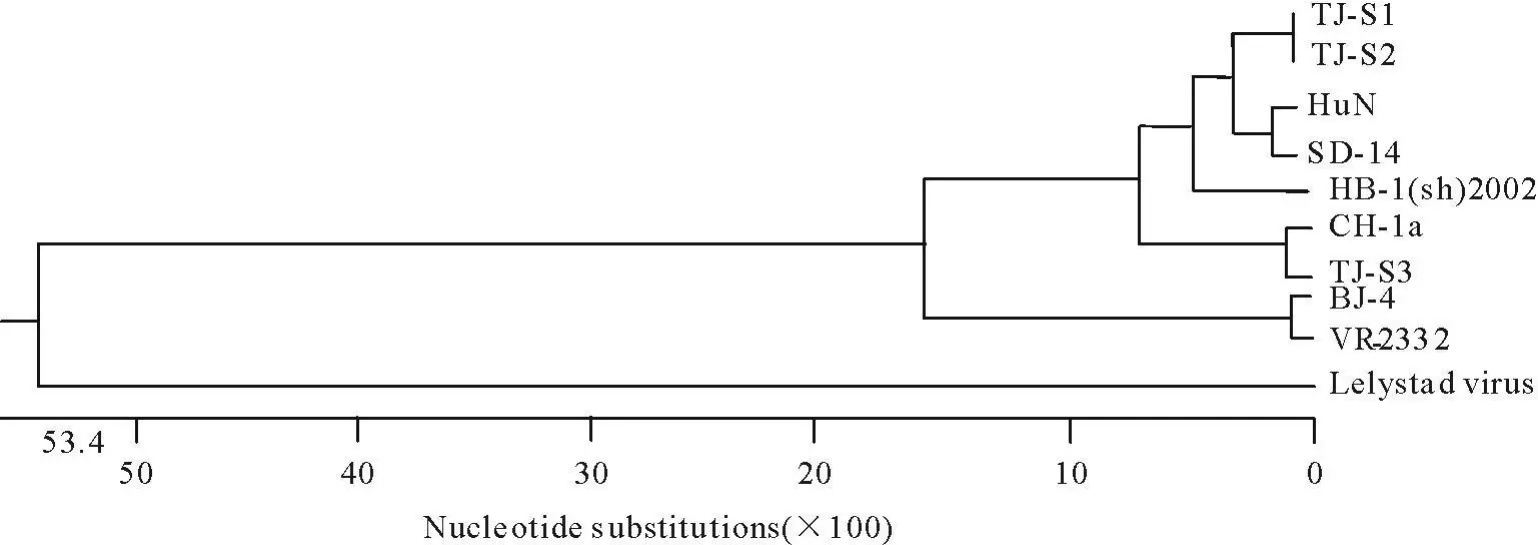
图3 Nsp2基因遗传进化树Fig.3 Phy logenetic tree of Nsp2 gene
3 讨论
自从猪繁殖与呼吸综合征(PRRS)于20世纪80年代发生以来,该病已成为危害世界养猪业的重大疾病之一,造成了严重的经济损失[7]。我国于1995年始发此病[8],并迅速传播至全国各地,2006年高致病性的PRRS在江西爆发,随后蔓延至北京、河北、河南、湖南、广东等主要养猪省市,给我国养猪业带来了较大灾难[9-10],其中PRRSV的变异是造成本病难以控制的重要原因之一。
PRRSV以特有的套式转录方式进行病毒粒子的复制增殖,这种独特的转录方式使其基因组极易发生变异[11],除碱基点突变频率较高外,PRRSV基因组还常发生片段的插入或缺失变异,尤其在Nsp2基因区域。PRRSV出现之初,美洲型毒株的Nsp2基因大小约为 2.9 kb,VR2332株、BJ-4株、CH-1a株等为这一类型,随着时间的推移,N sp2基因发生缺失的PRRSV毒株不断出现,2002年在河北省分离的HB-2(SH)/2002株Nsp2基因出现36个碱基连续缺失[12],2006年在江西省又分离到另一缺失程度更大的PRRSV毒株(JX-A 1株)[13]。JX-A 1株的Nsp2基因存在2处共90个碱基缺失,其中一处缺失87个碱基,另一处缺失3个碱基,2006年后国内大范围流行的毒株即为这一类型。因为插入或缺失使PRRSV的N sp2基因具有长度多态性,这一特点可用于PRRSV经典毒株和变异毒株的鉴别。
本研究对3株天津PRRSV分离株的Nsp2基因进行了克隆和序列测定,并与VR2332株、HB-1株、SD-14株、HuN 株、BJ-4株和CH-1a株的相应序列进行了比较分析,结果表明分离的3株病毒都属于美洲型毒株,其中TJ-S3株和国内分离株CH-1a株Nsp2基因同源性较高,属于经典毒株;TJ-S1株、TJ-S2株和国内分离株SD-14株、HuN株Nsp2基因同源性较高,在第221位和第272位~300位氨基酸发生缺失,属于变异毒株。以上研究结果表明,PRRSV的N sp2基因的变异广泛存在,在同一地区PRRSV变异毒株和经典毒株可以同时存在;PRRSV经典毒株感染亦可导致猪的高热病,说明Nsp2基因的缺失变异并不是PRRSV的致病力和毒力变化的惟一因素或主要因素,PRRSV的致病力和毒力的改变可能是多区域多因素作用的结果。
[1]Nielsen H S,Liu G,Nielsen J,et al.Generation of an infectious c lone of VR-2332,a highly viru len t North American ty pe isolate of porcine rep rodu ctive and respiratory syndrome virus[J].J V irol,2003,77(6):3702-3711.
[2]Terpstra C,W ensvoort G,Pol JM,et al.Experimental reproduction of porcine epidem ic abortion and respiratory syndrome(mystery sw ine disease)by infection with Lelystad virus:Koch's postulates fulfilled[J].Vet Q,1991,13(3):131-136.
[3]Dea S,Bilodeau R,Sauvageau R,et al.Ou tb reaks in Quebec pig farms of respiratory and reproductive p rob lem s associated with encephalomyocarditis virus[J].JVet Diagn Invest,1991,3(4):275-282.
[4]YoshiiM,Okinaga T,M iyazaki A,et al.Genetic polym orphism of the nsp2 gene in North American type-porcine reproductive and respiratory syndrome virus[J].A rch Virol,2008,153(7):1323-1334.
[5]A llende R,Laegreid W W,Kutish GF,et al.Porcine reproductive and respiratory syndrome virus:description of persistence in individual pigsupon ex perimental infection[J].JVirol,2000,74(22):10834-10837.
[6]童光志,周艳君,赫晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-327.
[7]Benfield D,Nelson E,Collins J E,et al.Characterization of swine infertility and respiratory syndrome(SIRS)virus(isolate A TCC VR-2332)[J].JVet Diagn Invest,1992,4(2):127-133.
[8]郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国畜禽传染病,1996,18(2):1-4.
[9]Li Y F,W ang X L,Bo K T,et al.Emergence of a highly pathogenic porcine rep roductiveand respiratory syndrome virus in the M id-Eastern region of China[J].Vet J,2007,174(3):577-584.
[10]Tong GZ,Zhou Y J,Hao X F,et al.High ly pathogenic porcine reproductive and respiratory syndrome,china[J].Emer Infec Dis,2007,13(9):1434-1436.
[11]de V ries A A,G laser A L,Raam sman M J,et al.Geneticmanipulation of equine arteritis virus using full-length cDNA clones:separation of overlapping genes and exp ression of a foreign epitope[J].Virology,2000,270(1):84-97.
[12]高志强,郭 鑫,杨汉春,等.猪繁殖与呼吸综合征病毒缺失变异株的基因组特征[J].畜牧兽医学报,2005,36(6):578-584.
[13]Tian K G,Yu X L,Zhao T Z,et al.Emergence of fatal PRRSV varian ts:unparalleled outbreak s of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoSONE,2007,2(6):526.
