鸭粪中环孢子虫18 S rDNA部分基因和ITS-1基因的克隆与分析*
2010-09-21程家林李国清岳彩铃徐前明高振永
程家林,李国清,岳彩铃,徐前明,高振永,刘 霞
(华南农业大学兽医学院,广东广州 510642)
环孢子虫(Cyclospora sp.)是一种新出现的食源性和水源性传播的寄生原虫,可以引起人和动物的胃肠炎和严重腹泻[1-5]。1996年-1999年美国和加拿大相继暴发了大规模的食源性环孢子虫病[1,6],由此该寄生虫引起医学界和国家公共卫生机构的广泛关注。大量研究证实环孢子虫隶属于复顶门、孢子虫纲、真球虫目、艾美耳科、环孢子虫属(Cyclospora)。迄今为止,已报道的环孢子虫大约有18种[7-8],它们大都寄生于哺乳类与爬行类,分别为C.cayetanensis、C.cercopitheci、C.colobi、C.papionis、C.angimurinensis、C.ashtabulensis、C.b abaulti、C.caryolytica 、C.glomericola 、C.megacephali、C.niniae、C.parascalopi、C.scinci、C.talpea 、C.tropidonoti、C.viperae、C.zamenis 和牛源环 孢子 虫 。由于各种环孢子虫的形态学特征基本相似,并容易与其他球虫相混,要确定环孢子虫的种类,必需对其进行分子生物学鉴定。目前对环孢子虫的分子鉴定方法国际上多采用Relman D A等[9]设计的套式引物,扩增18 S rDNA基因的294 bp片段,随后进行RFLP研究或对其克隆测序结果进行序列分析[10],来确立环孢子虫属的分类地位;扩增环孢子虫种间高度特异的转录间隔区Ⅰ(internal transcribed spacer 1,ITS-1)基因片段,来确立环孢子虫种的分类地位。迄今为止,通过分子生物学研究鉴定出的环孢子虫有 5种[7-9],分别为 C.cayetanensis、C.cercopitheci、C.colobi、C.papionis和牛源环孢子虫。本研究首次在鸭粪中发现了疑似环孢子虫卵囊,并综合应用形态学和分子生物学鉴定方法对其进行分类研究,以确立鸭源环孢子虫的分类地位。
1 材料与方法
1.1 材料
1.1.1 卵囊的收集 从广东省佛山某鸭场采集新鲜鸭粪,先加少量水稀释,镜检发现有疑似环孢子虫卵囊时,再用多于10倍体积的水稀释全部粪样并充分搅拌混匀后,依次经 80、100、160目铜筛过滤,沉淀过夜;然后小心去除上清液,离心沉淀后,用饱和蔗糖漂浮法浓集疑似环孢子虫卵囊;最后将收集的卵囊经蔗糖密度梯度离心纯化后,置于4℃冰箱备用。
1.1.2 主要试剂 粪样DNA提取试剂盒为OMEGA公司产品;蛋白酶 K、琼脂糖、Ex-Taq酶、PCR buffer、MgC12、dNT Ps、pMD-18T 载体均为宝生物工程(大连)有限公司产品;DNA纯化试剂盒为上海生工生物工程技术服务有限公司产品;WizardTMplus SV Minipreps DNA Purification System试剂盒为Promega公司产品;饱和蔗糖和感受态细胞JM109为华南农业大学寄生虫与寄生虫病学教研室自制。
1.2 方法
1.2.1 卵囊的形态学鉴定 对浓集后的疑似环孢子虫卵囊进行形态学鉴定,包括400倍下普通镜检,改良抗酸染色后观察以及孢子化试验,将其镜检结果与文献[3,7-8]描述的典型特征进行比较。其镜检典型特征为:直接涂片时可见卵囊大小约为8.0 μ m~10 μ m,其内含折光性较强的成团小球体,呈桑椹胚状,淡绿色;孢子化后卵囊有两个孢子囊,每个孢子囊有两个子孢子;经改良抗酸染色卵囊着色不均,呈深红色或淡红色或不着色。
1.2.2 DNA提取 按照OMEGA公司的粪样DNA提取试剂盒的说明,提取本次纯化卵囊的基因组DNA,并做相应改进。一是玻璃珠震荡的时间宜延长至30 min以上,以便打碎卵囊壁;二是消化时间延长,最好消化过夜;三是DNA提取最后一步加入Elution buffer的量应根据卵囊的多少适量加入,一般要小于说明书的加入量60 μ L。
1.2.3 18 S rDNA基因的套式PCR扩增 参考Relman P A等[9]设计的引物扩增18 S rDNA基因片段,两对引物由上海英俊生物技术有限公司合成,预计片段大小为294 bp。PCR扩增在0.5 mL eppendorf管中依 次加入 5 μ L 10×buffer(含25 mmol/L MgC12),4 μ L dNTPs,正反 向引 物各1 μ L(25 pmol/μ L), 模 板 DNA 2 μ L, 最 后 加Ex-Taq酶0.25 μ L,用灭菌去离子双蒸水加至总体积为50 μ L,混匀后在PCR扩增仪上扩增。反应参数为:94℃5 min;94℃30 s,外引物51℃30 s,内引物48℃退火30 s,72℃延伸1 min,循环35次;最后72℃后延伸10 min。PCR产物经10 g/L琼脂糖凝胶电泳分析,于紫外透射仪上观察并记录结果。
1.2.4 ITS-1+基因的PCR扩增 分析GenBank中收录的环孢子虫rDNA的18 S、5.8 S序列,采用引物设计软件Premier 5.0在其保守位置设计一对引物用来扩增ITS-1+序列(包括部分18 S rDNA,全长 ITS-1及部分 5.8 S rDNA序列)。引物为ITS-R,5′-AGGGTCCTGTGAACTCAT-3′;ITS-F,5′-ACTGAAACAGACGTGCTG-3′。预 计扩 增片段大小约680 bp。
PCR扩增体系参照套式PCR扩增体系,混匀后在PCR扩增仪上扩增。反应参数为:94℃5 min;94℃30 s,47℃30 s,72℃1 min,循环35次;最后72℃10 min。PCR产物经10 g/L琼脂糖凝胶电泳分析。
1.2.5 PCR产物的克隆和测序 按照DNA胶回收试剂盒进行PCR产物纯化,并将其连接到pMD-18-T载体上,然后转入JM109感受态细胞中,进行蓝白斑筛选。挑取转化的白色菌落,接种于含氨苄青霉素的LB培养基中培养。取重组菌1 μ L做模板,用相应引物进行菌落PCR鉴定。选菌落PCR阳性克隆菌株,用Promega公司的WizardTMplus SV Minipreps DNA Purification System试剂盒抽提重组质粒,再用PstⅠ和SacⅠ进行双酶切鉴定。将鉴定为阳性的重组菌样送上海博尚生物技术有限公司测序。
1.2.6 序列同源性及系统发育分析 进入美国国家生物技术信息中心(NCBI)站点,利用“Nucleotide-nucleotide BLAST”程序,将此次所测序列与GenBank中已知的各种微生物序列进行相似性搜索,寻找同源性核苷酸序列,并下载相关序列,用MEGA 4软件进行系统进化树分析,确定其种类。
2 结果
2.1 形态学鉴定结果
鸭源环孢子虫镜检结果见图1。卵囊为正圆形,大小约为 8.0 μ m ~10 μ m。未孢子化卵囊内有颗粒状小体,呈桑椹状、淡绿色;孢子化卵囊内有两个孢子囊;经改良抗酸染色后,卵囊呈红色,有着色不均的现象。

图1 鸭源环孢子虫卵囊形态图(400×)Fig.1 M orphology of Cyclospora-like oocysts from duck(400×)
2.2 PCR扩增结果
以提取的鸭源环孢子虫基因组为模板,分别扩增其18 S rDNA和ITS-1+基因,其电泳结果如图2和图3所示,扩增片段的大小与预期片段大小基本相同。

图2 18 S rDNA基因套式PCR扩增结果Fig.2 The results of 18 S rDNA gene amplified by nested PCR
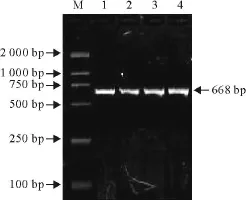
图3 ITS-1+基因 PCR扩增结果 Fig.3 The results of ITS-1+gene amplified by PCR
2.3 PCR产物的克隆与鉴定
取重组菌1 μ L做模板,用相应引物进行菌落PCR鉴定。选菌落PCR阳性克隆菌株,进行质粒小量抽提,所得重组质粒用PstⅠ和SacⅠ进行双酶切后,经10 g/L琼脂糖凝胶电泳,结果见图4和图5,均切出两条条带,都含有目的条带,与相应PCR产物电泳结果相符。
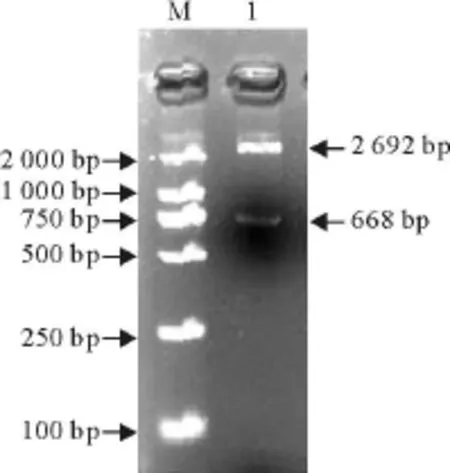
图5 ITS-1+基因重组质粒PstⅠ和SacⅠ双酶切鉴定 Fig.5 The identification of the ITS-1+gene recombinant plasmids by restriction digestion with PstⅠand SacⅠ
2.4 测序及序列分析结果
本次测得的18 S rDNA部分基因片段大小为294 bp,其组成如下:

利用NCBI在线BLAST程序,对本次所测的18 S rDNA基因序列进行分析,发现与环孢子虫和艾美耳科原虫有较高的相似性,其中与C.cayetanensis相似性为98%。从GenBank中下载相关序列,用MEGA4软件建立系统进化树(图6)。由进化树分析可知,本研究分离出的环孢子虫和艾美耳科的球虫遗传距离较近,尤其是和其他环孢子虫关系最近,符合环孢子虫属的分类标准。
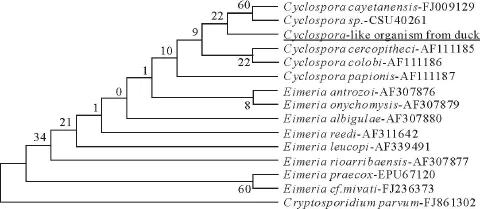
图6 鸭源环孢子虫18 S rDNA基因的系统进化树(N-J法)Fig.6 The phy logenetic tree of cy clospora-like organism from duck based on 18S rDNA gene(N-J method)
本次测得的ITS-1+基因片段大小为668 bp,包括部分18 S rDNA(135 bp),全部 ITS-1(374 bp),部分5.8 S rDNA(159 bp),其组成如下:

对种间高度特异的ITS-1序列进行同源性分析,通过NCBI中的 BLAST在线分析,与GenBank收录的所有已知序列进行同源性比较。结果显示,该序列高度特异,未发现同源性基因片段。因此,鸭源环孢子虫的分类地位得到确立,本研究首次发现了鸭源环孢子虫。
3 讨论
环孢子虫作为一种新出现的寄生性原虫,近年来,其流行病学调查和未知宿主的探索研究倍受关注。本研究在鸭粪中发现的疑似环孢子虫卵囊,通过形态学鉴定,其形态特征与国内外报道的人源环孢子虫(C.cayetanensis)的形态特征基本一致。
要确立其为环孢子虫,必需进一步对其进行分子生物学鉴定。由于18 S rDNA基因在生物进化过程中具有高度保守性,近年来国外学者应用18 S rDNA基因序列设计引物,来鉴别和检测环孢子虫[7-14],目前已测得18 S rDNA基因序列的环孢子虫 有 C.cayetanensis、C.cercopitheci、C.colobi、C.papionis和牛源环孢子虫[7-9]。Eberhard M L等[15]对 C.cercopitheci、C.colobi、C.papionis 进行 18 S rDNA序列比对时发现环孢子虫属内高度同源,若要进行种间区别,需要寻找其他高变区。Adam RD等[16]和Olivier C等[17]建议可用ITS-1区,Olivier研究发现C.cayetanensis与C.papionis的ITS-1区高度特异;Adam研究发现从不同地方分离到的C.cayetanensis的ITS-1区基本相同,没有因地域来源不同而呈现差异;肖淑敏等[18]曾用ITS-1+序列鉴定牛源环孢子虫。应用Relman D A等[9]设计的套式引物和自己设计的一对引物,扩增了18 S rDNA基因的部分片段和ITS-1基因全部片段,并对其克隆测序结果进行了序列分析,结果发现,该虫的18 S rDNA基因序列与环孢子虫的相应基因序列相似性高达98%,而且系统进化树中它们又位于同一分支,该虫的ITS-1基因序列高度特异,在GenBank中未发现同源序列,进而确立了鸭源环孢子虫种的分类地位。
[1]Chambers J,Somerfeldt S,M ackey L,et al.Outbreaks of Cyclospora cayetanensis infection-United States[J].MMWR,1996,45(25):549-551.
[2]Serpentini A,Dutoit E,Camus D.Cyclospora cayetanensis:review of an emerging intestinal pathogen[J].Annales De Biologie Clinique,1999,57(6):677-683.
[3]Mansfield L S,Gajadhar A A.Cyclospora cayetanensis,a food-and waterborne coccidian parasite[J].Vet Parasitol,2004,126(1-2):73-90.
[4]Popovici I,Dahorea C,Rugina A,et al.Acute diarrhea associated with Cyclospora cayetanensis[J].Rev Med Chir Soc Med Nat Iasi,2003,107(4):877-880.
[5]Naito T,Mizue S,Misawa S,et al.Cyclospora infection in an immunocompetent patient in Japan[J].Jpn J Infect Dis,2009,62(1):57-58.
[6]Herwaldt B L.Cyclospora cayetanensis:a review,focusing on the outbreaks of cyclosporiasis in the 1990s[J].Clin Infect Dis,2000,31(4):1040-1057.
[7]Joan M S,Betty H O.Cyclospora cayetanensis:a review of an emerging parasitic coccidian[J].Int J Parasitol,2003,33(4):371-391.
[8]肖淑敏,李国清,周荣琼,等.牛源环孢子虫的发现与分子鉴定[J].中国预防兽医学报,2006,28(4):380-382.
[9]Relman D A,Schmidt T M,Gajadhar A,et al.M olecular Phylogenetic analy sis of Cyclospora,the human intestinal pathogen,suggest that it is closely related to Eimeria species[J].J Infect Dis,1996,173(32):440-444.
[10]Orlandi P A,Carter L,Brinker A M,et al.Targeting singlenucleotide polymorphisms in the 18S rRNA gene to differentiate Cyclospora species from Eimeria species by multiplex PCR[J].Appl Environ Microbiol,2003,68(8):4806-4813.
[11]Marina S,Scott U,Joseph O.Sensitivity of PCR detection of Cyclospora cayetanensis in raspberries,basil,and mesclun lettuce[J].J Microbiol Meth,2003,54(1):277-280.
[12]徐前明,李国清.环孢子虫的研究进展[J].寄生虫与医学昆虫学报,2008,15(1):55-60.
[13]李韦华,李国清,肖淑敏,等.牛源环孢子虫18 S rDNA部分序列的扩增与克隆分析[J].动物医学进展,2006,27(12):62-65.
[14]Joan M S,Betty H O.PCR-restriction fragment leng th polymorphism method for detection of Cyclospora cayetanensis in environmental waters without microscopic confirmation[J].Appl Environ Microbiol,2003,69(8):4662-4669.
[15]Eberhard M L,da Silva A J,Lilley B G,et al.Morphologic and molecular characterization of new Cyclospora species from Ethiopian monkey s:C.Cercopitheci sp.n.,C.colobi sp.n.,and C.papionis sp.n.[J].Emerg Infect Dis,1999,5(5):651-658.
[16]Adam R D,Ortega Y R,Gilman R H,et al.Intervening transcribed spacer region 1 variability in Cyclospora cayetanensis[J].Clin Microbiol,2000,38(6):2339-2343.
[17]Olivier C,van de Pas S,Lepp P W,et al.Sequence variability in the first internal transcribed spacer region within and among Cyclospora species is consistent with poly parasitism[J].Int J Parasitol,2001,31(13):1475-1487.
[18]肖淑敏,李国清,周荣琼,等.以 ITS-1+序列鉴定牛源环孢子虫[J].中国兽医学报,2007,27(1):59-65.
