黄藤素纳米粒的制备及抗感染试验*
2010-09-21李云让欧阳五庆吴旭锦李树鹏
李云让,欧阳五庆,吴旭锦,李树鹏,王 珊
(1.西北农林科技大学动物医学院,陕西杨陵 712100;2.宝鸡职业技术学院,陕西宝鸡 721013;3.咸阳职业技术学院,陕西咸阳 712000;4.河北农业大学中兽医学院,河北保定 073000)
黄藤素(fibrauretin)为从防己科植物黄藤干燥茎中提取得到的生物碱,其有效化学成分为盐酸巴马汀(C21H22NO4HCl),本品具有抗细菌、真菌、疟原虫和肿瘤作用[1-3],常用于泌尿生殖道感染如阴道炎、呼吸道感染如肺炎、消化道感染如菌痢和肠炎等的治疗。黄藤素的胃肠道吸收效果差(吸收速率小于10%)[4],严重影响其临床应用的效果。纳米粒作为新的药物载体具有提高生物利用度、调节释药速度、靶向性等优点,已成为近年研究的热点[5-6]。药物借助纳米粒的包裹或者吸附作用,按与微生物类似的途径(融合、内吞)进入胞内,从而增强黄藤素在胃肠道的吸收,达到提高生物利用度的目的。另外,纳米粒通过亲水性的外表减少血浆蛋白的吸附,使吞噬细胞系统对药物的清理作用下降,从而延长药物在血液中的循环时间达到缓释作用。本试验以乳化聚合法制备黄藤素聚氰基丙烯酸正丁酯纳米粒(F-PBCA-NP),并通过抗感染试验对其药效进行初步评价,为黄藤素纳米粒制剂的临床应用提供参考。
1 材料与方法
1.1 材料
1.1.1 主要材料 金黄色葡萄球菌,西北农林科技大学微生物教研室保存;昆明种小鼠,第四军医大学实验动物中心提供;黄藤素片,云南金柯制药有限公司产品,批准文号Z20063500;黄藤素胶囊,上海华源安徽仁济制药有限公司产品,批准文号Z20050636;黄藤素原料药,含量>95%,云南玉溪万方天然药物有限公司产品;氰基丙烯酸正丁酯(BCA),北京瞬康医用胶有限公司产品,批号061103;泊洛沙姆F-68,上海七叶树贸易有限公司产品;焦亚硫酸钠,分析纯,天津市登峰化学试剂厂产品;磷酸盐缓冲液,用分析试剂纯自制;其他试剂均为分析纯。
1.1.2 主要器材 EB-280型电子天平,日本Shimadzu公司产品;78HW-1型恒温磁力搅拌器,杭州仪表电机厂产品;HH-6型数显恒温水浴锅,常州国华电器有限公司产品;Optima L-100XP超速离心机,美国Beckman公司产品;UV-2102PCS型紫外分光光度计,尤尼柯仪器有限公司产品;2000HSA型激光粒度分析仪,英国Mavlern公司产品;H-600型透射电子显微镜,日本日立公司产品;SKP02.420电热恒温培养箱,黄山市恒丰医疗器械有限公司产品;BCD-208 K/ACJN型冰箱,青岛海尔股份有限公司产品。
1.2 方法
1.2.1 F-PBCA-NP制备 精确称取黄藤素0.1 g加到20 mL蒸馏水中,在30℃恒温水浴中加热溶解配成A液。准确称取表面活性剂右旋糖酐D-70 0.2 g分散在20 mL蒸馏水中加热溶解,冷却后再加入表面活性剂泊洛沙姆 F-68 0.2 g,加蒸馏水至80 mL配成B液。A液和B液分别用0.1 mol/L盐酸调pH至2.0,在搅拌条件下将0.2 g氰基丙烯酸正丁酯(BCA)缓慢滴入B液中,搅拌20 min后再将A液逐步加入,在磁力搅拌器上搅拌7 h,加入附加剂Na2S2050.2 g继续搅拌3 h后用1 mol/L氢氧化钠溶液调pH至5.0,用孔径为0.45 μ m微孔滤膜抽滤,即得F-PBCA-NP溶液。
1.2.2 F-PBCA-NP质量评价
1.2.2.1 外观形态及粒径 F-PBCA-NP溶液加蒸馏水作适当分散后,取1滴~2滴置于覆有支持膜的铜网上停留2 min~3 min,滴入2%磷钨酸溶液,染色2 min~3 min,自然干燥,在透射电镜下观察纳米粒的形态。另取适量F-PBCA-NP溶液加去离子水稀释至适当浓度,用激光粒度分析仪测定粒径。
1.2.2.2 包封率和载药量 F-PBCA-NP溶液经低温超速离心(4℃,25 000 r/m,150 min)后,用紫外分光光度计在273 nm处测定上清液中黄藤素的含量,按下式计算黄藤素纳米粒的包封率和载药量。

其中W1为投药量,W2为上清液中药量,WBAC为高速离心后烘干至恒重的BCA量。
1.2.3 正交设计试验优化制备条件 采用正交设计对影响载药纳米粒形态、粒径、载药量和包封率的主要因素进行优选,确定制备黄藤素纳米粒的最佳条件。即以黄藤素浓度(A),BCA用量(B),右旋糖酐-70+泊洛沙姆F-68(1∶1)用量(C)为试验因素,各取3个水平,采用L9(34)表安排试验(表1)。对各次试验结果进行综合评分[7],形态分(X1,满分10):从样本电镜照片中选出清晰的三张观察,以分散性好、圆整、均匀而不粘连者为佳适当给分;粒度分(X2):X2=X/SD,X为平均粒径,SD为样本偏差;包封率分(X3,满分 10):实测包封率×10;载药量分(X4,满分10):实测载药量×10;总分(X):X=X1+X2+X3+X4。
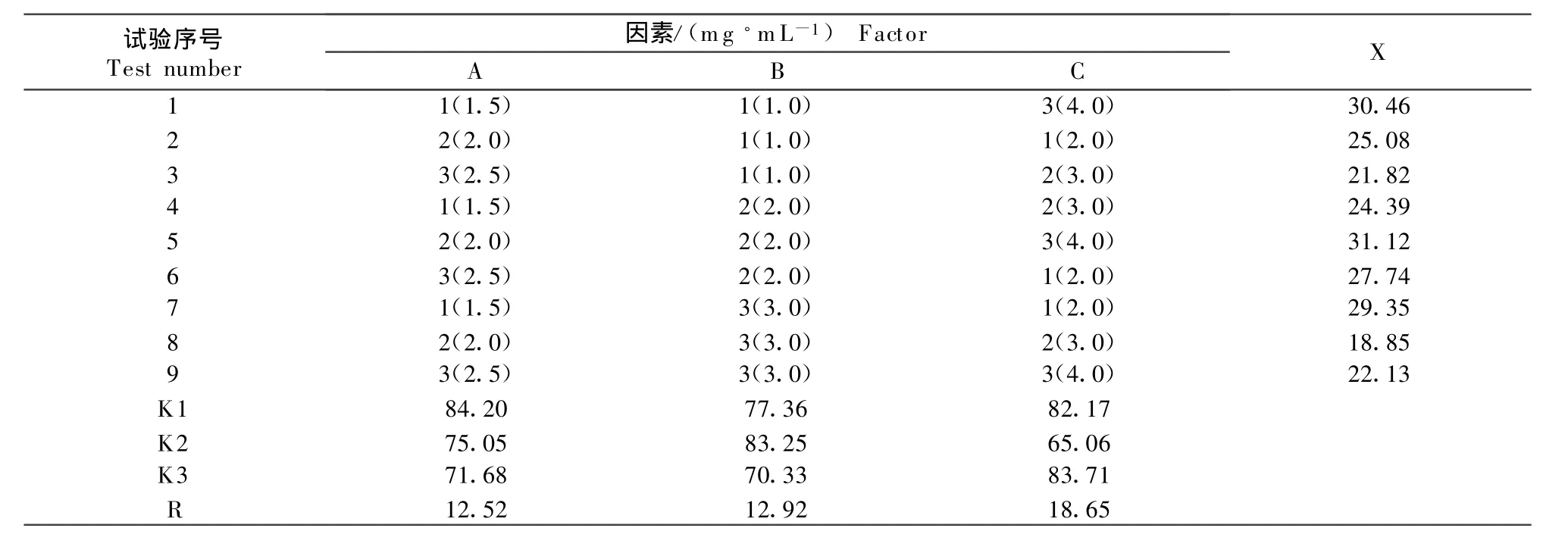
表1 正交试验设计及结果T able 1 Design and result of orthogonal test
1.2.4 抗感染试验
1.2.4.1 菌液制备与动物分组 将金黄色葡萄球菌接种于10 mL的营养肉汤培养基中,在37℃恒温箱中孵育增菌18 h后作为感染原菌液;将原菌液用生理盐水稀释至感染动物所需浓度即1×109/mL[8]。选体重18 g~22 g的健康小鼠并雌雄各半,将小鼠随机分为7组且每组10只即黄藤素片剂组、黄藤素胶囊组、空白纳米粒组;黄藤素纳米粒组、阴性对照组(感染金葡菌而不给药物或感染后给予生理盐水)和阳性对照组(感染后给予盐酸诺氟沙星)及正常对照组(不感染金葡菌也不给药物),灌服剂量为黄藤素70 mg/kg。
1.2.4.2 感染模型的建立和治疗 选取经饲养7 d~10 d后的清洁健康小鼠作为试验动物,试验小鼠除正常对照组外每组小鼠腹腔注入金黄色葡萄球菌0.5 mL,于感染后即刻 6、12、24、48 、72 h 给各组小鼠分别灌胃相应的药物[9],连续观察并记录感染后7 d内小鼠的死亡数;死亡小鼠及时解剖而存活小鼠在末次给药后的次日断颈处死均取心、肝、脾和肺及肾称重以计算脏器重量指数[10]。
2 结果
2.1 正交设计试验优选的制备条件
根据正交试验结果(表1),极差(R)确定主次因素顺序:C>B>A。其中A因素:K1>K2>K3;B因素:K2>K1>K3;C因素:K3>K1>K2,因此确定A1B2C3为最佳处方。故制备黄藤素纳米粒的最佳条件为黄藤素1.5 mg/mL;氰基丙烯酸正丁酯2.0 mg/mL;右旋糖酐-70+泊洛沙姆F-68(1∶1)4.0 mg/mL。按优化条件制备黄藤素纳米粒形态圆整、表面光滑、大小均匀、纳米粒之间无粘连(图1);平均粒径为64 nm,载药量50.9%,包封率67.8%。
2.2 抗感染作用
由表2可知黄藤素纳米粒可提高感染金葡菌小鼠的存活率达到80%,而片剂和胶囊分别为30%和40%,体内抗菌消炎效果不逊于盐酸诺氟沙星且这种效应具有剂量依赖性。
表3显示小鼠感染后心脏和肺脏及肾脏的重量指数没有变化而肝脏和脾脏重量指数上升;在同等剂量条件下黄藤素纳米粒制剂能降低肝脏和脾脏的重量指数,特别是降低脾脏重量指数的效果明显高于普通制剂(P<0.05),空白纳米粒对脏器指数没有影响。
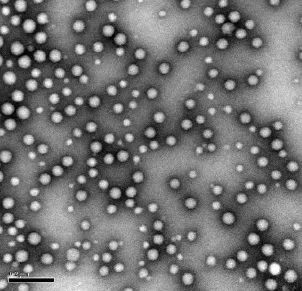
图1 电镜检测的纳米粒形态图(×100 000)Fig.1 F-PBCA-NP by transmission electron microscope(×100 000)

表2 黄藤素纳米粒对金黄色葡萄球菌感染小鼠的保护试验结果Table 2 Protective test results of fibrauretin nanoparticle against S.aureas in mice

表3 黄藤素纳米粒对细菌感染小鼠脏器重量指数影响的结果Table 3 Effects of F-NP on organ weight indexes in bacterialinfection mice
3 讨论
3.1 纳米粒的制备
在载药聚氰基丙烯酸烷酯纳米粒的制备过程中,温度和搅拌速度对纳米粒的成球性和粒径无明显影响。由于BCA的聚合是以H2O中的OH-作为引发剂的,所以控制介质pH是制备纳米粒成败的关键。附加剂的种类和用量可以改变纳米粒表面的电荷性质而影响药物的吸附。所以结合相关文献[11-12],这些条件很容易确定。表面活性剂不仅影响纳米粒的质量参数,还对成球后的纳米粒有稳定作用。药物/BCA的比率影响纳米粒的载药量和包封率,故处方优化应以这3个因素为重点。乳化剂F-68和D-70单独使用时,纳米粒的球形不规则且粒径分布较宽,原因可能在于F-68+D-70的亲水亲油平衡值(HLB)更利于单体BCA的分散,其用量与纳米粒的粒径成负相关,但当用量达到一定程度后,粒径的变化不明显,并且整个纳米粒体系的载药量下降,故表面活性剂的用量一般控制在3%左右。药物和BCA由于水溶性的限制,用量一般都小于1%,增大药物与BCA的比率会使载药量提高而包封率下降,所以两者的比例要适中。由于药物理化性质有差异,会使其与其他药物的制备条件不尽相同,所以要通过试验寻找适合本药物的制备方法。
3.2 抗感染作用
金黄色葡萄球菌是医院内感染最重要的感染原也是社区感染的常见病原菌,研究发现金葡菌对所有β-内酰胺类抗生素耐药,这给临床治疗带来极大困难[13]。抗菌机制不同于β-内酰胺类抗生素的纯中药提取物黄藤素常作为抗菌消炎药用于敏感菌引起的感染,特别对革兰阳性菌中金黄色葡萄球菌的抑制效果最好,故本试验选用金葡菌腹腔感染造模。尽管纳米化后的药物可能具有许多新的特性,但纳米化过程是否会影响抗菌药物的原有特性尤其是抗菌活性,是令人关注和感兴趣的问题也是抗菌药物纳米化必须回答的问题。本试验通过黄藤素纳米化前后对染菌小鼠治疗效果的观察,发现与普通制剂相比较,黄藤素纳米粒不仅能大幅提高小鼠存活率,而且能显著降低患病小鼠脾脏的病理反应,故黄藤素纳米粒的体内抑菌效果优于普通剂型,这与桂卉[14]研制的硫酸链霉素纳米粒和邹龙[15]研制的头孢唑林钠纳米粒的抑菌结果的报道一致,原因来自黄藤素纳米粒改善胃肠道吸收差的状况从而导致药效提高。
[1]Yu Y,Yi Z B,Liang Y Z.Main antimicrobial components of Tinospora capillipes,and their mode ofaction against Staphy lococcus aureus[J].FEBS Letters,2007(581):4179-4183.
[2]Iwasa K,Kim H S,Wataya Y,et al.Antimalarial activity and structure-activity relationships of protoberberine alkaloids[J].Eur J M ed Chem,1998(33):65-69.
[3]Bhadra K,Maiti M,Kumar G S.M olecular recognition of DNA by small molecules:A T base pair specific intercalative binding of cy totoxic plant alkaloid palmatine[J].Biochimica et Biophy sica Acta,2007(1770):1071-1080.
[4]周 玥,蒋学华.黄藤素在大鼠胃肠道中的吸收动力学[J].华西药学杂志,2006,21(2):168-169.
[5]Poupaert J H,Couvreur P.A computationally derived structural model of dox orubicin interacting with oligomeric polyalkylcyanoacrylate in nanoparticles[J].J Controlled Release,2003(92):19-26.
[6]Kreuter J.Application of nanoparticles for the delivery of drugs to the brain[J].International Cong ress Series,2005(1277):85-94.
[7]桂 卉,范学工.链霉素聚氰基丙烯酸正丁酯毫微粒的制备工艺研究[J].解放军药学学报,2004,20(6):408-411.
[8]游雪甫,张伟新,娄人慧,等.红霉素环 11,12-碳酸酯于小鼠体内的抗菌活性研究[J].中国抗生素杂志,2003,28(8):488-490.
[9]薛 玲.结肠清颗粒抑菌作用研究[J].齐鲁药事,2006,25(3):175-177.
[10]桂 卉,邹 龙,范学工.链霉素聚氰基丙烯酸正丁酯纳米粒小鼠体内抗结核菌活性的研究[J].解放军药学学报,2007,23(1):21-24.
[11]戴蔚荃,周长江,崔黎丽,等.聚α-氰基丙烯酸丁酯载药纳米粒的研究进展[J].药学服务与研究,2004(1):33-35.
[12]Soppimath K S,Aminabhavi T M,Kulkarni A R,et al.Biodegradable polymeric nanoparticles as drug delivery devices[J].Journal of Controlled Release,2001(70):1-20.
[13]Ramotar K,Bobrowska M,Jessamine P,et al.Detection of methicillin resistance in coagulase negative staphy lococci initially reported as methicillin susceptible using automated methods[J].Diagn Microbiol Infect Dis,1998,30(2):267-273.
[14]桂 卉.硫酸链霉素纳米粒的制备及其药效学实验研究[D].湖南长沙:中南大学,2005.12-15,28-39.
[15]邹 龙.头孢唑林钠纳米粒的制备及其药效学实验研究[D].湖南长沙:中南大学,2005.21-25.
