PRRSV云南株的分离与鉴定*
2010-09-21段博芳沈艳萍杨贵树吴静敏尹革芬
段博芳,沈艳萍,杨贵树,张 飞,吴静敏,段 纲,尹革芬*
(1.云南农业大学动物科学技术学院,云南昆明 650201;2.振太畜牧兽医站,云南镇沅 666508)
猪繁殖与呼吸综合征(Porcine productive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的以母猪繁殖障碍和仔猪呼吸衰竭为主要症状的传染病,临床症状主要表现为母猪流产、早产、产死胎、产木乃伊胎、仔猪成活率下降和育成猪呼吸道症状等[1]。PPRS于1987年在美国北卡罗来纳州首先发现[2],随后在荷兰、加拿大、德州、英国、西班牙、瑞士、法国等世界许多国家和地区均有发生[3]。1991年Wensvoort G等[4]用猪巨噬细胞(PAM)从发病猪群中分离到PRRSV(欧洲型)。1996年郭宝清等[5]用 PAM 和Marc-145细胞首次从国内发病猪群中分离出PRRSV,随后我国的许多省都相继用肺泡巨噬细胞(pulmonary alveolar macrophage,PAM)和Marc-145细胞分离到PRRSV毒株。自2007年以来,我国有26个省份先后发生了高致病性PRRS疫情,对我国的养猪业造成了极大的危害和重大的经济损失,严重影响了农民的增收和猪肉消费市场的稳定以及养猪业的生产安全。2007年杨贵树等对云南省某些猪场PRRS血清流行病调查表明 PRRS血清阳性率为90.8%[6]。表明PRRS已经在云南省存在,本试验从云南某猪场送检样品(病死猪肺)中分离出一株疑是PRRSV,并对其进行初步鉴定。
1 材料与方法
1.1 材料
1.1.1 病料来源 云南某猪场送检样品,经 RTPCR初步检测为PRRSV阳性。
1.1.2 细胞及相关试剂 Marc-145细胞由云南农业大学动物科学技术学院动物医学实验室保存;原代PAM细胞为自行分离;MEM粉剂(GIBiCO);1640细胞培养液(GIBCO);标准胎牛血清,天津濒洋生物公司产口;双抗,美国GIBCO公司;胰酶粉,T ryPSIn:1:250,华美生物工程公司产品;血样(液体样本)RNA提取试剂盒,百泰克生物有限公司产品;反转录试剂盒,TaKaRa公司。
1.2 方法
1.2.1 病料的处理 按参考文献[7]方法操作,采集发病猪的肺脏,匀浆器研磨后用无血清的MEM制成悬液,冻融3次,2 500 r/min离心15 min取上清,滤网过滤后,0.22 μ m微孔滤膜过滤除菌。置-20℃冰箱保存,作为接种用。
1.2.2 细胞制备
1.2.2.1 Marc-145单层细胞的制备 Marc-145细胞自液氮罐中取出后,迅速置于37℃水浴中快速晃动,使细胞在2 min内很快融化,移入细胞培养皿中。加入含100 mL/L FBS和1/100双抗的MEM营养液,置于37℃、体积分数为5%CO2培养箱中培养,12 h后换液。在随后的培养过程中,观察细胞生长情况,长成单层后进行传代接种。
1.2.2.2 原代PAM的制备 猪臂动脉丛放血致死,剖开胸腔,结扎气管后连同心脏取出完整的肺,去心脏及周围脂肪等组织后,用无菌生理盐水充分漂洗肺表面,除净血块污物。从气管往肺部注入灭菌的PBS液40 mL,轻轻拍打肺表面,2 min后回收灌洗液。重复以上操作,直到共回收约200 mL。将回收的支气管肺泡灌洗液用吸管轻轻吹打,使其细胞团以及黏液块分散,用无菌的100目不锈钢筛过滤,收集全部灌洗液,1 500 r/min离心10 min,弃上清。用无菌PBS重悬细胞沉淀,200目滤网过滤,1 500 r/min离心10 min,弃上清。得到细胞沉淀后按原代单层细胞培养法[8]进行培养,观察细胞生长情况,长成单层后进行接毒。
1.2.3 病毒的分离 按照文献[7]进行。将处理的病料接种于长成单层的M-145细胞和PAM细胞,每瓶1.5 mL;37℃吸附1 h后加入含有50 mL/L血清的培养液。每天观察细胞病变(CPE)情况,当病变至70%~80%收毒,未出现CPE者,经反复冻融3次后取上清盲传3代。
1.2.4 病毒的电镜观察 将分离毒经高速离心浓缩后送电镜室进行电镜观察。
1.2.5 RT-PCR鉴定 按照引物设计原则,参照CH-1a株筛选设计一对引物(p1、p5),该对引物可扩增PRRSV的ORF7特异性片段,其长度为329 bp。p1、p5 的 序列 分 别为 :P1 5′-AATGGCCAGCCAGTCAATCA-3′;P5 5′-TCATGCTGAGGGTGATGCTG-3′
1.2.5.1 培养物中RNA的提取 提取方法按血样(液体样本)RNA提取试剂盒说明书操作。
1.2.5.2 反转录 按反转录试剂盒说明书进行。RT过程中体系的配制需在冰盒上进行;戴手套防止RNA酶污染。
1.2.5.3 PCR反应体系和条件 PCR反应在25 μ L反应体系中进行,依次加入以下成分:ddH2O 18 μ L,10 ×PCR buffer 2.5 μ L,dNTP Mixture(2.5 mmol/L)1 μ L,正 反 方 向 引 物 各 0.5 μ L(10 pmol/μ L),0.5 U Taq 酶,模板 2 μ L,混匀短暂离心后置PCR仪中进行反应。反应程序为:94℃预变性3 min;94℃30 s,58℃30 s,72℃30 s,30个循环;72℃延伸 5 min;4℃保存。用10 g/L琼脂糖凝胶进行电泳(120 V,30 min),观察扩增结果。
1.2.6 动物回归试验 参照文献[7]方法进行,将出现CPE的细胞培养物反复冻融3次后离心取上清,于P2级动物房里,将上清液接种到经RT-PCR检测PRRSV阴性,血清学检测PRV、CSFV抗体阳性的断奶仔猪。每日观察临床症状,并记录体温。定期采血测抗体效价和RT-PCR检测病毒。
1.2.7 间接免疫荧光试验鉴定 试验步骤按参考文献[7]进行,被检标本上滴加一抗为PRRSV阳性抗体,二抗为FIFC标记的羊抗兔IgG。自然干燥后滴加500 mL/L甘油,待干燥后。置于荧光显微镜下观察。
1.2.8 病毒毒价测定(TCID50)参照文献[7]方法进行,取已长满的细胞,经消化后计数至1.5×105个/mL,于 96孔培养板中,每孔加入细胞悬液100 μ L,置 37 ℃、体积分数为 5%的 CO2培养箱中静置培养。病毒液做从10-1~10-10梯度稀释,接种到已长成单层的96孔板中,每一稀释度设8个重复,每孔接种50 μ L,设 16个孔为正常对照。置37℃、体积分数为5%CO2培养箱中培养。每天早晚各观察1次,观察有无细胞病变,逐日观察并记录结果,一般需要观察5 d~7 d。结果按 Reed-Muench两氏法计算。
1.2.9 理化测定 理化特性检验分离病毒株,TCID50滴定方法测定对氯仿、紫外线、pH、热的敏感性。试验方法按参考文献[7]进行。
2 结果
2.1 病毒的致细胞病变效应观察
本试验采用Marc-145和PAM两种细胞对病料进行分离培养。病料在Marc-145细胞经盲传2代~3代后,培养48 h~72 h后可见CPE(图1)。连续传6代后,CPE出现时间稳定,表现为细胞变圆,折光性降低,灶状脱落,呈现大面积空洞。在PAM细胞上接毒后72 h细胞开始出现CPE,表现为细胞堆积,折光性降低(图2)。
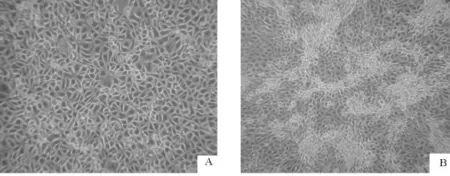
图1 病毒在Marc-145细胞上的增殖Fig.1 Virus proliferation in M arc-145 cells
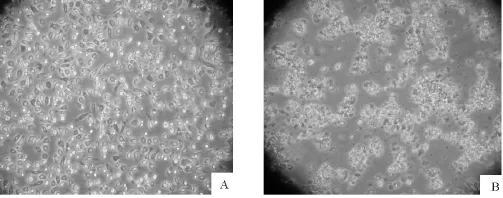
图2 病毒在PAM细胞上的增殖Fig.2 Virus proliferation in the PAM cells
2.2 病毒的电镜观察
1∶40 000电镜下可观察到大小为45 nm~55 nm左右的病毒粒子(图3)。
2.3 RT-PCR检测
在细胞出现明显CPE后,提取细胞RNA进行RT-PCR检测PRRSV,所得结果为阳性(图4)。
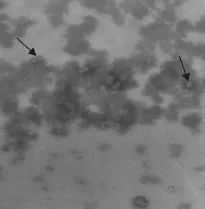
图3 电镜下病毒粒子Fig.3 Virions under electron microscope
2.4 动物接种试验
将出现CPE的细胞培养物反复冻融3次后离心取上清,接种到1月龄PRRSV阴性的仔猪。在接种后1周没出现异常症状,采血测抗体效价1∶40,RT-PCR未检测到病毒。接种2周后仔猪出现体温升高,呼吸急促,并伴有食欲废绝,精神不振等症状,测抗体效价1∶20,RT-PCR能在猪血液中检测到PRRSV(图 5)。
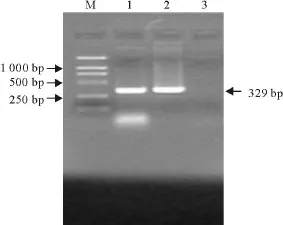
图4 细胞培养物RT-PCR扩增结果Fig.4 RT-PCR results of cell culture product
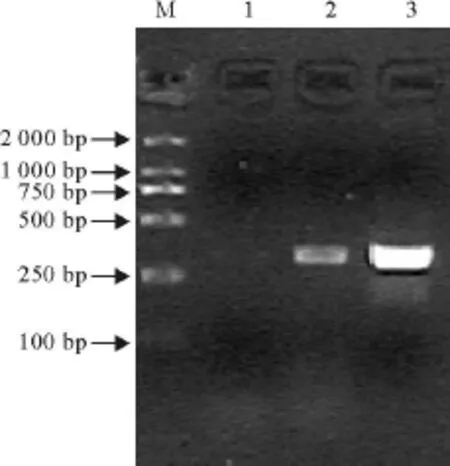
图5 接种猪血液样品RT-PCR扩增结果Fig.5 RT-PCR results of infected porcine blood sample
2.5 间接免疫荧光鉴定
荧光显微镜下观察玻片,在接种Marc-145细胞的胞浆内出现黄绿色荧光:未接种的Marc-145细胞没有见到荧光(图6)。
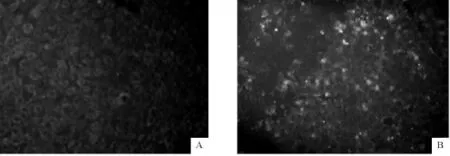
图6 间接免疫荧光试验鉴定病毒Fig.6 Detection of P RRSV in infected Marc-145 cells by IFA
2.6 病毒毒价测定(TCID50)经测定
该分离株病毒的 TCID50为10-4.75/0.1 mL培养物。
2.7 主要理化特性测定
分离的毒株经终浓度48 mL/L氯仿4℃震荡10 min处理后失活;经紫外照射(室温30 min)处理后被灭活;经37℃水浴48 h或56℃水浴45 min后病毒完全失活;病毒经pH 5.0以下或pH 7.5以上在4℃的液体中作用2 h,病毒失活。结果表明,该分离到的病毒对氯仿、紫外线、热、酸碱敏感。
3 讨论
本试验将CPE明显的细胞培养物经高速离心浓缩后经电镜观察鉴定病毒粒子形态,电镜下看到了直径约为45 nm~55nm的圆形颗粒,这与国内相关报道相似[9]。研究表明[10-11],不同的 PRRSV毒株对细胞的嗜性也不同。无论体内或体外培养,PRRSV均可在单核巨噬细胞系统(包括肺泡巨噬细胞PAM、外周单核细胞、肺血管内巨噬细胞等)中复制,但更偏爱在PAM细胞上复制,其产毒量和毒价都较高。在体内,所有毒株对PAM的亲嗜性最高;在体外,欧洲分离株(LV)仅能适应于猪肺巨噬细胞(PAM),并有致细胞病变效应(CPE),美洲分离株除了能在PAM细胞上很好的增殖并产生CPE外,还可在 CL2621、Marc-145、MA-104细胞系培养,并能出现CPE。本试验所分离的 YN-1病毒株除能在PAM细胞上很好增殖并产生CPE外,还能在Marc-145细胞上增殖且产生CPE。表明所分离毒株为美洲株。
虽然尚未发现PRRSV有不同的血清型,但来源于不同地理位置的毒株之间的变异程度很大且流行过程中容易发生变异,因此不同毒株之间也存在着毒力以及抗原性的差异[7,11]。吴家强等[12]研究表明,当培养液pH在7.0~7.2范围时,细胞密度在10×l04~15×l04个/mL范围内,用含 80 mL/L血清的维持液,获得的病毒高滴度是107.32~107.36TCID50/mL;而在相同条件下,严亚贤等[13]报道,上海分离株SH1株病毒,毒价为1×105.9TCID50/mL。而本研究试验得出,细胞培养液pH在7.0~7.4范围内,细胞密度在4×104~5×104个/mL范围内,用含20 mL/L血清的维持液培养,病毒在Marc-145细胞上增殖产生CPE最明显,TCID50较稳定,其毒价为10-4.75/0.1 mL,所分离获得的云南PRRSV分离株为中等毒力毒株。从毒价来看,分离株与国内不同地区分离株之间存在差异。成功分离获得的PRRSV YN-1株将为进一步开展云南省PRRSV感染机制及病原生物学相关研究奠定基础。
[1]Benfield D A,Nelson E,Collins J E,et al.Characterization of swine infertility and respiratory syndrome(SIRS)virus(isolate A TCC VR-2332)[J].Vet Diagn Inves,1992,(4):127-133.
[2]Zhang Y,Shamra R D,Paul P S.MnocoInoal antibodies against confomratinoally dsepndent epeitoeps on porcine reproductive and respiratory syndrome virus[J].Vet Microbiol,1998,63(2-4):125-136.
[3]Shimizu M,Yamada S,Miy M R,et al.Isolation of swine infertility and respiratory syndrome virus from Heko-heko disease of pig s[J].J Vet Met Sci,1994(6):389-391.
[4]Wensvoort G,Terpstra C,PoI J M A,et al.M ystery swine disease in the Netherlands:the isolation of Lely stad virus[J].Vet Q,1991,13(3):121-130.
[5]郭宝清,陈章水.剌文兴,等.应用间接荧光法从国内生殖障碍综合征猪群中检测生殖和呼吸综合征用性抗体的研究[J].中国兽医科技,1996(3):3-5.
[6]杨贵树,刘 杰,王爱茹.云南省蓝耳病血清流行病学调查[J].畜禽业,2007(219):28-29.
[7]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:619-620.
[8]辛 华.现代细胞生物学技术[M].2版.北京:科学出版社,2008:126-128.
[9]程安春,汪铭书,希尼尼根,等.猪繁殖与呼吸综合症病毒四川株分离、鉴定及其病原特性研究[J].黑龙江畜牧兽医,2004(9):15-18.
[10]刘伍海,汪铭书,程按春,等.PRRSV感染Marc-145细胞凋亡的形态学观察[J].黑龙江畜牧兽医,2008(3):61-63.
[11]Hanada K,Suzuki Y,Nakane T.T he origin and evolution of porcine reproductive and respiratory syndrome viruses[J].M ol Biol and Evolut,2005(22):1024-1031.
[12]吴家强,颜世敢,胡北侠,等.细胞培养对PRRSV-SD分离株滴度的影响[J].山东农业科学,2002(6):41-42.
[13]严亚贤,孙建和,王恒安,等.猪繁殖-呼吸综合征病毒上海分离株的病毒特性研究[J].南京农业大学学报,2001,24(2):90-93.
