芽胞抗力快速弱化技术研究
2010-09-25程立庆黄国荣熊鸿燕
张 林,程立庆,黄国荣,向 颖,吴 龙,熊鸿燕
(第三军医大学军队流行病学教研室,重庆 400038)
芽胞抗力快速弱化技术研究
张 林,程立庆,黄国荣,向 颖,吴 龙,熊鸿燕*
(第三军医大学军队流行病学教研室,重庆 400038)
以L-丙氨酸缓冲液为发芽剂,结合芬顿反应原理,观察发芽-氧化损伤效应对芽胞的杀灭效果,以期为新型炭疽疫源地净化方法的深入研究奠定基础。以腊样芽胞为试验菌,采用透射电镜、激光扫描共聚焦显微镜、活菌计数等方法观察芽胞发芽过程的超微结构、核酸含量变化,以及在芬顿反应的联合作用下发芽体的活性变化。在20~30 min的发芽过程中,芽胞核心密度降低,核心与皮质、皮质与外壁之间界限模糊,芽胞外壁和芽胞衣有破裂,通透性增加,进一步有皮质消失、细胞核与细胞质融合、细胞膜基本形成的现象;发芽体荧光强度不断增加,显示菌体中核酸的活性和含量不断增加;发芽体对化学因子的抗力明显下降,H2O2浓度为0.20 mol/L的Fenton反应系统作用60 min时,发芽体灭活可达到3.016个对数级。诱导发芽和反应的联合处理程序可显著提高芽胞的灭活水平。
芽胞;发芽剂;芬顿反应
与相应繁殖体相比,细菌芽胞对理化因素的抵抗作用增加了10~75倍,常规消毒、灭菌方法完全无法清除此类微生物[1-5]。因此,专业机构对炭疽疫源地进行洗消处置时必须采取超常规手段,即采取焚烧加高浓度化学制剂长期浸泡的方法,这些方法对环境的污染非常严重[6-8]。而且,根据近年来生物恐怖袭击的特点,生物污染地往往是在人群高度集中的场所,如建筑内、运输工具内和重要的交通中心等,现场洗消难度和低污染要求增加。因此,在生物防护技术研究中,探索并建立可靠、低污染型的现场净化技术是一项迫切任务。营养物质(氨基酸、次黄嘌呤核苷等)、非营养物质(吡啶二羧酸钙)、物理(压力、磨损等)等因素能够启动芽胞的萌发过程,促使其不断生长,向繁殖体状态转变。在这一过程中,促成细菌芽胞高抵抗力的各种因素,如丰厚的壳质层、芽胞膜内大量吡啶二羧酸钙(CaDPA)包裹的蛋白酶、被α/β-酸溶性小分子蛋白(α/β-type acid-soluble spore proteins,α/β-SASP)包绕的核酸成分,以及多种核酸修复酶等逐渐降解、流失。伴随着这些反应,芽胞的通透性逐渐增加,抗力明显降低[9-11]。这意味着在芽胞启动萌发程序后存在一“脆弱”期,有利于设计“致死性攻击”方法。因此,本课题以L-丙氨酸缓冲液为发芽剂,结合芬顿反应(Fenton reaction)原理,观察发芽-氧化损伤效应对芽胞的杀灭效果,以期为新型炭疽疫源地净化方法的深入研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 冻干腊样芽胞(ATCC10987) 由军事医学科学院微生物流行病研究所提供。
1.1.2 仪器设备 透射电镜(荷兰飞利浦TECNA I-10型);激光扫描共聚焦显微镜(TCS SP5型,德国Leica)。
1.2 方法
1.2.1 芽胞发芽处理 ①芽胞悬液制备[12]:取冻干腊样芽胞用营养肉汤和营养琼脂培养基平板进行增菌和纯化培养。取5.0 mL第3~5代菌液于罗氏瓶进一步培养,置于37℃恒温箱内,培养5~7 d。芽胞染色,镜检。当芽胞形成率达95%以上时收集芽胞。过滤芽胞悬液,清除其中的琼脂凝块;离心、清洗(3000 r/min离心10 min)3遍。将洗净的芽胞悬浮于三角烧瓶内蒸馏水中,并加入适量小玻璃珠。将芽胞液放于80℃水浴中10 min,以杀灭残余的繁殖体。待冷至室温后,保存于4℃冰箱中备用;②L-丙氨酸发芽剂制备:将L-丙氨酸(加拿大B I O BASIC I NC)加入10 mmol/L Tris/HCl(pH 8.5)缓冲液中,使L-丙氨酸终浓度为200 mmol/L;③引导发芽:将稀释于PBS缓冲液中的芽胞(107cfu/mL左右)在70℃恒温水浴箱水浴30 min,然后37℃孵育15 min[13-15];以1∶1的比例将芽胞悬液加入发芽剂中,在室温下作用20 min。
1.2.2 发芽过程的形态学观察 ①透射电镜观察:将2~3 mL经发芽剂处理的芽胞悬液离心(2000~2500 r/min),使芽胞成团,用适量2.5%戊二醛进行固定。0.1 mol/L PBS漂洗2次,用1%锇酸进行后固定2 h,再用0.1 mol/L PBS漂洗2次,用丙酮梯度脱水后浸透包埋、脱水、切片、双铅染色,在透射电镜下观察(80 KV),每个样本观察20~30个视野;②激光扫描共聚焦显微镜观察[16]:吸取萌发后的芽胞悬液样本20~30μL滴加在载玻片上,用30~50μL 2.5%戊二醛进行固定,再滴加50~100μL 100 ng/mL DAPI荧光染液(4′,6-diamidino-2-phenylindole;4′,6-二脒基-2-苯基吲哚),使其覆盖样品,染色10 min后,用新鲜配置的PBS缓冲液轻轻冲洗2~3次,盖上盖玻片,在激光扫描共聚焦显微镜下观察。
1.2.3 芬顿反应杀菌试验 芬顿反应系统的设计:按照经典的芬顿反应方法[17],以H2O2、Fe2+和EDTA为核心成分,制备3个芬顿反应系统。3个系统中,H2O2浓度分别为0.05、0.1、0.2 mol/L,H2O2与Fe2+摩尔比为9∶1。稀释液为二次去离子水。杀菌试验:按照《消毒技术规范》要求[12],室温下,在无菌大试管中加入0.5 mL发芽的芽胞混悬液,再加入0.5 mL有机干扰物质,混匀,置20℃水浴5 min,分别加入3种芬顿反应系统的反应液4.0 mL与其混合,在10、30、60 min时分别取混悬液0.5 mL,置于4.5 mL 1 mmol/L二甲基亚砜液(中和剂)中,中和10 min后分别取1.0 mL进行活菌计数。试验同时,以芽胞为对象,在相同条件下进行芬顿反应的杀菌观察,以作为对照观察;此外,以芬顿反应所用稀释液代替芬顿反应液,进行平行试验,作为空白对照组;以浓度1.00 mol/L H2O2液代替芬顿反应液,进行平行试验,作为实验对照组。各试验点均平行3个样本试验。以上试验中芽胞浓度为1.8×107/mL;芽胞发芽体的浓度为1.8×107/mL。
2 结 果
2.1 发芽过程中芽胞的超微结构变化观察
从超微结构观察可见(见图1),发芽20 min时的芽胞核心密度降低,核心与壳质、壳质与外壁之间界限模糊,芽胞外壁和芽胞衣有破裂,通透性增加;30 min时的芽胞壳质消失,细胞膜基本形成,细胞核与细胞质融合。
2.2 发芽过程中菌体的超微结构变化观察
经DAPI荧光染色后,随着发芽时间的增加发芽体荧光强度不断增加(见图2),显示菌体中核酸的活性和含量不断增加。
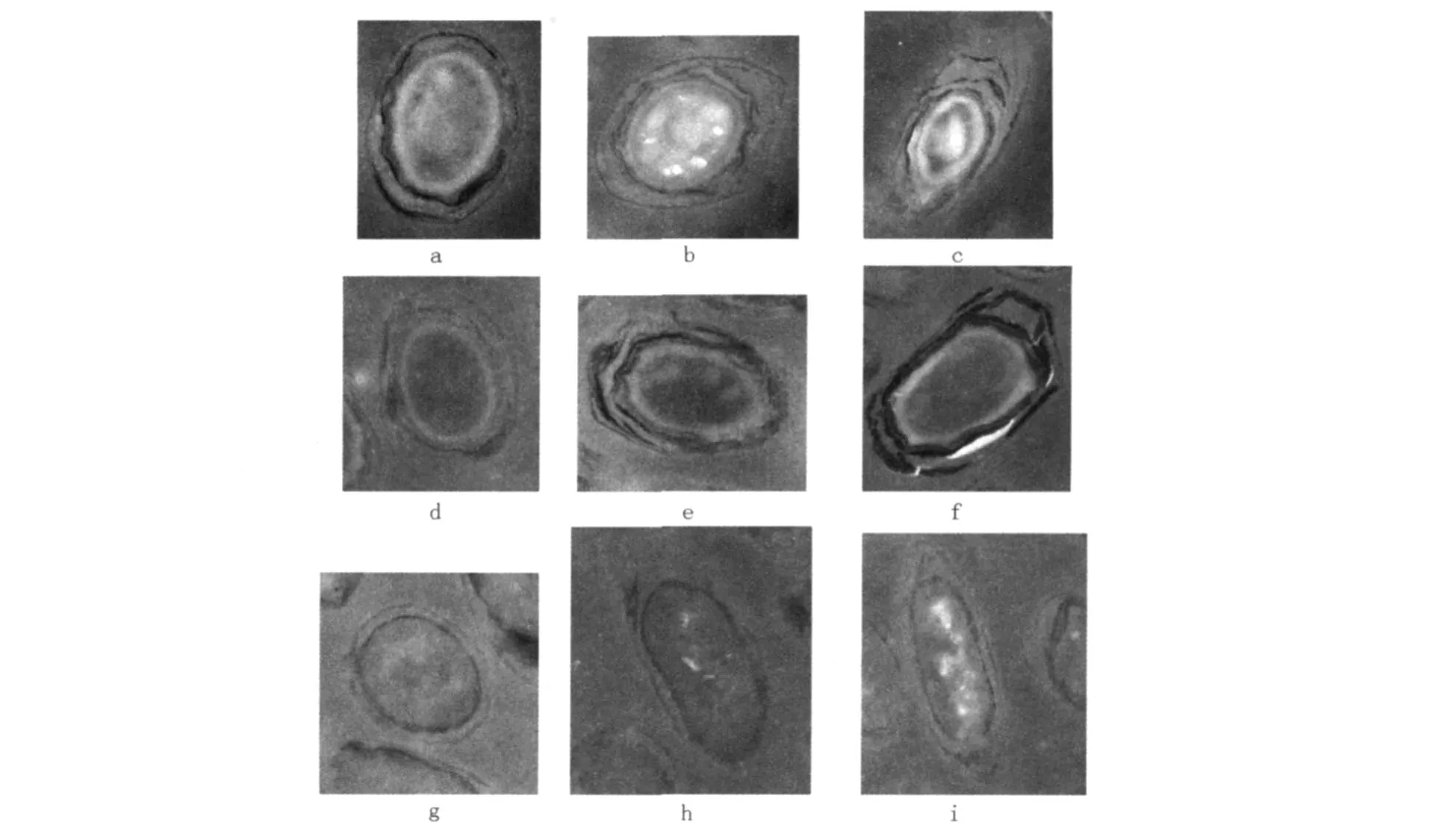
图1 芽胞发芽过程的超微结构变化(37000×)Fig.1 The ultrastructure changes of spore germination(37000×) a、b、c:不同切面正常芽胞:结构清晰,核心、皮质、芽胞衣、外壁很完整,b图还可见核心和皮质之间的内膜,皮质和芽胞衣之间的外膜;d、e、f:发芽20 min的菌体:核心密度降低,核心与皮质、皮质与外壁之间界限模糊,芽胞外壁和芽胞衣有破裂;g、h、i:发芽30 min时菌体:芽胞皮质消失,细胞膜基本形成,细胞核与细胞质融合

图2 芽胞发芽过程中核酸荧光染色变化(1000×)Fig.2 Nucleic acid fluorescent staining changes of spore germination(1000×) a:正常芽胞;b:发芽20 min时的菌体;c:发芽30 min时的菌体
2.3 芬顿反应系统对芽胞和发芽体的杀灭作用
杀菌试验显示,芽胞对单纯的H2O2溶液有明显的抗力,经浓度为1.00 mol/L的H2O2溶液作用60 min时只能达到0.084个对数级的杀灭效果。但发芽体抗力明显下降,相同浓度和作用时间杀灭数量达到1.229个对数级。与单纯的H2O2溶液相比,芬顿反应系统有明显的杀菌增效作用,H2O2浓度为0.20 mol/L的在反应系统中作用60 min时,芽胞杀灭数量可达到0.129个对数级,发芽体可达到3.016个对数级。

表1 芬顿反应系统和单纯的H2O2溶液杀菌作用Table 1 The sterilization effect of Fenton reagent and hydrogen peroxide on spore
3 讨 论
发芽诱导与芬顿反应系统的杀菌作用:细菌芽胞的高抵抗Fe2+力是与其丰厚的外壁、皮质、芽胞膜内大量吡啶二羧酸钙(CaDPA)包裹的蛋白酶、被α/β-酸溶性小分子芽胞蛋白(α/β-type acid-soluble spore proteins,α/β-SASP)浸润的核酸成分,以及多种核酸修复酶等因素密切相关的。在萌发过程中,进入始动期(initiation)末时,各种促成芽胞具有高抗力的因素逐渐瓦解,如CaDPA的大量外流以及α/β-SASP迅速降解,芽胞的通透性增加,抗力明显降低。这就意味着,促使芽胞启动萌发过程而后进行攻击是杀灭芽胞的一个有效途径。近年来,国内外研究者开始利用这种原理,探索了理化因素、生物酶和噬菌体等与其联合作用的杀菌效果,相关结果展示出可喜的应用前景[18-20]。
本研究利用浓度为200 mmol/L L-丙氨酸发芽剂诱导芽胞发芽,在发芽剂作用20~30 min时,芽胞核心密度降低,核心与皮质、皮质与外壁之间界限模糊,芽胞外壁和芽胞衣有破裂,进一步皮质消失,细胞核融合,细胞膜基本形成,包体核酸的活性显著提高,菌体抗力降低,在H2O2浓度为0.2 mol/L的反应条件下,发芽芽胞的杀灭量达到3个对数级。基本实现了低杀菌剂浓度,高滴度灭活菌体的目标。但是,此处理方式不能进一步提高对菌体的杀灭程度,其原因可能是在发芽诱导程序中少量芽胞(10%左右)未能复苏发芽。因此,在进一步研究中,将探索改良发芽程序,以提高发芽率。
芬顿反应的应用价值:芬顿反应[21]是利用催化剂或光辐射或电化学作用,通过H2O2产生羟基自由基(·OH)处理有机物的技术。系统中主要成分为H2O2和Fe2+,其中H2O2与Fe2+的比例一般在5~25∶1,pH 3~5。H2O2在Fe2+的催化作用下分解产生·OH。羟基自由基的氧化电位达到2.8 V,是除元素氟外最强的无机氧化剂,可通过电子转移等途径将有机物(羧酸、醇、酯等有机化合物)氧化分解成无机小分子,这种反应体系即可以杀灭细菌,又可以分解有机物。
芬顿反应中,Fe2+被氧化成Fe3+,同时分解H2O2并释放·OH。新生成的Fe3+一部分发生水解,另一部分继续参与反应,重新被还原成Fe2+。在此体系中,pH、H2O2浓度、Fe2+/Fe3+比例均可影响·OH水平。有研究显示,在低Fe2+的量时,增加其投加量可有效促进羟基自由基的生成;过高浓度的Fe2+在氧化过程中,将导致反应启动过程中双氧水被迅速催化产生大量活性羟基自由基,造成游离羟基自由基的积聚,使自由基自身反应,反而影响对有机物的氧化作用[22]。本研究以细菌芽胞的发芽体为试验对象,经过实验筛选,从反应效果和处理成本因素考虑,将Fe2+与H2O2摩尔比设为1∶9。研究结果可见,在芬顿反应中, H2O2浓度为0.2 mol/L的反应体系可杀灭发芽芽胞体3.016个对数级,而单纯的H2O2溶液在浓度为1.0 mol/L时只能杀灭1.229个对数级。显示系统中产生的·OH有更高的杀菌效应。由于·OH存在浓度低、反应活性大、寿命短,滞留的毒性和污染问题小,因此,在深入研究进一步提高杀灭效率的基础上,将芬顿反应与发芽剂结合,作为疫源地的洗消制剂是值得推广的。
[1]Blatchley E R,ASCE AM,Meeusen A,et al.Inactivation of Bacillus Spores by Ultraviolet or Gamma Radiation[J].Journal of environmental engineering,2005,1251:1245-1251.
[2]Knudson,G.B.Photoreactivation of ultraviolet-irradiated,plasmid-bearing and plasmid-free strains of Bacillus-anthrac[J]. Appl.Environ.Microbiol,1986,52(3):444-449.
[3]Nicholson WL,Munakata N,Horneck G,et al.Resistance of Bacillus endosporesto extreme terrestrial and extraterrestrial environments.Microbiol[J].Mol.Biol.Rev,2000,64(3):548.
[4]Setlow P.DNA in dormant spores of Bacillus speciesis in an A-like conformation.Mol[J].Microbiol,1992,6(5):563-567.
[5]Setlow P.I will survive—Protecting and repairing spore DNA [J].J.Bacteriol,1992,174(9):2737-2741.
[6]Manchee RJ,Brosler MG,Stagg A J,et al.Formaldehyde solution effectively inactivates spores of Bacillus anthracison the Scottish Island of Gruinard[J].Appl Environ Microbiol,1994, 60(11):4167-4171.
[7]杨瑞馥.炭疽芽胞恐怖及其相关问题[J].军事医学科学院院刊,2002,26(1):1-4.
[8]Cieslak TJ,Eitzen EM Jr.Bioterrorism:agents of concern[J]. J Public Health Manag Pract,2000,6(4):19-29.
[9]Setlow P.I will survive:DNA protection in bacterial spores [J].Trends in Microbiol,2007,15(4):172-180.
[10]Setlow P.Spore germination[J].Current Opinion in Microbiology,2003,6(6):550-556.
[11]Raju,D.Waters M,Setlow P,et al.Investigating the role of small,acid-soluble spore proteins(SASPs)in the resistance of Clostridium perfringensspores to heat[J].BMC Microbiol, 2006,6:50.
[12]中华人民共和国卫生部.消毒技术规范[S].2002:15-44.
[13]Wuytack EY,Soons J,Poschet,et al.Comparative study of pressure-and nutrient-induced germination ofBacillus subtilis spores[J].Appl Environ Microbiol,2000,66(1):257-261.
[14]Clements MO,Moir A.Role of the ger I Operon of Bacillus cereus 569 in the Response of Spores to Germinants[J].J.Bacteriol, 1998,180(24):6729-6735.
[15]Broussolle V,Gauillard F,Nguyen-The C,et al.Diversity of spore germination in response to inosine and L-alanine and its interaction with NaCl and pH in the Bacillus cereusgroup[J].J Appl Microbiol,2008,105(4):1081-1090.
[16]http://www.microimage.com.cn/uploadfile/xwjs/uploadfile/ 201007/20100713023815328.pdf
[17]孙德智.环境工程中的高级氧化技术[M].北京:化学工业出版社,2002:125-139.
[18]Hornstra LM,Leeuw PLA,Moezelaar R,et al.Germination of Bacillus cereusspore adhered to stainless steel[J].International Journal of Food Microbiology,2007,116(3):367-371.
[19]张利军,熊鸿燕,张耀,等.营养启动剂诱导类炭疽芽胞发芽的研究[J].中华流行病学杂志,2005,26(3):203-210.
[20]Akhtar S,Paredes-Sabja D,Torres J.A,et al.Strategy to inactivate Clostridium perfringensspores in meat products[J].Food Microbiology 2009,26(3):272-277.
[21]http://www.lenntech.com/fenton-reaction.htm
[22]苑宝玲,陈一萍,李艳波,等.Fenton催化氧化降解藻毒素MCLR的效能研究[J].环境科学学报,2005,07(7):925-929.
Rapid Weakening Techniques of Germ Resistance
ZHANG Lin,CHENG Li-qing,HUANG Guo-rong,XIANG Ying,WU Long,XIONG Hong-yan
(Teach.&Res.Div.of Troops Epidemics,The Third Milt.Med.Uni.,Chongqing400038)
Based on the germination agent of L-alanine buffer combined with the principle of Fendun reaction,the killing result of germination-oxidation traumatic effects against germ were observed so as to lay down foundation of studying deeply on cleaning methods of the epidemic source new type of anthrax.The germ of Bacillus cereus was used as a test bacteria and observed its super microstructure of its germination process,content changes of nucleic acid through trans mission electron microscope,laser scanning confocal microscope,living cell counting etc.,as well as the activity changes of germinant body under the united effect of Fenton method.The results showed that during the germinant process in 20~30 min.the density of core were decreased and the margins between core and cortex,the bounds cortex and exospore were blurred;and there were some break at the exospore and coat,the per meability increased, some cortex vanished,nuclei and protoplasm fused,and cell membrane basically formed,and fluorescence intensity germination body continuously increased,indicating the activity and content of nucleic acid of thallus continuously increased;the resistance of germination body against chemical factor obviously decreased.After treated by Fenton reaction(0.2 mol H2O2)for 60 min,the inactivation of germination body was as high as 3.016 logarithmic level.Therefore,joint treatment procedure of germination with reaction could obviously increase the inactivation level of germs.
spore;germination agent;Fenton reaction
Q939.1
A
1005-7021(2010)06-0027-05
重庆市科委攻关课题(CSTC,2008AC5005)
张林 男,硕士研究生。主要从事传染病流行病学研究。E-mail:monkcrazy@126.com
*通讯作者。Tel:023-68752287,E-mail:hongyanxiong@sohu.com
2010-10-25;
2010-11-20
