α-酮戊二酸对免疫应激仔猪肝脏氨基酸代谢的影响
2010-09-22李永塘付大波侯永清丁斌鹰刘玉兰朱惠玲
李永塘 付大波 侯永清 丁斌鹰 刘玉兰 朱惠玲
在内毒素脂多糖诱导的免疫应激下,为抵抗有害刺激,会导致机体基础代谢提高、抗体生成上升,氨基酸糖异生的量上升[1]。AKG是谷氨酰胺(Gln)的最佳替代物,可以提高人肌肉内游离谷氨酰胺的水平,应激状态下可促进肌肉蛋白质的合成[2-3]。已有研究表明,应激会影响机体部分氨基酸的代谢[4]。Lambert等(2002)[5]对仔猪的研究表明,日粮中添加AKG后能显著增加门脉中Leu、Lys和Pro的水平,有提高门脉中Ile的趋势。肝脏是机体清除内毒素的主要场所,肝脏也是内毒素引起的全身炎症反应中受损最严重器官之一[6]。因此LPS刺激可能会对仔猪肝脏氨基酸代谢造成影响。
当前国内外尚未见AKG对免疫应激仔猪氨基酸代谢影响的报道。本试验应用多次LPS刺激建立仔猪免疫应激模型,研究日粮中添加1%AKG对免疫应激仔猪肝脏氨基酸代谢的影响,为AKG的应用提供依据。
1 材料与方法
1.1 试验材料
脂多糖(LPS):由Sigma公司提供,大肠杆菌血清型055:B5。α-酮戊二酸(AKG):含量99.8%,市售医药级产品。
1.2 试验动物分组及免疫应激模型建立
选取健康,来源、体重基本一致的(24±1)日龄断奶仔猪[杜洛克×长白×大白,(7.25±0.23)kg]24 头,随机分为3个处理组,每组设8个重复,每个重复1头猪。3个处理组分别为:对照组、应激对照组(LPS组)和试验组(AKG组)。各组基础日粮一致,空白对照组和应激对照组饲喂基础日粮+1%淀粉,AKG组饲喂基础日粮+1%AKG。试验期为17 d。LPS组和AKG组仔猪分别于第 10、12、14 和 16 d 腹膜注射 80 μg/kg BW 的LPS,空白对照组注射相应剂量的灭菌生理盐水。在第17 d,所有仔猪用戊巴比妥钠(50 mg/kg BW)进行麻醉后屠宰,取肝脏组织,于液氮中速冻后,转入-80℃冰箱中保存待分析。
1.3 试验日粮组成与营养水平
基础日粮参照(NRC 1998)10~20 kg猪的营养需要[4]配制(见表1)。AKG组日粮为基础日粮+1%AKG,对照组和LPS组的日粮为基础日粮+1%的淀粉。
1.4 测定指标及方法
称取100 mg的肝组织置于匀浆器中,加入1.5 mol/l高氯酸1 ml,匀浆后分别两次用3 ml的三蒸水漂洗,将漂洗液转移至15 ml的离心管中,缓慢加入2 mol/l碳酸钾 0.5 ml,混匀,然后 3 000×g/min 离心 5 min,取上清液于-80℃保存待测。
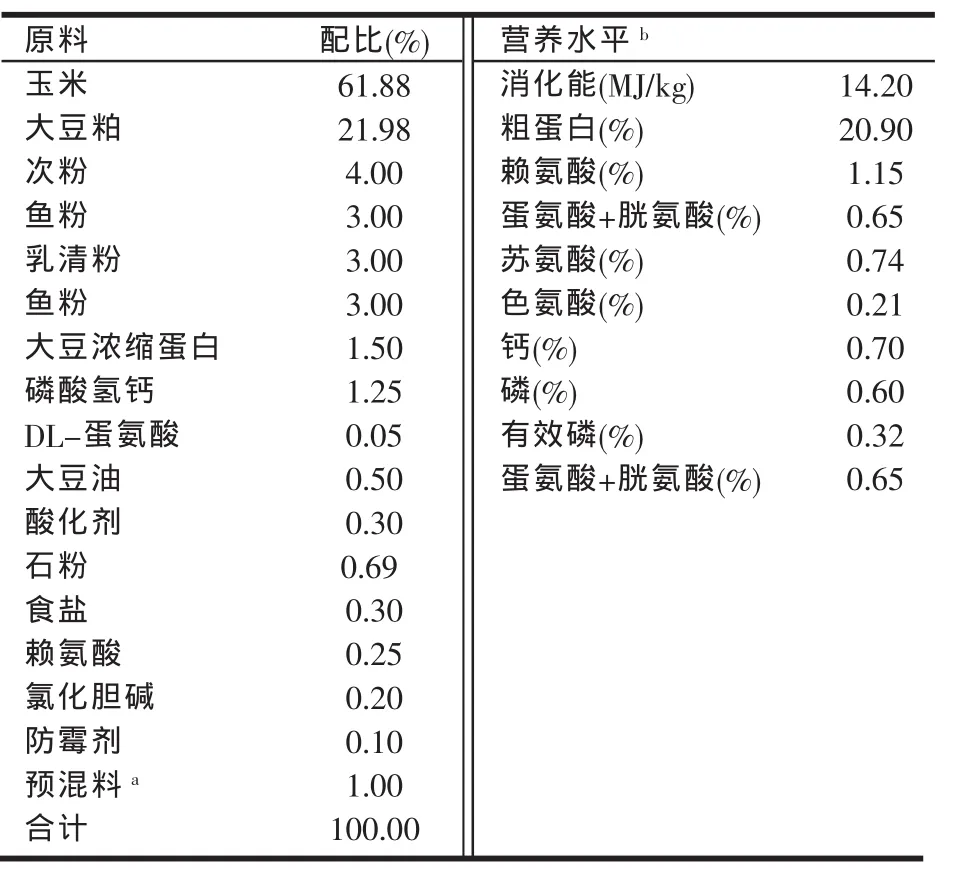
表1 基础日粮组成及营养水平
采用高效液相色谱法测定肝脏组织中的18种游离氨基酸:天冬氨酸(Asp)、谷氨酸(Glu)、天冬酰胺(Asn)、丝氨酸(Ser)、瓜氨酸(Cit)、苏氨酸(Thr)、牛磺酸(Tau)、丙氨酸(Ala)、酪氨酸(Tyr)、色氨酸(Trp)、蛋氨酸(Met)、缬氨酸(Val)、苯丙氨酸(Phe)、异亮氨酸(Ile)、亮氨酸(Leu)、鸟氨酸(Orn)、赖氨酸(Lys)、脯氨酸(Pro)。 具体操作见 Wu 等(2008)[7]的文献。 采用Waters Breeze高效液相色谱系统,包括二元梯度泵和自动进样器。色谱条件:色谱柱为Waters XTerra MS C18(4.6 mm×150 mm,5 μm);流动相 A(0.1 mol/l的乙酸钠,pH 值 7.2),流动相 B(100%甲醇),流速1.1 ml/min;荧光法检测器,激发和发射波长分别为340和455 nm。
1.5 数据处理
采用SPSS 16.0软件进行单因素方差分析(ONEWAY ANOVA)和Duncan's方法多重比较,结果均以“平均值±标准差”表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析(见表2)
由表2 可见,LPS 刺激后,肝脏 Asp、Asn、Ser、Cit、Thr、Tau、Trp、Met、Val、Phe、Ile、Leu、Orn 和 Pro 浓度均未受到显著性影响(P>0.05);LPS组肝脏Lys浓度较对照组有下降的趋势(P<0.1),降低了 20.02%;Tyr浓度降低了18.18%,差异显著(P<0.05)。AKG组Glu浓度较对照组和LPS组均有上升的趋势(P<0.1),分别上升了 20.71%和 15.56%,Ala浓度较 LPS组上升了37.33%(P<0.1),但与对照组差异不显著(P>0.05)。
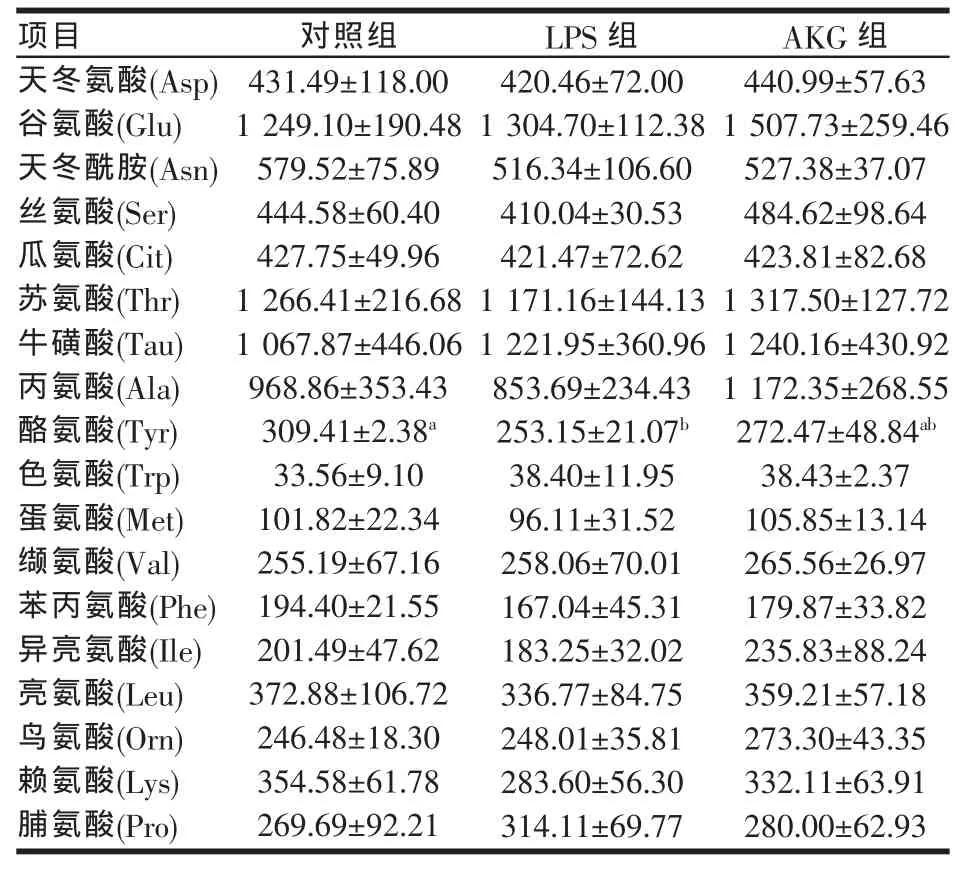
表2 AKG对免疫应激下仔猪肝脏游离氨基酸含量的影响(nmol/ml)
3 讨论
进入肝脏的AKG在丙氨酸转氨酶作用下与丙氨酸反应生成谷氨酸和丙酮酸,也可在天门冬氨酸转氨酶的作用下与天冬氨酸反应生成谷氨酸和草酰乙酸。谷氨酸在谷氨酸脱氨酶作用下通过脱氨基产生氨和AKG,而转氨酶催化下将谷氨酸一个氨基的一部分转移到α-酮酸,形成AKG和相应的支链氨基酸。AKG还可以与肝内的氨结合生成谷氨酸,谷氨酸再与氨结合生成谷氨酰胺,因此AKG可以作为NH4+的清除剂。另外,经α-酮戊二酸进入三羧酸循环的氨基酸有精氨酸、组氨酸、谷氨酰胺、脯氨酸以及谷氨酸等谷氨酰胺族氨基酸,同样,α-酮戊二酸也能通过三羧酸循环途径改变其他氨基酸的代谢,直接或间接发挥其生理功能。谷氨酸、天冬氨酸、天冬酰胺、瓜氨酸和脯氨酸均为功能性氨基酸,不仅对动物的正常生长和维持是必需的,而且对很多生物活性物质的合成也是必需的(Wu,2007)[8]。本试验中 AKG 组与 LPS组比较谷氨酸、天冬氨酸、天冬酰胺、瓜氨酸均有所提高。
动物处于免疫应激时,机体的养分从用于生长转向优先满足免疫系统代谢改变的需要。动物应激时基础代谢提高、骨骼肌蛋白沉积下降、肝急性期蛋白合成上升、抗体生成上升、氨基酸糖异生的量上升[1],这就意味着免疫应激状态下动物机体代谢的改变很可能会影响动物的氨基酸需要模式。李建文等(2006)[9]以仔猪[(9.03±0.63)kg BW]为研究对象,在试验的前1 d、试验第2、4、6 d给应激组注射200 μg/kg BW脂多糖,正常组注射等剂量的无菌生理盐水,结果表明与正常条件下的氨基酸模式相比,应激条件下氨基酸模式中Met和Thr略有下降,而Trp有很大程度的增加(正常情况下Trp为21,应激情况下Trp为29),研究还指出:肌肉蛋白质与急性期蛋白质氨基酸组成的差异表明,免疫应激期内对Phe和Trp的需求增加是为了满足急性期蛋白质合成。高蔚娜等(2008)[10]以大鼠为研究对象,用H2O2诱导大鼠肝细胞发生氧化应激,研究了槲皮素对氧化应激大鼠肝细胞氨基酸代谢的影响,结果显示氧化应激下大鼠肝脏Met、His和Ala含量显著减少,Tau含量增加。Met、His和Ala转氨基后生成的丙酮酸以及应激过程中生成Tau都可作为活性氧的清除剂[11],Met、Tau、His等氨基酸可能是氧化应激防御机制的组成部分,参与哺乳动物对氧化应激生理-病理反应的调节。Kristensen等(2002)[12]以猪为研究对象,研究表明通过肠道补充AKG能促进体内Pro的合成,增加动脉血中Pro的含量(P<0.05),并有增加动脉血中Gln的含量的趋势(P<0.1),而Pro对于胶原蛋白的合成过程起着重要的作用。同时,通过从肠道添加 AKG能增加门脉中 Leu、Lys和 Pro的浓度 (P<0.05),并有提高门脉中 Leu和Ile浓度的趋势 (P<0.1)。 Tatara 等(2005)[13]以火鸡为研究对象,通过每天在火鸡日粮中添加0.4 g/kg BW的AKG,试验期为97 d,结果表明 AKG组血浆中 Tau、Pro、Leu的浓度显著高于对照组 (P<0.05),而Gln浓度显著低于对照组(P<0.05)。
本试验结果显示,多次LPS刺激后,仔猪肝脏Tyr含量显著下降(P<0.05);Lys含量有下降的趋势(P<0.1)。其可能原因是免疫应激增加了肝脏对Tyr和Lys的需求以用于满足急性期蛋白的合成。由本试验结果还可以看出,AKG组Tyr、Lys的含量与LPS组和对照组差异均不显著,并且Ala的含量较LPS组有上升的趋势,而Glu的含量较对照组和LPS组均有上升的趋势。其可能原因是AKG能通过直接或间接的途径激活肝脏Glu和Ala的生成途径,Glu可能用作受损肝脏修复的能量供应燃料,而Ala可能通过转氨基生成的丙酮酸作为活性氧的清除剂[12]。试验结果表明LPS刺激影响了肝脏组织中部分游离氨基酸的含量,而AKG可以在一定程度上缓解LPS刺激对肝脏氨基酸代谢的影响。
4 结论
AKG能在一定程度上缓解免疫应激对仔猪氨基酸代谢的影响,减轻LPS刺激对仔猪肝脏损伤。
[1]Feldmann M,Dale D.Cell cooperation in the immune response[J].Immunology,1989(2):147.
[2]Pierzynowski S G,Sjodin A.Perspectives of glutamine and its derivatives as feed additives for farm animals[J].J.Anim.Feed Sci.,1998,7:79-91.
[3]Blomqvist B I,Hammarqvist F,von der Decken A,et al.Glutamine and alpha ketoglutarate prevent the decrease in muscle free glutamine concentration and influence protein synthesis after total hip replacement[J].Metabolism,1995,44(9):1215-1222.
[4]王天芳,杨维益,梁嵘,等.体康复对运动性疲劳大鼠海马组织中游离氨基酸的影响[J].北京中医药大学学报,1998,21(4):26-29.
[5]Lambert B D,Stoll B,Niinikoski H,et al.Net portal absorption of enterally fed alpha-ketoglutarate is limited in young pigs[J].J.Nut.,2002,132:3383-3386.
[6]Risuke K,Shigeru M.The molecular pathologenesis of Endotoxic shock and organ failure[J].Molecular Medicine Today,1999(3):123-132.
[7]Wu G Y,Meininger C J.Analysis of citrulline,argninine,and methylarginines using high-performance liquid chromatography[J].Methods in Enzymlology,2008(440):177-189.
[8]Wu G Y,Bazer F W,Davis T A,et al.Important roles for the arginine family of amino acids in swine nutrition and production[J].Livestock Science,2007(112):8-12.
[9]李建文,陈代文,张克英,等.免疫应激对仔猪理想氨基酸平衡模式影响的研究[J].畜牧兽医学报,2006,37(1):27-34.
[10]高蔚娜,郭长江,吴健全,等.槲皮素对氧化应激大鼠肝细胞氨基酸代谢的影响[J].氨基酸和生物资源,2008,30(1):53-56.
[11]Livine R L,Berlett B S,Moskovitz J,et al.Methionine residues may protect proteins from critical oxidative damage[J].Mech Ageing Dev.,1999,107(3):323-332.
[12]Kristensen N B,Jungvid H,Fernandes J A,et al.Absorption and metabolism of alpha-ketoglutarate in growing pigs[J].J.Anim.Physiol Nutr.,2002,86:1-7.
[13]Tatara M R,Brodzki A,Krupski W,et al.Effects of α-ketoglutarate on bone homeostasis and plasma amino acids in turkeys[J].Poultry Sci.,2005,84:1 604-1 609.
