大鼠肾小球系膜细胞活性氧簇JAK2/STAT5通路与TIMP-1之间的关系及对其凋亡的影响
2010-09-18温文斌林洪丽吴泰华马艳梅夏丽华单路娟
温文斌 林洪丽 吴泰华 马艳梅 夏丽华 单路娟
大鼠肾小球系膜细胞活性氧簇JAK2/STAT5通路与TIMP-1之间的关系及对其凋亡的影响
温文斌1林洪丽2*吴泰华2马艳梅3夏丽华4单路娟2
目的:探讨高糖(HG)条件下大鼠肾小球系膜细胞(RMC)活性氧簇(ROS)、JAK2/STAT5信号通路与金属蛋白酶1组织抑制剂(TIMP-1)之间的关系及对其凋亡的影响。方法:在HG培养条件下的RMC中,根据是否使用DPI(NADPH氧化酶特异性抑制剂,可抑制ROS产生)和AG490(JAK 2特异性抑制剂)刺激24 h,将 RMC分为 HG组、HG+AG490组、HG+DPI组和 HG+AG490+DPI组四组。采用流式细胞技术检测各组细胞的凋亡率,RT-PCR检测各组RMC Bcl-xl、Cyclin D1、P27kip1、JAK 2和TIMP-1m RNAs的表达,Western blot检测胞浆中JAK2、STAT5及相应磷酸化蛋白的表达。结果:HG组、HG+AG490组、HG+DPI组和HG+AG490+DPI组的细胞总凋亡率分别为:(10.69±0.26)%、(20.52±0.51)%、(24.56±0.36)%和(26.01±0.28)%;加入 AG490和(或)DPI后 RMC总凋亡率明显升高(P<0.01),Bcl-xl、Cyclin D1、JAK 2和TIMP-1m RNAs表达显著减少,P27kip1mRNA表达增加。AG490和(或)DPI可使各组RMC P-JAK 2和P-STAT5的表达显著减少,尤其在加入DPI后减少更加明显。结论:HG条件下JAK 2/STAT5信号通路受ROS调控;阻断ROS生成和(或)JAK 2/STA T5信号通路,可使RMC TIMP-1mRNA表达减少,凋亡增加。
系膜细胞;活性氧簇;JAK 2/STA T5信号通路;金属蛋白酶1组织抑制剂;凋亡
近年来随着我国人均寿命的延长,生活饮食习惯和结构的改变,糖尿病的患病率迅猛上升。糖尿病肾病是其常见的严重并发症,目前已逐渐成为尿毒症透析患者的主要病因。研究表明,在糖尿病肾病中高糖(HG)可使活性氧簇(ROS)产生增加,引起肾脏氧化应激,并可经JAK s/STA Ts通路刺激细胞外基质产生增加[1]。而金属蛋白酶1组织抑制剂(TIMP-1)可通过抑制组织基质金属蛋白酶的活性,也可导致细胞外基质积聚。我们前期研究[2]将正义和反义全长TIMP-1 cDNA转染至大鼠肾小球系膜细胞(RMC),发现在无血清条件下,TIMP-1可在蛋白水平上激活JAKs/STATs信号通路,导致细胞外基质积聚和RMC凋亡减少。但在HG刺激下,阻断ROS生成和JAK 2/STAT5信号通路是否会通过TIMP-1对 RMC凋亡产生影响,目前尚不清楚。本文以 RMC为研究对象,探讨HG条件下加入NADPH氧化酶特异性抑制剂DPI和 JAK 2的特异性抑制剂 AG490后,ROS、JAK 2/STAT5信号通路与TIMP-1之间的关系及对RMC凋亡的影响,以期进一步明确糖尿病肾病系膜细胞增生和细胞外基质积聚的机制,为糖尿病肾病的治疗提供新的可能靶点。
1 材料与方法
1.1 材料和试剂
大鼠肾小球系膜细胞系(RMC)(解放军总医院肾内科暨全军肾脏病重点实验室陈香美院士惠赠)。RPM I1640培养基(美国Gibco),胎牛血清(FCS)(天津血研所),96孔板(加拿大JET Biochemicals)。AG490(JAK 2特异性抑制剂)(美国BioSource),DPI(NADPH氧化酶特异性抑制剂)(美国Sigma),M TT(加拿大 Bioshop),凋亡试剂盒(美国BD)。T rizol试剂(美国 Invitrgen),RTPCR试剂盒、大鼠基因引物(大连宝生物)。JAK 2、STAT5及相应磷酸化蛋白多克隆抗体,化学发光试剂(ECL)(美国Santa Cruz);小鼠抗大鼠β-actin多克隆抗体(武汉博士德)。PCR仪(美国M J Reserch),凝胶成像分析系统(美国PALL)。
1.2 方法
1.2.1 M TT法确定实验中AG490和DPI的合适实验浓度:将常规培养的RMC,在对数生长期中制成含0.5%FCS的细胞悬液,以1×104个/孔接种于96孔板内,同步化12 h后换10%FCS培养基(分别含 0 μmol/L、25 μm ol/L、50 μmol/L 、100 μm ol/L的 AG490;或者分别含 0μmo l/L、0.16 μm ol/L 、0.32 μmol/L 、0.64 μmol/L 、1.28 μmol/L和 2.56μmol/L的DPI)培养20 h,再在各孔中分别加入M TT继续培养4 h后在570 nm波长下检测各孔吸光度值。
1.2.2 实验分组:常规培养的RMC达80%融合时,将细胞随机分成HG组(Glucose 25 mm ol/L)、HG+AG490组(Glucose 25 mmol/L+AG490 50 μm ol/L)、HG+DPI组(G lucose 25 mmo l/L+DPI 0.32μmol/L)和 HG+AG490+DPI组(Glucose 25mmol/L+AG490 50μmol/L+DPI0.32μm ol/L)四组。以上各组均换用含 0.5%FCS的 RPM I1640培养基同步化12 h后,换用含10%FCS的RPM I1640培养基培养24 h,进行实验。
1.2.3 流式细胞技术检测各组RMC凋亡率:收集各组细胞,PBS漂洗 2次,用预冷的 binding bu ffer以106/m L的细胞密度重悬,加入Annexin-V-FITC和PI试剂各5μL,混匀,室温避光孵育15 min,加入 binding buffer上机,激发光波长488 nm,检测细胞凋亡率。实验重复3次。
1.2.4 RT-PCR 检测大鼠 TIMP-1、Bcl-x l、Cyclin D 1、P27kip1和JAK 2 mRNA s的表达:用T rizol试剂按标准程序提取各组 RMC总RNA,分光光度计定量总RNA含量。用RT-PCR试剂盒反转录成cDNA,在PCR仪上扩增。引物序列及反应条件见表1。PCR产物用1.5%的琼脂糖凝胶电泳,凝胶成像分析系统进行半定量分析。
1.2.5 Western b lot检测各组 RMC JAK 2、STAT5及相应磷酸化蛋白的表达:提取各组RMC总蛋白,采用Bradford考马氏亮蓝法进行蛋白质定量。蛋白样本在100℃下变性8 min,用7.5%的聚丙烯酰胺凝胶电泳,半干电转移至硝酸纤维素膜上,5%的脱脂奶粉37℃封闭1 h后加入一抗[兔抗大鼠JAK 2、STAT5多克隆抗体,山羊抗大鼠 P-JAK 2(Tyr1 007/Tyr1 008)、P-STAT5(Tyr694)多克隆抗体,小鼠抗大鼠β-actin多克隆抗体,均为1∶800]4℃过夜。洗膜后37℃结合二抗(辣根过氧化物酶标记兔抗小鼠IgG 1∶1 000,山羊抗兔、兔抗山羊IgG 1∶30 000)1 h,用ECL化学发光试剂在X线胶片上曝光、显影、定影。以βactin为内参照,用凝胶成像分析系统进行半定量分析。

表1 各基因引物序列、扩增片段大小和PCR反应条件
2 结果
2.1 M TT法测定实验中合适的AG490和DPI使用浓度
与正常培养条件下的RMC相比,加入AG490的RMC的吸光度值随 AG490浓度的增加而减少,当AG490浓度≥50μmol/L时,具有统计学差异;加入DPI的RMC吸光度值随DPI浓度增大而减小,当 DPI浓度≥0.32μm ol/L时,与不加 DPI的RMC吸光度值相比,具有统计学差异(见图1)。因此我们在本实验中选取50μmol/L、0.32μmol/L分别作为AG490、DPI的合适实验浓度。
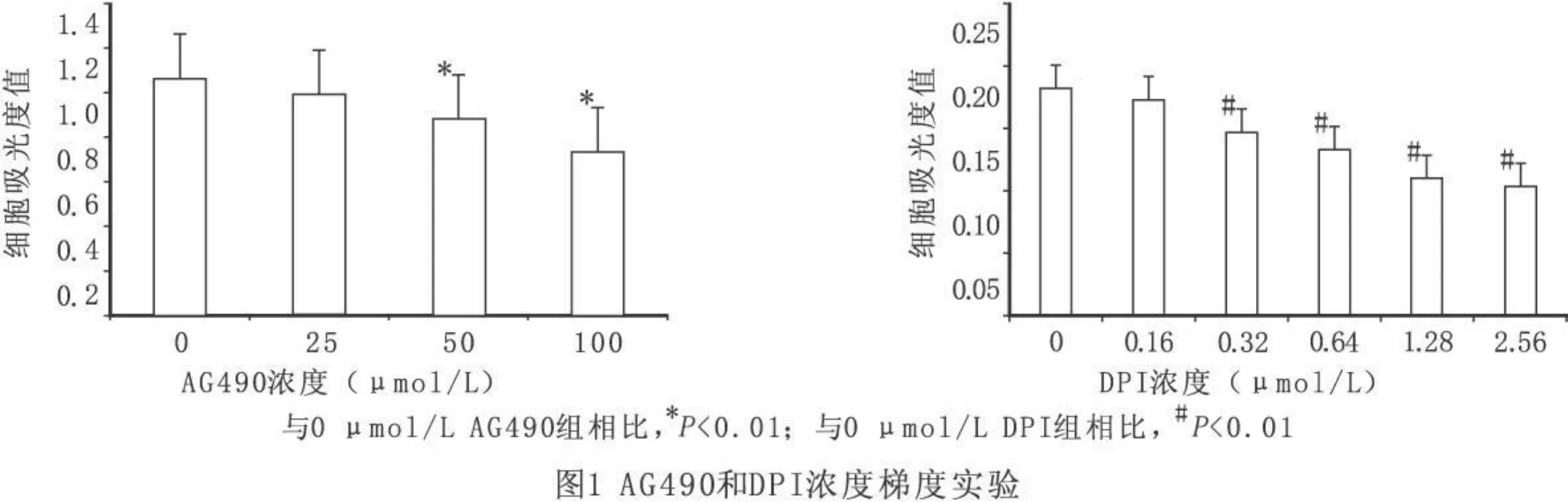
2.2 流式细胞技术检测RMC凋亡
各组RMC经流式细胞仪凋亡检测发现,在HG条件下,加入AG490和(或)DPI作用24 h后,各组细胞的总凋亡率(早期凋亡率+晚期凋亡率)均明显增加(见表2)。
2.3 RT-PCR 检 测 RMC Bcl-xl、Cyclin D1、P27kip1、JAK2和 TIMP-1m RNAs的表达
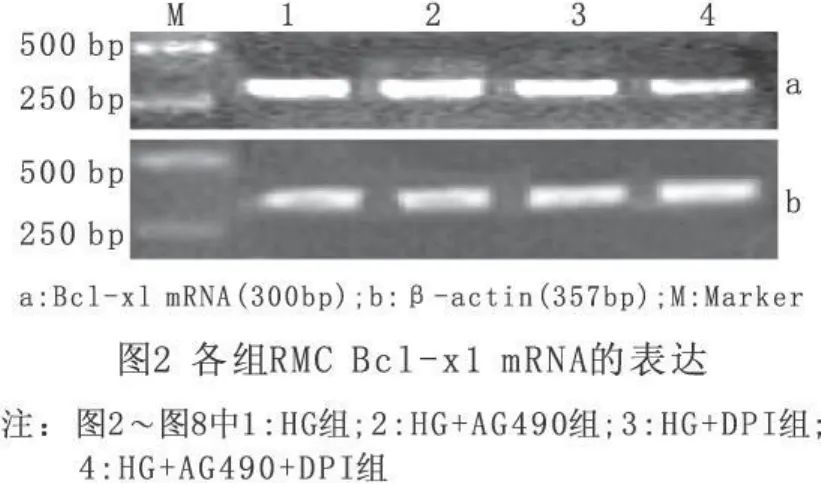
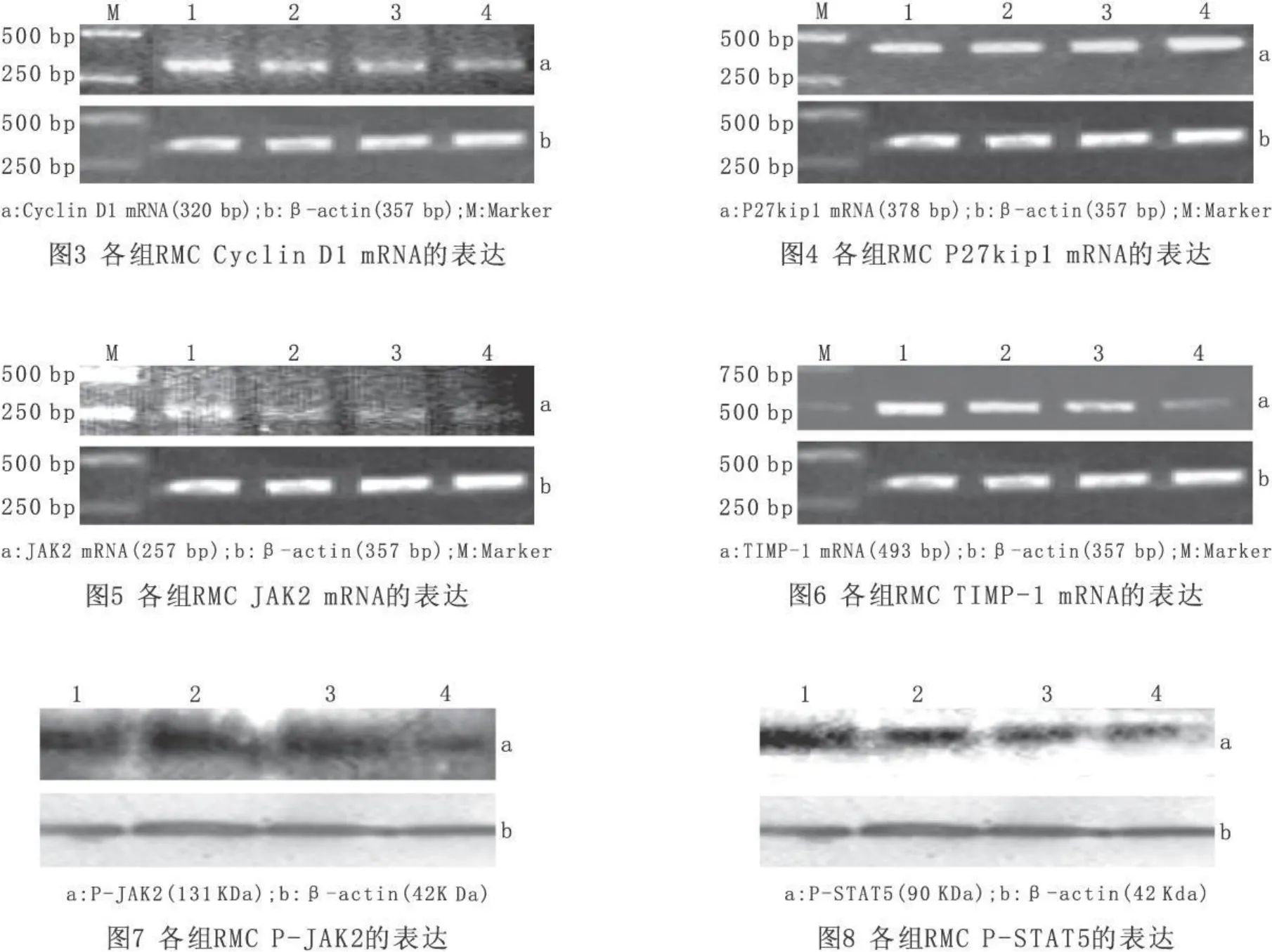
与HG组RMC相比,加入AG490和(或)DPI后,抑制细胞凋亡基因Bcl-xl、Cyclin D1 mRNA s表达显著减少,促进凋亡基因P27kip1 mRNA表达增加,均有明显统计学差别,P<0.01(见图2~图4);JAK 2、TIMP-1 m RNAs表达显著降低(P<0.01)(见图5~图6)。
2.4 Western blot检测JAK 2/STAT5信号通路相关蛋白表达
我们利用Western blot检测各组RMC,结果发现,加入 AG490和(或)DPI后,JAK 2及其下游的STAT5在各组细胞中的表达均无变化。我们进一步检测了其相应磷酸化蛋白的表达,结果发现:在HG环境中,加入AG490和(或)DPI刺激24 h后,与HG组RMC相比,各组 RMC P-JAK2和P-STAT 5的表达均显著减少(P<0.01)(见图7~图8)。
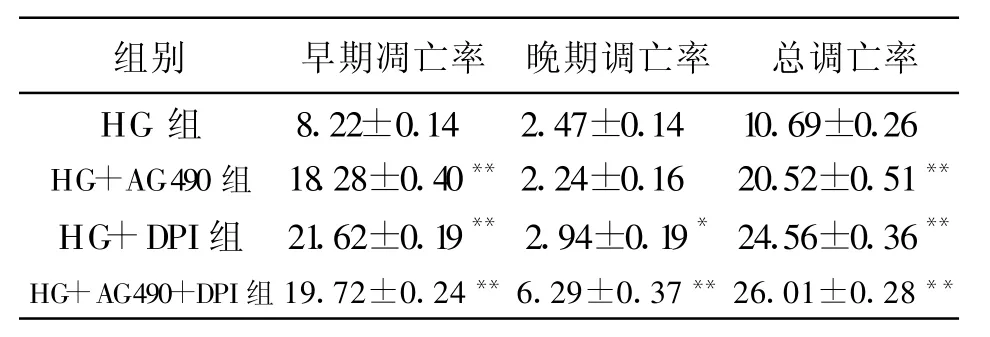
表2 流式细胞技术检测各组RMC的凋亡率 (%)
3 讨论
近年来的研究表明,氧化应激在糖尿病肾病的发生和发展中具有重要作用。在糖尿病肾病中,HG可使ROS产生增加,激活JAKs/STATs信号通路,引起肾小球系膜细胞增殖、细胞外基质积聚,导致糖尿病肾脏损害不断进展[1]。TIMP-1通过抑制组织基质金属蛋白酶活性,引起细胞外基质积聚。但在糖尿病肾病的氧化应激机制中是否存在T IMP-1参与,在 HG 条件下 ROS、JAK2/STAT5信号传导通路和 TIMP-1之间有何关系,它们对RMC凋亡有何影响,目前尚不清楚。
我们应用流式细胞技术检测RMC凋亡结果显示:在HG条件下,加入 AG490和(或)DPI后,各组RMC的总凋亡率显著增加,尤其在加入DPI后更为明显。我们前期研究结果表明:JAKs/STATs信号通路具有抑制细胞凋亡的作用,加入AG490对其阻断后可增加细胞总凋亡率[2]。氧化应激激活后既可活化JAKs/STATs通路[3],还可激活PI3K/AKT通路[4]和M EK/ERK信号传导通路[5]。上述三条细胞信号传导通路均可发挥抑制细胞凋亡的作用[6~8]。因此抑制氧化应激的发生,可同时抑制上述三条信号通路的活化,更加明显地引起RMC发生凋亡。
DPI可抑制细胞中NADPH氧化酶活性,使ROS产生减少,氧化应激受到抑制[9]。我们通过RT-PCR检测发现,在HG培养条件下的RMC培养基中使用DPI后,JAK 2 mRNA表达显著减少(P<0.01)。上述研究提示:JAK 2/STAT5信号传导通路受氧化应激调控;在 HG条件下阻断ROS生成,可抑制JAK 2/STAT5信号通路激活。
我们通过 RT-PCR检测还发现,在 HG组RMC培养基中加入AG490后TIM P-1 m RNA表达也显著减少(P <0.01),表明TIMP-1表达受JAK 2/STAT5信号传导通路调控。
细胞周期蛋白Cyclin D1S可抑制细胞凋亡,细胞周期蛋白激酶抑制剂P27kip1则可通过拮抗前者起到抑制细胞周期、促进细胞凋亡的作用[10]。我们通过RT-PCR检测发现,加入AG490和(或)DPI后凋亡抑制基因 Bcl-xl、Cyclin D1 m RNAs表达显著减少,凋亡促进基因P27kip1 m RNA表达却明显增加。上述研究结果很可能是HG条件下阻断JAK 2/STAT5信号通路和(或)ROS产生后引起RMC凋亡的原因之一。
通过Western blot检测发现,在HG条件下,RMC培养基中加入AG490和(或)DPI,均可使PJAK 2和P-STAT5表达显著下调,且在DPI加入后下调更加明显。结合我们前期实验结果[3]可知,加入AG490阻断JAKs/STA Ts信号通路后,TIMP-1表达下降,从而使T IMP-1在蛋白水平上对上述信号通路的反馈激活受到抑制,更加促进了上述磷酸化蛋白表达减少。加入DPI阻断ROS生成后,上述蛋白表达降低较加入AG490后更为明显,提示氧化应激抑制后可能通过除抑制JAK 2/STAT5信号通路外的其它途径起到下调上述磷酸化蛋白表达的作用。
目前国内外尚未见到 HG条件下 ROS、JAK 2/STAT5信号传导通路和TIMP-1关系的文献报道。上述研究进一步探讨了糖尿病肾病发生发展的氧化应激机制,为糖尿病肾病的发病机制填充了新的内容。
[1] Marrero MB,Banes-Berceli AK,Stern DM Eaton DC.Role of the JAK/STA T signaling pathw ay in diabetic neph ropathy[J].Am JPhy siol Renal Physiol,2006,290(4):F762~F768.
[2] 温文斌,林洪丽,吴泰华,等.JAKs/STATs通路在T IMP-1抑制肾小球系膜细胞凋亡中的作用[J].中华肾脏病杂志,2008,24(1):24~29.
[3] Taw fik A,Jin L,Banes-Berceli AK,et al.H ypergly cem ia and reactive oxygen speciesmediate apop tosis in aortic endothelial cells through Janus kinase 2[J].Vascul Pharmacol,2005,43(5):320~326.
[4] Lee SB,Cho ES,Yang HS,et al.Serum w ithd raw al kills U 937 cells by inducing a positive mutual interaction between reactive oxygen speciesand phosphoinositide 3-kinase[J].Cell Signal,2005,17(2):197~204.
[5] Cao Q,Mak KM,Lieber CS.DLPC and SAM e combined prevent leptin-stimulated T IMP-1 production in LX-2 human hepatic stellate cells by inhibiting HO-mediated signal transduction[J].Liver Int,2006,26(2):221~231.
[6] Masamune A,Satoh M,K iku ta K,et al.Activation of JAKSTAT pathw ay is required for platelet-derived grow th factor-induced proliferation of pancreatic stellate cells[J].W orld JGastroenterol,2005,11(22):3385~3391.
[7] 王楠,林洪丽,吴泰华,等.T IMP-1抑制大鼠肾小球系膜细胞凋亡与磷脂酰肌醇3激酶/丝/苏氨酸激酶通路的研究[J].中国实用内科杂志(临床前沿版),2006,26(14):1059~1061.
[8] 孙艳玲,林洪丽,吴泰华,等.ERK 1/2M APK通路在T IMP-1抑制高糖诱导的大鼠肾小球系膜细胞凋亡中的作用[J].中华肾脏病杂志,2006,22(9):554~558.
[9] Shen W L,Gao PJ,Che ZQ,et al.NAD(P)H oxidase-derived reactive oxygen species regulate angiotensin-II induced ad ventitial fib roblast phenotypic differen tiation[J].Biochem Biophys Res Commun,2006,339(1):337~343.
[10] Zhu JS,W ang L,Cheng GQ,et al.Apoptosismechanisms of hum an gastric cancer cell lineM KN-45 in fected with hum an mutant p27[J].World JGastroenterol,2005,11(47):7536~7540.
The Relationship Among ROS,JAK 2/STAT5 Signal Pathway and TIMP-1 and the Ef fect of them on Apoptosis in RatMesangial Cells
W enW enbin,Lin H ongli,Wu Taihua,et al.
Departmento f Nephrology,Heji Hospita l,Changzhi Medical College
Ob jective:To investigate the relationship among Reactive Oxygen Species(ROS),JAK2/STAT5 signal pathw ay and TIMP-1 and the effectof them on apoptosis in ratmesangial cells under the condition of high glucose.Methods:A fter RMC w as stimulated w ith HG,DPI(specific inhibitoro f NADPH oxidase)and AG 490(specific inhibitor of JAK 2)for 24 hours,the tota l apop tosis rate of RMC w asmeasured by flow cy tometry.The exp ression of Bcl-xl,Cyclin D1,P27kip1,JAK 2 and TIMP-1m RNAs was assayed by RT-PCR.The expression of JAK 2,STAT5,P-JAK 2 and P-STAT5 proteinsw as analysed by W estern b lot.Resu lts:The total apop tosis rates of HG,G+AG 490,HG+DPIand HG+AG490+DPIgroupsw ere(10.69±0.26)%,(20.52±0.51)%,(24.56±0.36)%and(26.01±0.28)%,respectively.AG 490 and(or)DPI treatment enhanced the apoptosis(P<0.01)and the exp ression of P27kip1 mRNA,however,it obviously decreased the exp ression of Bcl-xl,Cyclin D1,JAK 2,TIMP-1mRNAs and the exp ression of P-JAK 2 and P-STAT5 p roteins in RM C.Conclusion:Under the condition of high glucose,JAK 2/STAT5 signal pathw ay could be regulated by ROS;the inhibition of ROSand(or)JAK2/STAT5 signal pathway decreased the exp ression of TIMP-1 mRNA and increased apop tosis rate in RMC.
Mesangial cells;Reactive Oxygen Species;JAK 2/STAT5 signal pathway;Tissue inhibitor o fmelallop roteinase 1;Apop tosis
R587.24
A
1006-(2010)05-321-05
1长治医学院附属和济医院肾内科(046011) 2大连医科大学附属第一医院 3长治医学院附属和济医院消化内科 4内蒙古医学院附属医院
国家自然科学基金(30470805)
* 通讯作者
2010-08-14;
2010-08-27)
