电针对模型大鼠海马CA1区Aβ的阳性细胞表达和脑内SOD活性的影响
2010-09-17赵凤云关珊珊张鹏姜国华
赵凤云,关珊珊,张鹏,姜国华
(1.黑龙江省康复医院,黑龙江 哈尔滨 150018;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
阿尔茨海默病(Alzheimer's Disease,AD)是神经系统变性疾病,以老年人为多发,是痴呆最常见的病因。以老年斑、神经元纤维缠结、海马椎体细胞颗粒空泡变性和神经元缺失为典型病理特征,是伴随老化而出现认知功能障碍为主的疾患。针灸对痴呆具有一定的疗效,对老年痴呆患者的智能提高(改善学习记忆功能障碍)及临床症状改善均有明显的作用[1~3]。
1 材料与方法
1.1 实验动物及主要试剂
4月龄Wistar大鼠60只(黑龙江中医药大学实验动物中心提供),健康清洁级,体重220~250g,链脲霉素(STZ)、丙二醛、超氧化物歧化酶测定试剂盒(南京建成生物工程研究所),Aβ免疫组化试剂盒(武汉博士德生物工程有限公司)。
1.2 动物分组、造模及行为学测试
将Wistar大鼠在实验室适应性饲养1w,然后用Morris水迷宫筛选出智力正常的60只大鼠,随机分成空白组12只、模型对照组12只、模型组12只、西药组12只和电针组12只。模型组、西药组和电针组的大鼠经10%水合氯醛(3mL·kg-1)腹腔注射麻醉,固定于脑立体定位仪上。常规消毒头顶部皮肤,正中矢状切口,分离骨膜后用锥颅器钻开颅骨,暴露硬脑膜,参照大鼠脑立体定位图谱[1]定位侧脑室:前囟后0.8mm,中线旁开1.5mm,深3.8mm。用微量注射器在每侧侧脑室各注射链脲霉素(STZ)10μL(注射前将STZ 溶于生理盐水,浓度为 10%)[5,6],缓慢进针,匀速给药,10min注完,使其充分浸润局部组织,缓慢拔出微量注射器,第3天重复注射,剂量同前。正常组不予处置,模型对照组操作同前,以等量生理盐水替代STZ。所有术后大鼠均肌注青霉素,每只每天40万单位,常规饲养。水迷宫行为学测试分别在术前、术后及治疗后进行。①定位航行试验:历时5d,每天(上午7点30至下午16点)4次水迷宫测试,将大鼠面向池壁分别从4个入水点放入水中,记录其在120s内找到平台并爬上平台的时间,即潜伏期。如果大鼠在120s内不能找到平台,则由实验者用手牵引其至平台。第1d让大鼠在平台上停留20s,第2d停留15s,第3d停留10s,第4天停留5s。②空间探索实验:第5d去除平台,任选一入水点,将大鼠放入水池中,记录其在120s内跨过原平台所在位置的时间。
1.3 治疗及取材
正常组、模型对照组、模型组常规饲养。西药组给与氢溴酸加兰他敏,剂量为0.5~1mg·(kg·d)-1。电针组针刺治疗,根据中国针灸学会实验针灸研究会制定的《动物针灸穴位图谱》,用0.25mm×25mm毫针针刺百会穴,平刺约2.5mm;大椎穴,直刺约4mm;双侧太溪穴,直刺进针3mm;双侧肾俞穴,直刺进针5mm;双侧足三里穴,直刺进针4mm。其中百会穴、大椎穴连接KWD-808Ⅱ型全能脉冲电疗仪,频率为30Hz,电压为2V,强度以肢体轻微抖动为度;余穴间歇5min捻转1次,平补平泻,每日1次,时间30min,7d为1疗程,间歇1天,治疗4个疗程后进行行为学测试。水迷宫测试完毕后,第2d每组随机选取6只,用10%水合氯醛(4mL·kg-1)腹腔麻醉,麻醉后立即开胸暴露心脏,左心室插管,同时剪开右心耳,快速灌注生理盐水至肝脏颜色变白,改灌4%的多聚甲醛,快速灌注,当出现下肢抽动时,缓慢灌注30min,至肝脏变硬,四肢、尾均僵硬后停灌。取脑,放入4%的多聚甲醛溶液中固定过夜,进行石蜡包埋,HE染色,免疫组织化学染色。再将每组剩余大鼠断颈处死取全脑,取一侧脑组织,去除软脑膜血管、脑干及小脑,用冰生理盐水冲洗血液后,滤纸拭干,称重,加入9倍冷生理盐水,电动匀浆机中研磨成10%匀浆,之后以3000r·min-1的速度离心15min,取上清液,按照试剂盒说明进行生化指标的检测。
1.4 图像分析及统计方法
阳性细胞数的计算:取每组大鼠脑组织切片12张,每张切片于海马区随机选取5个区域,在400倍显微镜下计算此区域内的免疫组化染色为棕色的Aβ阳性细胞数。由两名人员独立观察最后取平均值,结果以均数±标准差(±s)表示。计算公式:

图像采用Image-Proplus5.0软件进行图像分析。各组实验数据采用统计程序软件SPSS 17.0进行运算,采用t检验,用(±s)表示。
2 结果
2.1 海马CA1区Aβ蛋白表达
表1显示,正常组、模型对照组CA1区Aβ蛋白有较低表达,模型组CA1区Aβ蛋白表达水平显著升高,治疗后西药组、电针组与模型组比较有极显著性差异(P<0.01)。
表1 各组海马CA1区Aβ蛋白表达阳性细胞数(±s)(个·mm-2)

表1 各组海马CA1区Aβ蛋白表达阳性细胞数(±s)(个·mm-2)
注:与模型组比较,*P<0.01。
组别 n 表达阳性细胞数正常组 12 10.87±3.15*模型对照组 12 11.09±3.28*模型组 12 25.31±2.46西药组 12 18.52±2.63*电针组 12 17.94±2.70*
2.2 电针对AD大鼠脑组织内MDA含量和SOD活性的影响 见表2,图1。
图1显示:模型组与正常组、模型对照组比较,大鼠脑组织内MDA含量明显升高(P<0.01);电针组、西药组与模型组比较,MDA含量明显降低(P<0.01);模型组与正常组、模型对照组比较,SOD活性明显降低(P<0.01);电针组、西药组与模型组比较,SOD活性明显升高(P<0.01),均有极显著性差异。以上说明电针可以降低AD大鼠脑组织内MDA含量,而使SOD活性增强。
表2 各组大鼠脑组织内MDA含量和SOD活性(±s)
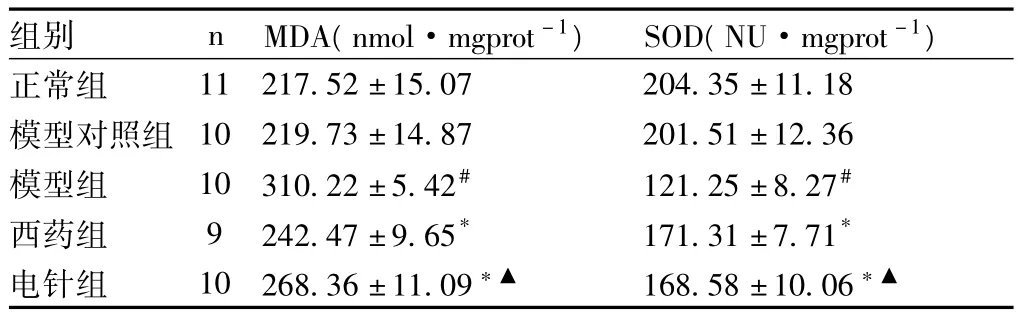
表2 各组大鼠脑组织内MDA含量和SOD活性(±s)
注:与模型组比较,*P<0.01;与正常组、模型对照组比较,#P<0.01;与西药组比较,▲P>0.05。
组别 n MDA(nmol·mgprot-1) SOD(NU·mgprot-1)11 217.52±15.07 204.35±11.18模型对照组 10 219.73±14.87 201.51±12.36模型组 10 310.22±5.42# 121.25±8.27#西药组 9 242.47±9.65* 171.31±7.71*电针组 10 268.36±11.09*▲ 168.58±10.06正常组*▲

图1 各组大鼠脑组织内MDA含量和SOD活性比较
3 讨论
AD最典型的病理改变是老年斑,而老年斑主要成分就是Aβ。聚集状态的Aβ具有长期的稳定性,所以一旦发生聚集,很快就形成极难溶解的沉淀,在神经细胞内沉积下来。沉积的Aβ与凋亡细胞在脑内如基底核、海马、新皮层等逐渐累积,进而导致典型的老年斑。纤维状的Aβ产生毒性作用,导致神经元细胞的死亡,从而使AD患者出现认知功能减退与记忆碍障等痴呆症状。脂质过氧化的最终产物如MDA的细胞毒性作用,是导致AD神经元变性坏死的重要原因。SOD能够阻滞由于大量过氧化氢蓄积所导致的神经元凋亡的发生,对机体的氧化与抗氧化平衡起着重要的作用,SOD是体内重要的自由基清除酶,能促使超氧阴离子氧化为过氧化氢,保护细胞免受损伤,衰老机体SOD活性减弱,抗氧化剂减少,自由基损伤因素增加。实验结果显示,模型组大鼠与正常组和模型对照组对比,可见到较多的Aβ沉积,其脑内Aβ阳性神经细胞数明显高于正常组和模型对照组。电针治疗后,电针组大鼠Aβ的阳性细胞表达明显下降;模型组与正常组、模型对照组比较,大鼠脑组织内MDA含量明显升高;电针组、西药组与模型组比较,MDA含量明显降低;模型组与正常组、模型对照组比较,SOD活性明显降低(P<0.01);电针组、西药组与模型组比较,SOD活性明显升高(P<0.01),均有极显著性差异。根据阿尔茨海默病临床表现,在中医学中将其归属为“痴呆”、“健忘”、“善忘”、“呆病”、“郁证”,“癫疾”等病症范畴,针刺治疗AD的原则是补肾益髓、醒神开窍。补肾益髓以治其本,醒神开窍以治其标。在上述治疗原则的指导下,选取百会、大椎、肾俞、太溪和足三里穴。百会穴为督脉和足太阳膀胱经的交会穴,具醒神开窍之功,为治疗老年性痴呆的主要穴位;肾俞为足太阳膀胱经穴,培补肾气;太溪为足少阴肾经穴,补肾益精,二者为临床补肾要穴,常用于失眠,健忘及其它神志及精神疾患;大椎出自《素问·气府》,属督脉经穴位,是手足六阳经的交会穴,为“诸阳之会”,可通调诸经,增强各脏腑经络,促使阴阳平衡;足三里为足阳明胃经的合穴,是传统保健要穴,且在《素问·玉机真脏论》指出:“五脏者,皆禀气于胃,胃者,五脏之本也”,故而分别用来补先天之本和后天之本。诸穴相配,达到补肾益髓、醒神开窍、标本同治的目的。本实验的结果表明,电针能够抑制Aβ在脑内过度沉积,降低Aβ在脑内的表达,降低脑组织内MDA含量,而使SOD活性增强,从而改善了大鼠学习记忆功能。从实验角度验证了电针对AD的治疗效果。
[1] 陈水灿.古代针灸益智临床经验节要[J].中国针灸,1997,17(5):312.
[2] 王惠仙.针灸中药并用治疗老年性痴呆52例疗效观察[J].中国针灸,1998,18(12):735.
[3] 刘会安.化浊益智针法治疗血管性痴呆的临床疗效观察及机理研究[J].中国针灸,1997,17(9):52.
[4] 包新民,舒斯云.大鼠脑立体定位图谱[M].第1版,北京:人民卫生出版社,1994.
[5] Veerendra Kumur M H,Gupta Y K.Effect of centella Asiatica on cognition and oxidative stress in an intracerebroventricular streptozotocin model of Alzheimer's disease in rats[J].Clinical and Experimental Pharmacology and Physiology,2003(30):336 -342.
[6] Sharma M,Gupta Y K.Effect of chronic treatment of melatonin on learning,memory and oxidative deficiencies induced by intracerebroventricular streptozotocin in rats[J].Pharmacology,Biochemistry and Behavior,2001(70):325 - 331.
[7] 毛雪璇,皮荣标.Morris水迷宫实验影响因素的研究进展[J].中国行为医学科学,2008(17):853-855.
