蝙蝠葛酚性碱对胰腺癌瘤组织中K-ras蛋白表达的影响
2010-09-17冯大志白云闻喜英王家明苏云明
冯大志,白云,闻喜英,王家明,苏云明
(1.哈药集团制药六厂,黑龙江 哈尔滨 150025;2.黑龙江中医药大学,黑龙江 哈尔滨 150040;3.牡丹江医学院第二附属医药,黑龙江 牡丹江 157009;4.哈药集团三精制药股份有限公司,黑龙江 哈尔滨 150010)
胰腺癌的发病率有明显的地区差异,在发达国家和工业化程度较高的国家,其发病率较高,而非洲和亚洲国家的发病率较低。半个多世纪来,英、美等国家的发病率逐步上升。胰腺癌居常见癌症死因的第4位,居消化道癌症死因的第2位,仅次于大肠癌[1]。现代医学对胰腺癌的病因研究尚未完全清楚,可能与胰腺癌发病的有关因素包括吸烟、高热量、高胆固醇、高碳水化合物摄入性饮食、慢性胰腺炎、糖尿病、胃溃疡和胃切除术、胆囊切除术和胆石症、环境污染、遗传因素(包括家族性胰腺癌、Ⅰ型多发性内分泌肿瘤综合征、遗传性胰腺炎、Ⅱ型Lynch综合征、共济失调-毛细血管扩张综合征、家族性非典型性多发性痣黑素瘤综合征等)。目前研究认为,癌基因和抑癌基因(如K-ras、DPC4、P16、P53 等)、细胞凋亡、端粒酶、肿瘤新生血管的形成等在胰腺癌的发生中起重要作用[2]。
1 实验材料
1.1 实验动物
裸鼠48只,体重(20±2)g,雌雄各半,由黑龙江中医药大学药物安全性评价中心提供,合格证:SCXK(京)2007-0001。
1.2 实验瘤株
胰腺癌瘤株(BXPC-3)购自中国科学院上海生命科学院细胞资源中心。
1.3 动物饲养
在黑龙江中医药大学药物安全性评价中心饲养。
1.4 药物
蝙蝠葛酚性碱(PAMD)由黑龙江中医药大学药学院王栋教授提供,用时先以1moL·L-1HCl溶解后,再用1moL·L-1NaOH调pH值至中性,加蒸馏水至所需浓度。实验时临时配制成溶液。
注射用环磷酰胺(Cyclophosphamide For Injection),江苏恒瑞医药股份有限公司,批准文号:国药准字H32020857。
1.5 仪器及试剂
①低温冰箱(MDF-U50V型),日本三洋;②电子天平AL204,METTLEY TOLEDO英国;③超净工作台,苏州净化设备厂;④电泳凝胶图象分析系统,Backman公司;⑤PVDF膜:美国Pall公司;⑥NC膜:美国PALL公司;⑦滤纸:Whatman 3mm;⑧丽春红:武汉博士德;⑨封闭用脱脂乳:sigma公司;⑩抗体:santa公司 baction(sc-47778)k-ras(sc-30)HRP羊抗兔二抗:sigma公司;⑩超敏发光液:鑫丰生物材料公司。
2 实验方法
2.1 胰腺癌BXPC-3裸鼠模型的建立
取冻存的胰腺癌细胞株BXPC-3,立即投入37℃水中,1min内融化,然后离心去除冻存液,用约10倍的冷RPMI1640完全培养液洗1次,接种于培养瓶中,待细胞贴壁后更换培养液。肿瘤细胞株培养在RPMI1640完全培养液中,置于37℃、饱和湿度、5%CO2的培养箱中,隔日换液,细胞长成单层后,用0.25%胰酶EDTA消化、传代。待细胞进入对数生长期后,收集细胞并用RPMI1640完全培养基调整浓度为5×106个/mL的细胞悬液备用,接种于40只裸鼠右腋窝皮下,每只鼠接种0.2mL(约含瘤细胞数1×106个)。
2.2 实验分组
40只裸鼠造模24h后随机分为5组,每组8只,分别为PAMD高、中、低剂量组,模型组对照组,阳性对照组。另取8只裸鼠作为空白对照组(不接种瘤株,给予同体积的生理盐水)。
2.3 给药剂量及给药途径
实验组每日给药剂量为PAMD高剂量20mg·kg-1,PAMD 中剂量 10mg·kg-1,PAMD 低剂量 5mg·kg-1,模型组及空白对照组每日给予同等容积生理盐水,环磷酰胺对照组给予注射用环磷酰胺156mg·kg-1(每周给药1次)。实验各组均采用腹腔注射给药,连续用药21d。
2.4 组织中总蛋白的提取
实验各组连续给药21d(药剂量及给药途径同实验一)后,次日摘眼球取血处死小鼠,并用酒精消毒操作部位皮肤,置于超净工作台中(事先以紫外线灯消毒30min),以无菌操作剥取肿瘤结节,剔除纤维包膜和坏死组织,标记好放入事先准备好的液氮罐内保存。
将少量瘤组织块置于1~2mL匀浆器中,用干净的剪刀将组织块尽量剪碎。加入400μL单去污剂裂解液于匀浆器中进行匀浆。然后置于冰上,重复碾几次使组织尽量碾碎。裂解30min后,即可用移液器将裂解液移至1.5mL EP管中,然后在4℃下12000rpm离心5min,取上清分装于0.5mL EP管中,采用蛋白印迹技术(Western-blot)检测肿瘤k-ras蛋白表达的差异。放入显影液中,约15s后,放入清水清洗,放入定影液中定影。
2.5 分析方法
胶片采用Alpha image 2000凝胶成像系统扫描,所得图形使用Image-pro plus分析。计算各个指标样本的平均积分光密度(IOD)。
纵坐标为IOD,意思是平均积分光密度(IOD),又称积分吸光度(IA),为所测结构范围内各像素光密度值之和,即:IOD= ∑ODpixeli= ∑[log(Io/Ib)]...pixeli,为第i个像素的光密度值。积分光密度可反映所测结构的光密度与面积的综合变化。
2.6 统计学处理
3 实验结果
3.1 PAMD对胰腺癌K-ras、DPC4蛋白表达的结果见图1,图2。

图1 实验各组β-action蛋白表达
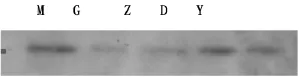
图2 实验各组K-ras蛋白表达
3.2 PAMD对胰腺癌K-ras蛋白表达的影响
实验结果表明,PAMD高、中、低剂量组及阳性对照组同模型组比较,K-ras蛋白相对表达量明显降低,差异具有统计学意义(P<0.01)。实验结果见表1。
表1 PAMD对胰腺癌K-ras蛋白表达的影响(±s)
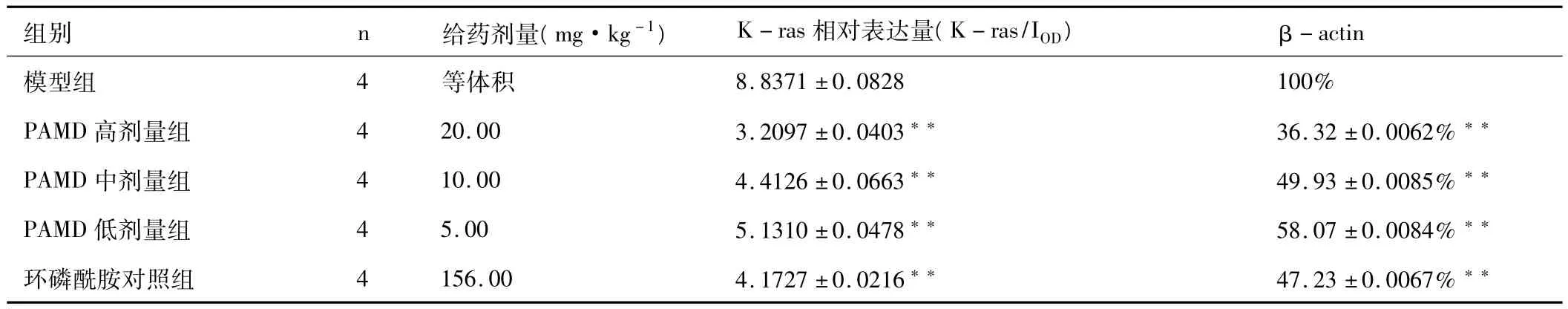
表1 PAMD对胰腺癌K-ras蛋白表达的影响(±s)
注:各给药组分别与模型对照组比较,**P<0.01。
组别 n 给药剂量(mg·kg-1) K-ras相对表达量(K-ras/IOD) β-actin模型组 4 等体积8.8371±0.0828 100%PAMD高剂量组 4 20.00 3.2097±0.0403** 36.32±0.0062%**PAMD中剂量组 4 10.00 4.4126±0.0663** 49.93±0.0085%**PAMD低剂量组 4 5.00 5.1310±0.0478** 58.07±0.0084%**环磷酰胺对照组 4 156.00 4.1727±0.0216** 47.23±0.0067%**
4 讨论
胰腺癌是K-ras基因突变发生率最高的肿瘤,达75% ~100%[3~5]。ras基因编码一种结构高度相似的分子量为21kD的蛋白质,称为p21蛋白,K-ras基因编码表达的产物是ras蛋白,其结构与其他ras基因编码表达的ras蛋白具有高度同源性,功能也基本相同。ras蛋白始终处于GDP结合失活和GTP结合激活两种状态的循环中。当细胞外因素作用于细胞时,如EGF和EGFR结合,EGFR内源性酪氨酸激酶被激活,自身某些特异的酪氨酸磷酸化,并与Grb2等蛋白的序列相似域2(SH2)结合,促进Grb2等蛋白的SH3与SOS蛋白结合,使ras蛋白与GDP解离而与GTP结合,使ras蛋白活化,进而通过一系列细胞信号传导途径最终促进有关基因的表达。同时,ras蛋白自身的三磷酸鸟苷酶(GTPase)使GTP水解为GDP,使ras蛋白又回到失活状态。突变K-ras基因编码的ras蛋白可发生结构和(或)构像变化,其内源性GTPase活性几乎完全丧失,使ras蛋白一直处于活化状态,持续作用于下游各信号传导途径,使细胞发生转化,增生失控,最后恶变。
目前,越来越多的学者认为肿瘤可能是一种多基因疾病,基因治疗可能是治疗恶性肿瘤的有效途径。
[1] Kovi J,Heshmat MY.Incidence of cancer in negroes in negroes in Washington,D.C.and selected African cities.Am[J].Epidemiol,1972(96):401-413.
[2] 袁世珍.胰腺癌[M].上海:上海科学技术出版社,2001.
[3] Omata M,Ta da M.General rules for the study of Panereatic cancer by molecular biological aspect[J].Nippon Geka Gakkai Zasshi,2000,101(2):233-236.
[4] Banerjes SK,Makdisi WF,Weston AP,et al.A two-steP enrichednested PCR Technique enhances sensitivity for detection of codon12 K - ras mutations in Pancreatic adenocarcinoma[J].Pancreas,1997(15):16-24.
[5] Urban T,Ricci S,Grange JD,et al,Detection of c- K - ras mutation by PCR/RFLP analysis and diagnosis of Pancreatic adenocarcinomas[J].J Natl Cancer Ihst,1993(85):2008 -2012.
[6] KawabataM,Imanoura T,Inoue H,et al.Intracellular signaling of theTGF - beta Superfamily by Smad Proteins[J].Ann N Y AeadSei,1999(886):73-82.
[7] Kleeff J,Ishiwata T,Maruyama H,et al.The TGF - beta signal ing inhibitor Smed7 enhances tumorigenieity in pancreatic cancer[J].Oncogene,1999,18(39):5363 -5372.
[8] Jonson T,Gorunova L,Dawiskiba S,et al.Molecular analyses of the 15q and 18q SMAD genes in Pancreatic caneer[J].Genes Chromosomes Cancer,1999,24(1):62 -71.
[9] Chiao PJ,Hunt KK,Grau AM,et al.Tumor suppressor geneSmad4/DPC4,its Downstream target genes,and regulation of cellcycle[J].Ann N Y Acad Sci,1999(880):31 - 37.
[10] Aifi A,Buisine M Mazars A,et al.Induction of apoptosis by DPC4,a transcriptional factor regulated by transforming growth factor-beta through stress-activated protein kinase/c-Jun N-terminal kinase(SAPK/JNK)signaling pathway[J].Biol Chem,1997,272(40):24731-24734.
[11] Schutte M,Hruban RH,Hedrick L,et al.DPC4 gene in various tumor tyPes[J].Cancer Res,1996,56(11):2527 -2530.
[12] Shi Y,Hata A,Lo RS,et al.A structural basis for mutational inactivation of the Tumour suppressor Smad4 [J].Nature,1997,388(6637):87-93.
[13] Daniel SL.Molecular Pathology of invasive carcinoma[J].Ann N Y Acad Sci,1999(880):74 -82.
[14] Hahn SA,Schutte M,Kern SE,et al.DPC4,a candidate tumor suppressor gene at human chromosome 18q21.1[J].science,1996(271):350-353.
