耐力训练对高脂膳食大鼠骨骼肌线粒体脂肪氧化及PGC-1α基因表达的影响
2010-09-15漆正堂丁树哲
张 媛,漆正堂,郭 维,丁树哲
耐力训练对高脂膳食大鼠骨骼肌线粒体脂肪氧化及PGC-1α基因表达的影响
张 媛,漆正堂,郭 维,丁树哲
目的:研究耐力训练对高脂膳食大鼠骨骼肌线粒体脂肪氧化相关酶活性及基因表达的影响。方法:40只SD大鼠,随机分成普通膳食对照组(C)与耐力训练组(E);高脂膳食对照组(H)与耐力训练组(R),每组10只。两耐力训练组大鼠进行8周跑台训练。结果:耐力训练使高脂膳食大鼠体重(P=0.000)、IR 指数(P=0.021)显著降低并维持在正常水平,使骨骼肌线粒体 β-HAD(P=0.011)、CS活性(P=0.047)、CPT-1β mRNA(P=0.037)及PGC-1α蛋白表达水平(P=0.007)显著增高。结论:耐力训练通过适度调节参与线粒体脂肪氧化关键酶β-HAD、CS活性及CPT-1β、PGC-1α基因表达,优化高脂膳食机体在线粒体水平的脂肪氧化能力。
线粒体脂肪氧化;高脂膳食;耐力训练;胰岛素抵抗;肉碱酰基转移酶;过氧化物酶体增殖物激活受体γ辅激活因子1
1 研究背景
高脂膳食与缺乏运动导致机体对自身胰岛素敏感性降低,引发相关代谢综合征[1-2]。耐力训练时脂肪为主要供能物质,可有效缓解高脂膳食给机体带来的高脂负荷,同时提高线粒体功能,增强线粒体脂肪氧化能力[3]。运动中限制LCFA被利用的问题仍未被解决,脂肪在线粒体水平的氧化代谢显得尤为重要[4]。当脂肪供给与氧化代谢不平衡时,脂肪代谢异常很可能导致骨骼肌发生IR现象,而后者又与线粒体脂肪氧化关系密切。此外,过氧化物酶体增殖物激活受体γ辅激活因子1(PGC-1)参与调节适应性产热、肝糖异生、脂肪酸β氧化等代谢过程[5],在长期耐力训练诱导骨骼肌适应方面起到关键作用。因此,本实验重点关注与线粒体脂肪氧化关系密切的相关酶及基因,比较高脂膳食单因素干预的大鼠与高脂膳食伴随耐力训练的大鼠在线粒体水平脂肪氧化过程中所发生的不同应激变化,进一步探讨耐力训练对高脂膳食机体线粒体水平脂肪代谢的作用机制,为耐力训练可能部分通过优化线粒体脂肪氧化从而调节机体胰岛素抵抗水平的设想提供理论依据。
2 研究方法
2.1 动物及饲养
清洁级SD雄性大鼠40只(上海斯莱克实验动物有限公司提供),体重(120±5)g。分笼饲养,每笼4只,自由饮食。室温20~23℃,相对湿度50%~70%,自然光照。高脂饲料成分:水分8.6%,粗脂肪16.2%,粗蛋白含量18.8%,粗灰分5.2%,粗纤维3.98%,无氮浸出物45.2%。
2.2 动物分组及运动方案
SD大鼠适应性饲养6天后,随机分为普通膳食对照组(C)与耐力训练组(E);高脂膳食对照组(H)与耐力训练组(R),每组10只。耐力训练组大鼠进行8周跑台训练,每周6天,每天一次,周日停训,每次训练40~60 min,速度为0.8 km/h~1.2 km/h。
作者单位:华东师范大学体育与健康学院,上海200241。
2.3 动物取材
最后一次训练结束24~48 h内,大鼠断颈椎处死,处死前禁食6 h。心脏取血,离心后,抽取上层血浆4℃保存。取下肢腓肠肌,液氮速冻后,-80℃保存,待检测。
2.4 测试指标与方法
2.4.1 血液指标及酶活性检测 空腹血糖、血浆胰岛素浓度分别采用比色法和酶联免疫(ELISA)测定,试剂盒由南京建成生物工程研究所提供。线粒体柠檬酸合成酶(CS)、羟脂酰CoA脱氢酶(β-HAD)活性检测均采用美国GENMED科技公司试剂盒,蛋白定量采用考马斯亮蓝法。Tecan Infinite M200酶标仪检测吸光度。
2.4.2 实时荧光定量PCR检测CPT-1β、PGC-1α的基因转录 提取大鼠腓肠肌组织总RNA,逆转录体系中约含RNA0.1~5 μg,逆转录后得cDNA模板。PCR总反应体系20 uL,包括cDNA 模板 4 uL、预混液 16 uL(2×SYBR green PCR MasterMix 10 uL,前后引物各1 uL,RNase free水 4 uL)。CPT-1β上游引物:5'-ATCTCGGTTCCAGTTCTACT--TCC-3'; 下 游 引 物 :5'-ACGACAGTCTCACTTAGAGGCAC-3',PGC-1α 上游引 物:5'-TGCAG--GCCTAACTCCTCCCAC-3'; 下 游 引 物 :5'-AATAGGCCATCCATGGCTAGTCC-3',β-actin 上游引物:5'-CCTCTATGCCAACACAG--TGC-3'; 下 游 引 物 :5'-ATACTCCTGCTTGCTGATC--C-3'。PCR温度循环参数:Step 1:预变性[95 ℃,60 s];Step 2:[95 ℃,15 s;61 ℃,30 s;72 ℃,45 s,收集荧光]×40个循环;Step 3:建立熔解曲线,再变性[95℃,75 s],退火[55℃,60 s],然后从55℃缓慢加热到95℃,15 s;每1℃收集荧光。反应结束后,按照各反应孔Ct值,以β-actin基因为内参,根据公式2-ΔCt计算各样品目的基因相对表达量。
2.4.3 骨骼肌线粒体、细胞核提取 取(50~100)mg腓肠肌组织:1)加入1 mL线粒体匀浆介质,电动匀浆后1 300 g 4℃离心10 min,将上清液17 000 g 4℃离心15 min,保留沉淀,加入1mL匀浆介质,重悬,17 000 g 4℃离心15 min,弃上清保留沉淀(线粒体),加入0.5 mL匀浆介质,重悬,保存待测。2)加入1 mL细胞核裂解液,电动匀浆后1 000 g 4℃离心10 min,弃上清,加入1 mL浓蔗糖溶液,吹打重悬(细胞核粗提物),重悬液23 000 g 4℃离心30 min,弃上清,加入0.3 mL细胞核裂解液和0.3 mL甘油,吹打重悬,-80℃保存。
2.4.4 Western Blotting测定线粒体CPT-1β、细胞核PGC-1α的蛋白表达量 分别提取线粒体、细胞核蛋白作为待测样品,采用BCA蛋白定量方法测定各样品总蛋白浓度,-80℃保存待检测。取100 L样品加入5×SDS上样buffer,每上样孔加样30 L。配胶放入100 mL阴极buffer,平衡15 min,用甲醇(100%)和双蒸水浸泡后取出用阳极bufferII平衡10 min后转膜1 h,将膜与胶及滤纸剥离,用丽春红溶液检测转膜效率。一抗(山羊抗PGC-1α 单克隆抗体、GAPDH,Santa Cruz公司生产)、二抗(HRP标记兔抗山羊二抗,Santa Cruz公司生产)中孵育后DBA溶液显色,水洗膜终止反应。TANON GIS-2008凝胶成像仪拍照并用天能GIS凝胶图像处理系统进行数据分析,每个泳道得到迁移率、强度、净面积、平均密度4个数据。以待测蛋白与内参蛋白的平均密度之比作为待测蛋白的相对表达水平。
2.5 统计学分析
SPSS15.0软件分析处理数据,采用双因素方差分析检验不同影响因素(膳食、运动)对变量的影响,并用Tukey法检验组间差异显著性。检测结果以均数±标准差(±S)表示,以P<0.05表示在统计学上有显著性差异,以P<0.01表示在统计学上有极显著性差异。
3 研究结果
3.1 耐力训练对高脂膳食大鼠体重的影响
各组大鼠体重较实验前均有所增长。高脂膳食对大鼠体重有显著影响,H组比C组显著增高(F=4.728,P=0.036)。此外,R组与H组相比,大鼠体重显著降低,具有极显著性差异(P=0.000)(见图 1)。
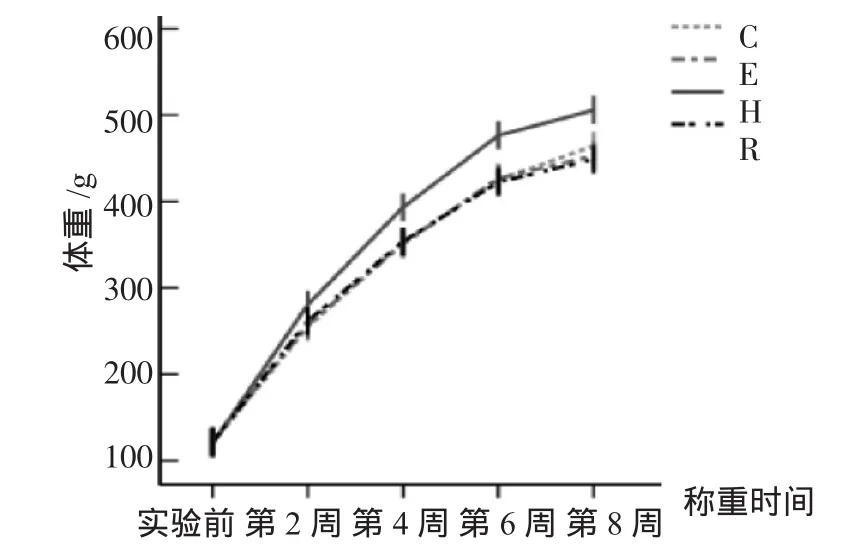
图1 大鼠体重变化曲线Fig 1 Rats'Weight(g)of Different Groups
3.2 耐力训练对高脂膳食大鼠IRI的影响
与C组相比,高脂膳食(F=7.163,P=0.015)、耐力训练(F=9.904,P=0.005)对大鼠IRI均有显著影响。此外,R组与H组相比,大鼠IRI显著降低,具有极显著性差异(P=0.021)(见表1)。

表1 大鼠胰岛素抵抗指数Table 1 IR Index of Rats
3.3 耐力训练对高脂膳食大鼠骨骼肌β-HAD、CS活性的影响
与C组相比,高脂膳食、耐力训练单因素以及膳食与运动交互作用对大鼠骨骼肌β-HAD、CS活性均具有显著影响,其中H组β-HAD活性显著增高,CS活性显著降低,E组β-HAD、CS活性均显著增高。此外,R组与H组相比,β-HAD活性显著增高(P=0.001)(见表 2)。

表2 骨骼肌线粒体β-HAD、CS活性Table 2 The Activity of Skeletal Muscle Mitochondrial β-HAD、CS
3.4 耐力训练对高脂膳食大鼠骨骼肌CPT-1β、PGC-1α基因表达的影响
与C组相比,高脂膳食对大鼠CPT-1β mRNA(F=47.759,P=0.000)及蛋白(F=11.456,P=0.002)表达影响显著;耐力训练使大鼠CPT-1β mRNA表达显著增高(F=11.204,P=0.002)。此外,R组与H组相比,CPT-1β mRNA表达显著增高(P=0.037)(见图2)。与C组相比,高脂膳食使大鼠PGC-1α蛋白表达显著增高(F=43.283,P=0.000);耐力训练使大鼠 PGC-1α mRNA 表达显著降低(F=21.796,P=0.000);膳食与运动交互作用对大鼠PGC-1α蛋白表达影响显著(F=20.832,P=0.000)。此外,R组与H组相比,PGC-1α mRNA表达显著降低(P=0.003)而其蛋白表达显著增高(P=0.007)(见图 3)。

图2 CPT-1β mRNA、蛋白表达(n=6)Fig 2 CPT-1β mRNA and Protein Expression

图3 PGC-1α mRNA、蛋白表达(n=6)Fig 3 PGC-1α mRNA and Protein Expression
4 讨论与分析
4.1 耐力训练对高脂膳食大鼠体重的影响
耐力训练对普通膳食大鼠体重无显著影响,而使高脂膳食大鼠体重增长幅度明显降低,从而使大鼠在高脂膳食作用下,体重仍能够保持与普通膳食大鼠相同的增长幅度。由此说明,高脂膳食伴随耐力训练可以有效地抑制高脂膳食单因素下的体重增长。耐力训练主要依靠脂肪氧化供能,高脂膳食下机体摄入脂肪过多,耐力训练的优势得以充分体现。提示我们,高脂膳食的个体可通过耐力训练的运动方式限制体重增长,而普通膳食个体也可通过耐力训练维持正常体重。
4.2 耐力训练对高脂膳食IR指数的影响
IR是指机体对一定量胰岛素的生物学反应低于正常水平的一种现象,即对胰岛素不敏感。IR指数是衡量机体胰岛素抵抗程度的指标之一,造成IR的原因十分复杂。一种观点认为,高脂膳食机体骨骼肌中脂肪代谢中间产物含量过多是导致IR的原因之一[7]。研究发现,受试者连续高脂膳食4周后,骨骼肌中IMTG含量将增高50%,降低食物中脂肪含量,仅3周IMTG含量将明显下降[8]。由此推测,高脂膳食会增加机体脂代谢负荷,致使脂肪代谢中间产物在体内堆积,不能够及时被完全氧化,易造成胰岛素信号系统异常,导致IRI升高。而耐力训练可缓解由高脂膳食引起的IRI过高现象,并且使机体IRI维持在正常水平。目前研究认为,运动可以通过改善胰岛素受体处和胰岛素受体后抵抗来增加胰岛素的敏感性,进而预防与IR相关的糖脂代谢紊乱,2-型糖尿病、高血压等疾病的发生[9]。Lorraine指出,有氧运动可降低骨骼肌脂肪含量,加速骨骼肌中脂肪酸氧化及增加肌肉对葡萄糖的摄取能力,从而对控制血糖含量具有重要作用[10]。
4.3 耐力训练对高脂膳食大鼠骨骼肌线粒体β-HAD、CS活性的影响
β-HAD与CS分别是反映线粒体β氧化、三羧酸循环水平的关键调节酶。有研究表明,人体在进行6天高脂膳食[11]或4周适当高脂膳食(脂肪含量占总能量的53%)[12]后骨骼肌β-HAD活性与普通膳食均无差异。本研究发现,8周高脂膳食提高大鼠β-HAD活性但却使CS活性明显降低。由此推测,高脂膳食提高线粒体β氧化水平,却降低线粒体TCA循环水平,使脂肪β氧化终产物乙酰辅酶A不能及时进入TCA循环进行氧化代谢,从而造成这些脂肪代谢中间产物在线粒体内堆积,加重高脂负荷,影响线粒体功能及脂肪氧化水平。此外,耐力训练使高脂膳食大鼠骨骼肌β-HAD、CS活性显著增高,说明耐力训练可通过脂肪消耗供能,进一步提高线粒体β氧化,同时积极改善线粒体功能,提高TCA循环水平以缓解高脂膳食对线粒体脂肪氧化的负面影响。2007年Muoio假设,线粒体β氧化与TCA循环之间存在的“disconnect”是诱发产生IR现象的一个主要原因[13]。2009年Gaster发现,肥胖型糖尿病肌管的线粒体β氧化与TCA循环之间存在“mismatch”[14]。因此,进一步研究这种“disconnect”或“mismatch”及运动对其的作用是深入认识诱发IR机制及预防、治疗与IR相关代谢综合征的新途径。
4.4 耐力训练对高脂膳食大鼠骨骼肌CPT-1β、PGC-1α基因表达的影响
高脂膳食使大鼠CPT-1β基因在转录水平代偿性增高,却显著抑制CPT-1β蛋白表达水平。若过多LCFA不能及时进入线粒体进行氧化,势必会造成细胞内脂肪代谢中间产物堆积,进而影响机体正常脂肪代谢。此外,运动可通过激活PPARα有效促进机体对脂肪酸的利用,从而提高CPT-1表达量[15]。耐力训练通过对骨骼肌CPT-1β基因的调控,使机体即使处于高脂膳食状态,也会加速脂肪代谢,缓解体内脂肪异位沉淀。有趣的是,耐力训练同样并没有使高脂膳食大鼠CPT-1β蛋白表达呈一致上调。这种同一基因在转录水平上调但在翻译水平未出现一致性上调的现象时有发生,可能由于基因在转录与翻译之间需要诸多环节,任何一个环节都可能决定基因最终的蛋白表达水平。总之,运动对CPT-1调节的复杂性显而易见,对骨骼肌CPT-1β基因转录水平以及翻译后蛋白表达水平的调节存在许多变数。运动训练时机体对脂肪酸供给的需求状况决定了线粒体脂肪酸的氧化程度,并非只要进行耐力训练就一定会使机体脂肪代谢相关基因表达上调,其最终变化方向主要取决于机体需求。此外膳食结构也是影响运动对CPT-1调节的一个重要因素。
高脂膳食虽然使大鼠PGC-1α蛋白表达显著上调,却降低线粒体CS活性并伴随IRI增高。提示:高脂膳食诱导PGC-1α蛋白表达上调会对机体产生不利影响。有研究表明,PGC-1α超出正常水平过度上调或下调,都将对机体产生负面影响[16]。此外,高脂膳食大鼠伴随耐力训练时骨骼肌PGC-1α在转录水平显著下调,而在转录后翻译水平却显著上调,并与高脂膳食单因素作用于大鼠的效果截然不同,说明耐力训练可能使骨骼肌PGC-1α基因转录—翻译过程高效化,使机体向良性代谢状态转变。值得注意的是,耐力训练使普通、高脂膳食大鼠PGC-1α mRNA表达均显著降低,这与以往研究结果不同,或许因为运动诱导PGC-1α基因表达具有很强的时相性。运动后PGC-1α基因表达显著增高,运动后2 h时达到峰值,2 h后呈现下降趋势,24 h时基本与运动前水平一致[17]。另外,耐力训练对普通膳食大鼠PGC-1α蛋白表达水平的调控趋于稳定,而对高脂膳食大鼠的调控较为显著。
5 结 论
耐力训练可有效控制高脂膳食大鼠体重增长速度并有利于其IRI维持在正常水平。耐力训练通过适度调节参与线粒体脂肪氧化过程β-HAD、CS关键酶活性及CPT-1β、PGC-1α基因表达,优化机体在线粒体水平的脂肪氧化能力,从而使高负荷线粒体脂肪氧化状态得以缓解,为高脂膳食机体在线粒体水平维持正常的脂肪氧化提供保障。
[1]Peter M.Travis J.Themed Review:Lifestyle Treatment of the Metabolic Syndrome[J].American Journal of Lifestyle Medicine,2008,2:99-108.
[2]杜蕾,柳宝华,王友华,等.运动训练对高脂膳食大鼠主动脉m-2受体的影响[J].西安体育学院学报,2010,(1):72-75,95.
[3]马国栋,刘艳环,刘善云.有氧运动对高脂膳食诱导小鼠脂肪肝及血脂改善效果的观察[J].天津体育学院学报,2006,(1):41-43.
[4]Bente K.Skeletal Muscle Lipid Metabolism in Exercise and Insulin Resistance[J].Physiol Rev,2006,86(2):205-243.
[5]Puigserver P,Wu Z,Park C W.A cold inducible coactivator of nuclear receptors linked to white adipocytes adaptive thermogenes[J].Cell,1998,92:829-839.
[6]陈丹,毕会民,毕欣.运动对胰岛素抵抗大鼠骨骼集中糖原合成酶激酶-3 表达的影响[J].中华物理医学与康复杂志,2006,28(3):153-156.
[7]Goodpaster B H,He J,Watkins S.Skeletal muscle lipid content and insulin resistance:evidence for a paradoxin endurance-trained athletes[J].Clin Endocrinol Metab,2001,86:5 755-5 761.
[8]Coyle E F,Jeukendrup AE,OsetoMC.Low-fat diet alters intramuscular substrates and reduces lipolysis and fat oxidation during exercise[J].Am J Physiol Endocrinol Metab,2001,280:E391-E398.
[9]刘奇刚、衣雪洁.运动影响胰岛素抵抗的机制[J].北京体育大学学报,2007,30(4),519-521.
[10]Turcotte L P,Fisher J S.Skeletal Muscle Insulin Resistance:Roles of Fatty Acid Metabolism and Exercise[J].Physical Therapy,2008,88,11:1 279-1 296.
[11]Peters S J,Amand T A,Howlett R A.Human skeletal muscle pyruvate dehydrogenase kinase activity increases after a low-carbohydrate diet[J].Am J Physiol Endocrinol Metab,1998,275:E980-E986.
[12]Kiens B,Essen G,Gad P.Lipoprotein lipase activity and intramuscular triglyceride stores after long-term high-fat and high-carbohydrate diets in physicallytrained men[J].Clin Physiol,1987,7:1-9.
[13]MuoioDM,KovesTK.Skeletalmuscleadaptationtofattyacid dependson coordinated actions of the PPAR and PGC-1:implication for metabolic disease[J].Appl.physiol.Nutr.Metab,2007,32:874-883.
[14]Gaster M.Reduced lipid oxidation in myotubes established from obese and type 2 diabetic subjects[J].Biochemical and Biophysical Research Communication,2009,382:766-770.
[15]张玥,姜宁,苏丽.PPARα与运动改善脂质代谢的关系[J].中国康复医学杂志,2008,23(6):495-498.
[16]Christoph H.The biology of PGC-1a and its therapeutic potential[J].Trends in Pharmacological Sciences,2009,30,3:105-113.
[17]Henriette P,Bengt S.Exercise induces transient transcriptional activation ofthe PGC-1a gene in human skeletal muscle[J].J Physiol,2003,546,3:851-858.
Effects of Endurance Training on Mitochondrial Lipid Oxidation and PGC-1α Gene Expression of High-Fat Diet Rats'Skeletal Muscle
ZHANG Yuan,QI Zhengtang,GUO Wei,DING Shu-zhe
(School of PE&Health,East China Normal University,Shanghai 200241,China)
Purpose:Investigate the effects of 8-week endurance training on mitochondrial lipid oxidation-related enzymes and genes expression in high-fat diet rats.Methods:40 male SD rats were randomly assigned to standard diet control group (C)and endurance training group (E),high-fat diet control group (H)and endurance training group (R),ten in each group.The two endurance training groups'rats were accustomed to 8-week treadmill training.Results:Endurance training efficiently decreased the weight(P=0.000)and IR index(P=0.021)in the high-fat diet rats as well as significantly increased the activity of β-HAD(P=0.011),CS(P=0.047)and the expression of CPT-1β mRNA(P=0.037)and PGC-1α protein(P=0.007)in high-fat diet rats'skeletal muscle mitochondrial.Conclusion:Endurance training optimizes the whole process of fat oxidation at the mitochondrial level through moderate regulating the activity of β-HAD and CS enzymes and the expression of CPT-1β and PGC-1α,which are involved in mitochondrial fat oxidation.
mitochondrial fat oxidation;high-fat diet;endurance training;mitochondrial lipid oxidation;insulin resistance(IR);CPT-1β;PGC-1α
G 804.2
A
1005-0000(2010)03-0193-04
2010-02-08;
2010-04-08;录用日期:2010-04-13
国家自然科学基金项目(项目编号:30871212);教育部新世纪优秀人才支持计划(项目编号:790013p8)
张 媛(1984-),女,陕西宝鸡人,华东师范大学在读博士研究生。
