SUMO-1在HIF-1/VEGF信号通路中作用
2010-09-14薛庆於郭联和于智勇王君沈维干
薛庆於,韩 野,郭联和,王 俊,于智勇,王君,沈维干
(1.扬州职业大学生化工程系,江苏扬州,225000;2.扬州大学医学院,江苏 扬州,225001)
泛素系统和其对蛋白质翻译后的修饰作用的影响是细胞内蛋白质功能调节的关键信号通路。与泛素化修饰引起靶蛋白降解不同,真核细胞中存在一种小的类泛素修饰因子-1(SUMO-1),其对蛋白质的修饰作用是调节细胞中蛋白质与蛋白质的相互作用和转录活性、增强底物的稳定性或影响靶蛋白亚细胞定位[1-3]。基因芯片研究结果显示,缺氧培养的细胞中SUMO-1 mRNA的表达表现为时间依赖性的增加[4]。缺氧应激研究发现,许多SUMO-1的底物与转录或者翻译后的调节相关,这些底物包括 p53、Mdm2、c-jun、Glut-1和Glut-4等,提示SUMO-1在缺氧应答中扮演重要角色[4-5]。
细胞对低氧应激的直接反应之一是在细胞内积聚缺氧诱导因子-1(HIF-1)。HIF-1是由HIF-1α和HIF-1β亚单位组成的异二聚体。在正常氧供应的环境中,HIF-1α通过泛素化/蛋白酶体途径降解;在缺氧时,HIF-1α与HIF-1β形成稳定异二聚体转移到细胞核中,与许多基因(如VEGF、纤溶酶原活化蛋白抑制基因等)的启动子或增强子区域的缺氧反应元件结合,从转录水平上调节与血管生成、糖代谢等过程相关的基因的表达,表现为多方位、多途径的调节作用[6]。
尽管类泛素化修饰作用的生物化学和酶学已经被揭示,但是绝大多数的报道仅集中在SUMO-1如何识别和与靶蛋白相互作用,有关SUMO-1表达的调节和其功能的实施在体内外仍然了解很少,特别是对于SUMO-1在低氧或缺氧环境下与HIF-1以及由HIF-1引起的下游信号通路的作用尚无确切的报道。本研究主要研究SUMO-1在低氧应激过程中对HIF-1α表达以及对依赖于HIF-1的基因转录激活的影响。
1 材料与方法
1.1 材料
荧光素酶报告基因质粒pGL-VEGF/K(含有VEGF启动子全长序列的表达荧光素酶的报告质粒)、pGL-VEGF/P(缺乏HRE的表达荧光素酶的报告质粒)、pGL-HREmut(含有突变位点的HRE的表达荧光素酶的报告质粒)和pGL-HRE(仅含有HRE的表达荧光素酶的报告质粒)由美国NIH的Gutkind教授惠赠[7]。pcDNA3.1-SUMO-1、pEGFP-C3 、β-半乳糖苷酶报告质粒(β-gal)和HEK293细胞为本实验室保存。胶回收试剂盒及质粒提取试剂盒购自Qiagen公司,小牛血清购自杭州四季清生物工程材料有限公司,DMEM购自Gibico公司,鼠抗人HIF-1α和 α-tubulin单克隆抗体和兔抗鼠IgG抗体购自Santa cruz公司,限制性内切酶EcoR I、Hind III和T4 DNA连接酶为NEB公司产品,脂质体转染试剂购自Invitrogen公司,低氧培养盒购自中国长沙长锦科技有限公司;低氧混合气(1%O2、5%CO2和平衡N2)购自南京特种气体厂。
1.2 方法
1.2.1 构建pEGFP-C3-SUMO-1真核表达质粒按照文献报道的方式[8],用限制性内切酶EcoRⅠ、HindⅢ酶切质粒pcDNA3.1-SUMO-1,经琼脂糖凝胶电泳、DNA胶纯化试剂盒纯化目的基因片段,获得人SUMO-1目的基因,并亚克隆到表达载体pEGFP-C3的相应酶切位点中得到pEGFP-C3-SUMO-1真核表达质粒。
1.2.2 质粒转染和稳定细胞系的筛选:HEK293细胞接种到6孔板中,培养于含10%小牛血清、100 mg/L青霉素和1 000 U/L链霉素的DMEM培养液中,在37℃,含5%CO2湿度饱和的培养箱中培养。采用脂质体转染方法,按照说明书操作分别转染pEGFP-C3和pEGFP-C3-SUMO-1到培养的相应的HEK293细胞中,培养48 h后通过G418抗性法筛选稳定表达GFP和GFP-SUMO-1的HEK293细胞系,G418浓度为300 mg/L。用荧光显微镜观察转染效果。
1.2.3 免疫印迹检测:对数生长期的HEK293细胞、稳定表达 GFP和GFP-SUMO-1的HEK293细胞,常氧和低氧培养24 h后,分别用预冷的PBS洗2次,吸干所有液体,加细胞裂解缓冲液(临用前补加2 mmol/L PMSF和 cocktail),冰浴30 min后,1 2000 g离心10 min,取上清。采用Bradford法进行蛋白定量,加入样品缓冲液,99℃处理 5 min,加样到 8%SDS PAGE,按常规方法转印至PVDF膜,随后用含3%BSA的PBS进行封闭1 h,与一抗孵育,4℃过夜,分别用PBS-Tween 20洗膜3次,每次10 min,用碱性磷酸酶结合的二抗室温孵育2 h,用含有NBT和BCIP的碱性磷酸酶缓冲液显色。实验重复3次。
1.2.4 荧光素酶报告基因质粒转染和检测:细胞瞬时转染采用常规磷酸钙沉淀方法,分别用相应的报告质粒pGL-VEGF/K、pGL-VEGF/P、pGLHREmut或 pGL-HRE(每孔 1.5 μ g)与 β-gal(作为内标,每孔0.5 μ g)共转染HEK293细胞、稳定表达GFP和GFP-SUMO-1的HEK293细胞,过夜培养后用PBS洗细胞2次,更换培养液,分别在常氧和低氧条件下继续培养24 h。低氧培养时,将细胞置于密封的低氧培养盒中,用低氧混合气平衡10 min(1 L/min),然后转移到37℃培养箱中培养。采用Promega公司提供的试剂盒,按照说明书操作,检测细胞裂解液中荧光素酶的活性;用邻-硝基苯-β-D半乳糖苷(ONPG)为底物,检测β-半乳糖苷酶活性作为对照(转染效率),计算荧光素酶的活性,并与对照组相比,计算并比较变化的倍数,每组设3个复孔,实验重复3次。
1.2.5 统计学处理:采用SPSS 11.0统计软件的One-way ANOVA程序进行单因素方差分析,进行数据处理,结果以(±s)表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 SUMO-1与GFP融合基因在HEK293细胞中的表达
pEGFP-C3和pEGFP-C3-SUMO-1转染HEK293细胞,经G418筛选后的建立稳定表达细胞系,荧光显微镜观察结果显示转染pEGFPC3的细胞中GFP分布于整个细胞,而转染pEGFP-SUMO-1的细胞中融合蛋白的表达集中于细胞核中(图1)。
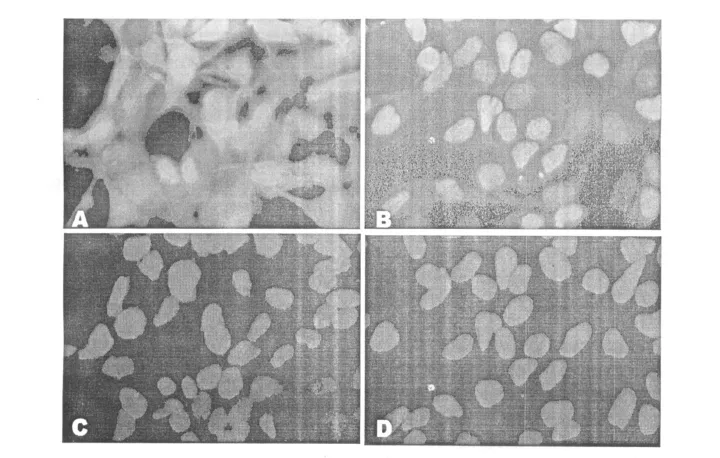
图1 SUMO-1基因在HEK293细胞中的表达 (200倍)
2.2 低氧可以上调SUMO-1的表达
对数生长期的HEK293细胞,经常氧和低氧培养24 h后,免疫印迹结果由图2可见,与常氧培养相比,低氧可以上调HEK293细胞中SUMO-1蛋白的表达。
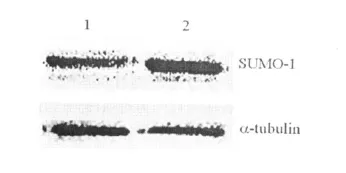
图2 Western blot检测HEK293细胞中SUMO-1的表达
2.3 SUMO-1可以上调HIF-1α的表达
HEK293细胞、稳定表达 GFP和 GFPSUMO-1的HEK293细胞,在低氧培养盒中培养24 h后,裂解细胞,经定量分析后的细胞裂解液与SDS-PAGE上样缓冲液混匀处理后,电泳、转膜、抗体结合并检测。实验结果由图3可见,稳定表达SUMO-1的HEK293细胞中的HIF-1α的表达量与未转染(空白对照组)和转染pEGFP-C3的HEK293细胞中的表达量相比显著提高。
2.4 SUMO-1可以上调HEK293细胞中HIF-1α的转录活性
应用一系列的 VEGF-Luc报告质粒(pGLVEGF/K 、pGL-VEGF/P 、pGL-HREmut和 pGLHRE)分别转染HEK293细胞、稳定表达GFP和GFP-SUMO-1的HEK293细胞,并进行低氧和常氧培养24 h后的实验结果由图4可见,在常氧和低氧培养时,稳定表达SUMO-1的HEK293细胞(C)组与空白对照组(未转染的细胞,A)和稳定表达GFP的细胞(转染pEGFP-C3的细胞,B)相比,pGL-VEGF/K和pGL-HRE转染后表达的荧光素酶报告基因活性明显增高,而A、B组细胞无论常氧培养还是低氧培养,两组之间相比均无显著性差异。稳定表达SUMO-1的细胞(C)在pGL-VEGF/P和pGL-HREmut转染的细胞中荧光素酶报告基因活性,无论在常氧培养还是低氧培养时,与空白对照组(A)和稳定表达GFP的细胞组(C)相比均无显著性差异。
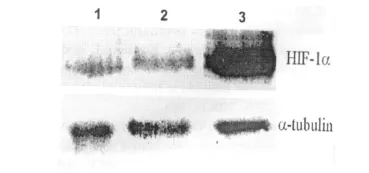
图3 Western blot检测转染细胞的HIF-1α的表达

图4 SUMO-1对依赖于HIF-1的荧光素酶报告基因表达的影响
3 讨 论
缺氧与许多生理和病理过程密切相关。肿瘤的生长、浸润和转移过程依赖于血管新生,依靠新生血管来提供营养(包括氧气)和排泄废物。在缺乏新生血管的情况下,肿瘤通常在长到几毫米后由于缺氧而停止生长[9]。细胞对低氧应激的直接反应之一是在细胞内积聚转录因子HIF-1,在细胞对环境条件的应答调节中发挥重要作用[4,9]。低氧应激的小鼠的脑组织和心脏组织中SUMO-1的表达上调,而这种上调可以在体内调节HIF-1α的功能[10]。HIF-1参与细胞内的多种生物学过程,包括血管生成、能量代谢以及细胞存活等。HIF-1有对氧气敏感的HIF-1α以及对氧气不敏感的HIF-1β组成,而 HIF-1α需经历翻译后的修饰,如羟基化修饰、泛素化修饰、乙酰化修饰来调节其稳定性。由SUMO-1介导的HIF-1α的翻译后的修饰,可以稳定HIF-1α的稳定性,但是对其转录活性的影响的报道结果不一,有研究认为HIF-1α的翻译后的SUMO修饰并不影响HIF-1α的降解,HIF-1α与 SUMO共价结合,会导致HIF-1α的转录活性下降[11],而另外的研究则认为SUMO-1对HIF-1α的翻译后修饰,可以稳定并上调的表达,增加HIF-1α的转录活性[12]。
本研究首先应用表达SUMO-1与GFP融合基因的质粒转染HEK293细胞,并筛选稳定表达的细胞系,荧光显微镜观察结果显示转染pEGFP-C3的细胞中 GFP分布于整个细胞,而转染pEGFP-SUMO-1的细胞中融合蛋白的表达集中于细胞核中,明确了SUMO-1的核定位。通过低氧处理HERK293细胞,结果显示,低氧可以上调细胞中SUMO-1蛋白的表达,这与文献报道的结果是一致的[4,10]。利用筛选和建立的稳定表达SUMO-1细胞系,通过低氧培养,结果显示,稳定表达SUMO-1的HEK293细胞中的HIF-1α的表达量与空白对照组以及稳定表达EGFP的细胞中的表达量相比显著提高,说明在低氧应激过程中SUMO-1可以稳定或者上调HIF-1α。
为了证明在低氧应激过程中,SUMO-1稳定或者上调HIF-1α,是否会影响HIF-1的转录活性,本研究应用一系列含有VEGF启动子的不同缺失突变体的 VEGF-Luc报告质粒分别转染HEK293细胞、稳定表达GFP和GFP-SUMO-1的HEK293细胞,并进行低氧和常氧培养,实验结果表明,在常氧和低氧培养时,转染含有VEGF启动子全长序列的报告质粒(pGL-VEGF/K)和仅含有完整HRE的报告质粒(pGL-HRE)的稳定表达SUMO-1的HEK293细胞中的荧光素酶报告基因的表达与空白对照组以及稳定表达GFP的细胞中相比明显增高,尤以低氧培养时更加显著;而转染缺乏HRE的VEGF启动子序列的报告质粒(pGL-VEGF/P)和含有HRE突变位点的报告质粒(pGL-HREmut)的稳定表达SUMO-1的细胞中的荧光素酶报告基因的表达无论在常氧培养还是低氧培养时,与对照组相比均无显著差异。这些结果说明,在低氧应激培养条件下,SUMO-1可以明显上调HIF-1的转录活性,而且这种转录上调的机制是通过促进HIF-1与HRE序列的结合。
尽管SUMO-1修饰作用的生物化学和酶学已经被揭示[13],但是绝大多数的报道仅集中在SUMO-1如何识别和与靶蛋白相互作用,有关SUMO-1表达的调节和其功能的实施在体内外仍然了解很少,特别是对于SUMO-1在低氧或缺氧环境下与HIF-1以及由HIF-1引起的下游信号通路的作用尚无确切的报道。本实验结果表明,低氧可以上调SUMO-1的表达,SUMO-1过表达可以上调HIF-1α表达,当然这种上调是是否是通过直接抑制HIF-1α的泛素化降解来实现的,还有待于进一步研究,但是本研究结果进一步明确SUMO-1可以通过促进HIF-1与HRE序列的结合而上调HIF-1的转录活性。
[1]Matunis MJ,Coutavas E,Blobel G.A novel ubiquitin-like modification modulates the partitioning of the Ran-GTPaseactivating protein RanGAP1 between the cytosol and the nuclear pore complex[J].J Cell Biol,1996,135(6 Pt 1):1457.
[2]Desterro JM,Rodriguez MS,Hay RT.SUMO-1 modification of IkappaBalpha inhibits NF-kappaB activation[J].Mol Cell,1998,2(2):233.
[3]Kang SI,Chang WJ,Cho SG,et al.Modification of promyelocytic leukemia zinc finger protein(PLZF)by SUMO-1 conjugation regulates its transcriptional repressor activity[J].J Biol Chem,2003,278(51):51479.
[4]Comerford KM,Leonard MO,Karhausen J,et al.Small ubiquitin-related modifier-1 modification mediates resolution of CREB-dependent responses to hypoxia[J].Proc Natl Acad Sci USA,2003,100(3):986.
[5]Blagosklonny MV.Do VHL and HIF-1 mirror p53 and Mdm-2?Degradation-transactivation loops of oncoproteins and tumor suppressors[J].Oncogene,2001,20(3):395.
[6]Huang LE,Bunn HF.Hypoxia-inducible factor and its biomedical relevance[J].J Biol Chem,2003,278(22):19575.
[7]Sodhi A,Montaner S,Miyzaki H,et al.MAPK and Akt act cooperatively but independently on hypoxia inducible factor-1alpha in rasV12 upregulation of VEGF[J].Biochem Biophys Res Commun,2001,287(1):292.
[8]徐军发,袁春雷,杨衡,等.小鼠B7-H4基因克隆及真核表达载体的构建[J].细胞与分子免疫学杂志,2007,23:665.
[9]Harris AL.Hypoxia--a key regulatory factor in tumour growth[J].Nat Rev Cancer,2002,2(1):38.
[10]Shao R,Zhang FP,Tian F,et al.Increase of SUMO-1 expression in response to hypoxia:direct interaction with HIF-1alpha in adult mouse brain and heart in vivo[J].FEBS Lett,2004,569(1-3):293.
[11]Berta MA,Mazure N,Hattab M,et al.SUMOylation of hypoxia-inducible factor-1alpha reduces its transcriptional activity[J].Biochem Biophys Res Commun,2007,360(3):646.
[12]Bae SH,Jeong JW,Park JA,et al.Sumoylation increases HIF-1alpha stability and its transcriptional activity[J].Biochem Biophys Res Commun,2004,324(1):394.
[13]Carbia-Nagashima A,Gerez J,Perez-Castro C,et al.RSUME,a small RWD-containing protein,enhances SUMO conjugation and stabilizes HIF-1alpha during hypoxia[J].Cell,2007,131(2):309.
