基于CD107a标记流式细胞仪检测NK细胞毒性方法的建立
2010-09-14龚春香王长荣龚卫娟胡茂志季明春
龚春香,王长荣,龚卫娟,胡茂志,季明春
(1.扬州大学医学院免疫学教研室,江苏扬州,225001;2.金坛市人民医院,江苏金坛,213200;3.扬州大学测试中心,江苏扬州,225001)
NK细胞被称为大颗粒淋巴细胞,是体内抗肿瘤、抗病毒感染的第一道防线。其胞浆内含有高浓度以囊泡形式存在的细胞毒性颗粒,如穿孔素、颗粒酶等[1]。溶酶体相关膜蛋白-1(LAMP-1或CD107a)是一种高糖基化的蛋白,约占溶酶体膜蛋白的50%[2-3]。NK细胞杀伤靶细胞时,毒性颗粒将到达浆膜面并与细胞膜融合,引起颗粒内容物释放,最终导致靶细胞的死亡[4]。随着脱颗粒的发生,CD107a分子被转运到细胞膜表面,且CD107a分子的表达上调与穿孔素的分泌一致[5]。因此,CD107a分子阳性表达的NK细胞可代表具有杀伤活性的NK细胞。
长期以来,51Cr释放实验是检测细胞毒活性的金标准,但51Cr具有半衰期短和放射性等缺点[6]。国内大多采用乳酸脱氢酶(LDH)释放法,但表现出敏感性低的缺点[7],从而期待发展敏感、特异、安全、简单、快捷的检测细胞毒活性方法。本课题组曾建立稳定表达EGFP的K562细胞,将效应细胞与其作用后标记碘化丙啶(PI),计算PI和EGFP双阳性细胞占总EGFP细胞的比例,作为一种评估NK细胞毒活性的方法[8]。在此我们利用CD107a分子反映NK细胞脱颗粒的特点,标记效应细胞,建立基于CD107a标记流式细胞仪分析NK细胞毒性的方法。
1 材料与方法
1.1 实验材料
人淋巴细胞分离液购自Axis-shield。荧光抗体CD56-FITC(MEM188),CD107a-PECy5(eBioH4A3)购自 eBioscience公司。佛波脂醇(PMA)、离子霉素购自Sigma。RPMI-1640培养基购自invitrogen公司,胎牛血清购自杭州四季青公司。LDH法检测试剂盒CytoTox96 non-radioactive cytotoxicity assay购于Promega公司。
1.2 方法
1.2.1 细胞培养:K562是高度未分化,不表达MHCⅠ类分子的人红白血病细胞。用含10%胎牛血清的RPMI 1640培养基悬细胞,37℃,5%CO2孵箱培养。
1.2.2 人PBMCs的分离:健康志愿者外周血用PBS缓冲液作等倍稀释后,将细胞悬液与Ficoll分离液按体积比2∶1沿管壁缓慢加入至Ficoll分离液面上,室温 2 000 rpm,15 min,缓慢增速,无制动停转。吸取中间白雾状细胞层,PBS缓冲液洗涤2遍,用RPMI-1640培养基悬浮,显微镜下计数。
1.2.3 流式细胞仪(FCM)分析NK细胞CD107a表达:用RPMI 1640完全培养基悬PBMCs,调整浓度为1×106/mL,K562细胞作为靶细胞。将PBMCs与K562以一定比例混合,置于U型孔,37℃CO2培养箱孵育2 h,加莫能菌素(monensin,2 μ mol/L)继续孵育 3.5 h后加 PE-Cy5-CD107a、FITC-CD56抗体孵育半 h。PBS 缓冲液洗涤3次后,用200 μ L 1%多聚甲醛固定进行流式分析。PBMCs同时仅用佛波脂醇(PMA,2.5 μ g/mL)和离子霉素(Ionomycin,0.5 μ g/mL)刺激为阳性对照。
1.2.4 LDH释放法分析NK细胞杀伤毒性:将不同稀释度的PBMCs与对数期K562细胞按1:3、1:1、3:1的效靶比例混合,250 g离心4 min,37℃5%CO2孵箱培养4 h,收集上清,加入底物作用 30 min后,再加入终止液检测各孔490 nm时的吸光度值。同时设靶细胞的自然释放孔、最大释放孔、培养基对照孔、体系效正孔、效应细胞自然释放孔,每组细胞设4复孔。杀伤百分率=(实验组-效应细胞自然释放-靶细胞自然释放)/(靶细胞最大释放-靶细胞自然释放)×100。
2 结 果
2.1 FCM 分析CD56和CD107a双阳性细胞
外周血单个核细胞(PBMC)与K562细胞按3∶1相互作用后,按上述方法标记FITC-CD56和PE-Cy 5.5-CD107a抗体,FCM检测荧光标记双阳性细胞占总NK细胞的比例。同时,按相同方法标记设未加靶细胞的NK细胞,检测其自发CD107a分子的表达,以单纯PMA/Ionomycin刺激作为阳性对照。流式双标记点图中,(Q2/Q2+Q4)×100即表示 CD107a阳性的NK细胞频率(%)。最终NK细胞毒性的计算方法=加靶细胞刺激的 CD107a阳性率(%)-CD107a自发表达率(%)。
2.2 CD107a抗体孵育时间对FCM检测结果的影响
为阻止转运到细胞膜表面的CD107a分子因膜内吞而降低检测阳性率,Alter等使用莫能菌素抑制细胞膜的内吞。但同时莫能菌素抑制高尔基体介导的转运,对细胞产生一定毒性[9]。如果CD107a抗体在PBMCs与K562细胞刚孵育时就加入培养体系,该抗体可能与很多低活性状态NK细胞(细胞膜通透性增加)内囊泡上CD107a分子结合,导致检测结果的假阳性。
因此我们首先观察莫能菌素与PBMC孵育4 h对NK细胞CD107a标记的影响,在PBMC培养体系中(不含靶细胞)先加入CD107a抗体,1h后与莫能菌素孵育,4 h后标记CD56抗体FCM检测,并与不加莫能菌素的PBMC进行比较。结果发现当培养体系CD107a抗体与莫能菌素孵育4 h后,CD107a抗体标记出现严重的假阳性(图2),提示莫能菌素对细胞有一定毒性。

图1 显示FCM检测CD56+CD107a+细胞的流式分析结果
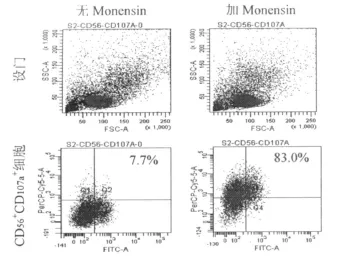
图2 长时间Monensin孵育引起C D107a标记假阳性
另外,我们对Alter等的方法进行改进,分为2组:第1组在PBMCs与K562混合孵育的同时加入CD107a抗体,2 h后加莫能菌素,再孵育2 h标记CD56抗体;另一组PBMCs与 K562混合,孵育2h加莫能菌素,孵育1.5h后同时标记CD107a和CD56抗体。结果显示,第 1组 NK细胞的CD107a自发阳性率与加入 K562细胞的 CD56+CD107a+细胞频率无明显区别,而第2组NK细胞的CD107a自发阳性率明显降低,加入靶细胞后CD56+CD107a+细胞频率可达自发CD107a阳性率的8倍(图3)。

图3 CD107a抗体孵育时间对FCM检测结果的影响
2.3 不同效靶比例对FCM检测结果的影响
为观察不同PBMCs与K562的比例对检测结果的影响 ,分别以 2.5∶1、5∶1、10∶1、20∶1 、40∶1的比例按上述第2组方法检测了2例不同正常个体,结果发现随着效靶比例的增高,未观察到CD56+CD107a+细胞频率的明显提高(图4)。因此我们又深入分析PBMCs与K562细胞按3∶1、1∶1和1∶3的比例相互作用,发现随着效靶比例的降低,CD56+CD107a+细胞频率同样相应降低(图5),提示使用该方法检测细胞毒活性时,并不需要较高的效靶比例就能得到明显结果。
2.4 CD107a检测法与传统LDH释放法的关联
为观察该实验方法与传统LDH释放法检测结果的一致性,取同一个体的外周血,分别用CD107a标记和LDH法评估NK细胞毒活性。结果发现,当效靶比例分别为1∶3、1∶1、3∶1 时,2 种方法均显示杀伤效率随之增高,而CD107a标记法的数值相应增高(图6),提示该方法比LDH法更为敏感。

图4 高效靶比对CD107阳性NK细胞频率无明显影响
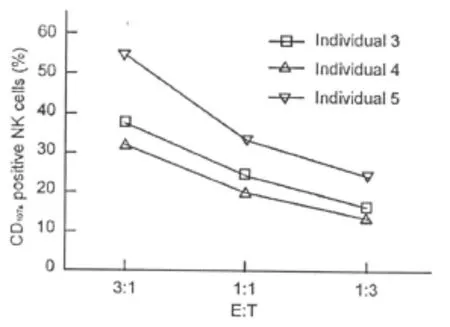
图5 低效靶比对CD107阳性NK细胞频率正相关

图6 CD107a标记法与LDH释放法检测结果一致
3 讨 论
本研究基于NK细胞释放其胞内穿孔素、颗粒酶的同时,CD107a分子向细胞膜迁移的现象,检测CD107a阳性NK细胞的频率以反映具有细胞毒活性NK细胞的频率,从而间接反映NK细胞的杀伤活性。另外,该方法不仅被证明所需效应细胞少、比LDH释放法敏感,还因改进CD107a抗体的孵育时间,降低了因莫能菌素的细胞毒性导致CD107a标记假阳性的现象。因此,我们在此成功建立一种基于CD107a标记而检测NK细胞毒活性的实验方法,具有简单、快速、敏感的优点。
正常NK细胞表面几乎不表达CD107a分子,但受靶细胞刺激后可大量表达于细胞膜表面[10],本实验证实NK细胞膜表面CD107a自发表达的频率很低,位于1.2%~5.8%。另外,因该方法主要涉及NK细胞膜表面CD107a的检测,保持NK细胞活力以维持细胞膜完整性尤为重要。NK细胞胞浆内含有大量包裹颗粒酶的囊泡结构,这些细胞器的膜上均含有CD107a分子[11],如果NK细胞活力降低引起细胞通透性增加,则抗体分子将穿过细胞膜引起与胞内CD107a分子的结合,导致检测结果的假阳性。我们证实虽然莫能菌素可抑制NK细胞膜的内吞,却对NK细胞的活力产生一定影响,预先加入CD107a抗体长时间孵育将引起严重的背景染色(图2),表现为Q1、Q2象限内均出现大量的CD107a阳性细胞。
为阻止因细胞膜内吞导致CD107a检测的假阴性结果,莫能菌素的使用绝对必要。尽管Alter等采取NK细胞与靶细胞孵育时即加入CD107a抗体的方法,可从最大程度上保证CD107a分子检测的阳性率,但容易引起假阳性。在本实验检测体系中,我们将效应细胞与靶细胞孵育2 h,充分刺激NK细胞后再加入莫能菌素,一方面降低莫能菌素对NK细胞的毒性,另一方面只要CD107a分子转移至细胞膜,因莫能菌素抑制CD107a的内吞,加入CD107a抗体孵育半h即可与所有阳性结合,而不会出现检测的假阴性。图3显示效靶细胞孵育后加入CD107a抗体标记,Q1象限内无明显阳性细胞;而效靶细胞孵育前加入CD107a抗体标记,Q1象限出现大量阳性细胞(CD56-细胞的着色)。
虽然51Cr释放法和LDH释放法检测敏感性不同,但所检测对象均是靶细胞的死亡率,所以靶细胞的状态对检测特异性影响大。当靶细胞数目固定时,效靶比例越高,对靶细胞的杀伤活性越强,靶细胞死亡率越高。而CD107a标记法检测的是效应(NK)细胞,当靶细胞数目固定时,在较低的效靶比例范围内效应细胞越多,发挥杀伤活性的NK细胞数随之增多。如果超出一定效靶比例时,效应细胞越多,CD107a阳性 NK细胞频率并不随之升高(图4,5)。因此,CD107a标记法检测细胞毒活性时仅需少量效应细胞,在检测临床标本时具有优越性。另外,由于CD107a分子在细胞表面的表达不受细胞因子分泌的影响[4],可通过流式细胞仪多色荧光标记同时分析NK细胞的细胞毒活性和细胞因子分泌情况。
[1]Cooper MA,Fehniger TA,Caligiuri MA.The biology of human natural killercell subsets[J].Trends Immunol,2001,22:633.
[2]Fukuda M,Lysosomal membrane glycoproteins.Structure,biosynthesis,and intracellular trafficking[J].Biol Chem,1991,266:21327.
[3]Kannan K,Stewart RM,Bounds W,et al.Lysosome-associated membrane proteins h-LAMP1(CD107a)and h-LAMP2(CD107b)are activation-dependent cell surface glycoproteins inhuman peripheral blood mononuclear cells which mediate cell adhesion to vascular endothelium[J].Cell Immunology,1996,171:10.
[4]Lettau M,Schmidt H,Kabelitz D,et al.Secretory lysosomes and their cargo in T and NK cells[J].Immunol.Lett,2007,108:10.
[5]Alter G,Malenfant JM.Altfeld M.CD107aas a functional marker for the identification of natural killer cell activity[J].Immunol M ethods,2004,294:15.
[6]Brunner K,Mauel J,Cerottini JC,et al.Quantitative assay of the lytic action of immune lymphoid cells on51Cr-labelled allogenic target cells in vitro;inhibition by isoantibody and by drugs[J].Immunology,1968,14:181.
[7]Korzeniewski C,Callewaert DM.An enzyme-release assay for natural cytotoxicity[J].Immunol Methods,1983,64:313.
[8]张俊,钱亚云,龚卫娟,等.利用流式细胞仪检测人外周血NK细胞毒性方法的建立[J].实用临床医药杂志,2006,10(4):28.
[9]Nylander S,Kalies I.Brefeldin A,but not monensin,completely blocks CD69expression on mouse lymphocytes:efficacy of inhibitors of protein secretion in protocols for intracellular cytokine staining by flow cytometry[J].Journal of Immunological Methods,1999,224:69.
[10]Aktas E,Kucuksezer UC,Bilgic S,et al.Relationship between CD107aexpression and cy totoxic activity[J].Cellular Immunology,2009,254:149.
[11]Winchester BG.Lysosomalmembrane proteins[J].European Journal of Paediatric Neurology,2001,5:11.
