流式细胞术和LDH释放法检测NK细胞杀伤效能的实用性比较
2021-07-08阳莉丘秀生胡元陈晓燕陈伟材卢建溪
阳莉,丘秀生,胡元,陈晓燕,陈伟材,卢建溪*
(1中山大学附属第三医院生物治疗中心,广州510000; 2中山大学附属第三医院疫苗研究所,广州510000;3东莞长安港湾医院内科,东莞 523000)
自然杀伤细胞(natural killer cell, NK细胞)是机体内的固有免疫细胞,负责杀伤老化、受病毒感染、肿瘤等异常细胞,并且无MHC限制性,它能自己识别和攻击外来病毒、癌细胞和异常细胞[1~3]。目前,NK细胞不仅广泛用于肿瘤病人的免疫治疗,还可应用于预防肿瘤发生及提高亚健康人群生活质量[4]。
检测NK细胞杀伤活性是评估体外培养的NK细胞生物学功能的主要方法。目前检测细胞毒性的方法有同位素释放法、MTT法、CCK-8法、LDH释放法、Calcein-AM释放法和流式细胞术等方法。同位素的方法对设备要求较高,费用较高,操作繁琐,又存在放射性污染的问题,使其推广使用受到限制;而酶反应比色法容易受各种因素影响致结果出现较大差异,重复性不佳;流式细胞技术可在单细胞水平分析细胞的自然凋亡和靶细胞的死亡,是近几年发展的一种方法[5~7]。本研究选取流式细胞术和LDH的方法检测体外培养的NK细胞对K562细胞的杀伤活性,对检测结果进行分析,优化了细胞浓度和效靶细胞比,为NK细胞功能评估提供稳定可靠的检测方案。
材料与方法
1 样本来源
白血病细胞株K562为本实验室保存。14例肿瘤患者外周血均来自中山大学附属第三医院岭南医院,其中男7例,女7例,年龄40~85岁,平均年龄(59.57 ± 3.38)岁,所有患者均签署知情同意书。
2 主要仪器与试剂
ALYS505NK-AC培养液和ALYS505NK-EX培养液(日本CSTI公司),RPMI1640培养液和胎牛血清(美国Gibco公司),重组人白细胞介素2(山东泉港药业),人淋巴细胞分离液(挪威Axis-shield公司),赫赛汀(美国Roche公司),淋巴细胞检测试剂盒CD45/CD56/CD19/CD3(美国Beckman Coulter公司),PI溶液(美国Sigma公司),羟基荧光素二醋酸盐琥珀酰亚胺脂(5,6-carboxyfluorescein diacetate succinimidy ester,CFSE)(美国 Thermo Fisher Scientific公司),LDH细胞毒性检测试剂盒(上海碧云天生物技术有限公司),流式细胞分析仪为 CytoFLEX(美国Beckman Coulter公司),酶标仪为 Spark 10M(瑞士TECAN公司),离心机为Centrifuge 5810R(德国Eppendorf公司),二氧化碳培养箱240i(美国Thermo Scientific公司)。
3 细胞培养
3.1 K562细胞株培养
白血病细胞株K562培养于含10% FBS的RPMI1640培养液中,置于37℃,5% CO2培养箱中培养,每隔3d换液。
3.2 NK细胞培养
用肝素钠抗凝管采集14份静脉血,密度梯度离心法分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),用 ALYS505NK-AC培养液重悬细胞,调整细胞密度为(1~3)×106个/ml,加入预先用赫赛汀包被好的培养瓶中,37. 5℃、5% CO2培养箱培养。每隔3d用ALYS505NK-EX培养液对细胞进行补液。培养14d后,收获细胞,使用淋巴细胞检测试剂盒CD45/CD56/CD19/CD3在流式细胞仪上测定NK细胞(CD3-CD56+)含量。
4 NK细胞的杀伤功能检测
4.1 LDH释放法
培养14d后,对NK细胞进行杀伤功能检测。以K562细胞作为靶细胞,浓度调整为1.0×105个/ml,按100μl/孔接种于96孔板;以NK细胞作为效应细胞,浓度调整为4×106个/ml,然后进行倍比稀释,每组效应细胞浓度分别为4×106个/ml、2×106个 /ml、1×106个 /ml和 5×105个 /ml,按 100μl/孔接种于96孔板,最终效应细胞与靶细胞的比例(效靶比)(effective target ratio, E/T ratio)分别为40:1、20:1、10:1和5:1,同时设靶细胞自然释放对照组和最大释放对照组,每组设3个复孔;250×g,离心5min后,将该96孔板置于37℃、5% CO2培养箱中孵育4h。取出 96 孔板,400×g,离心 5min,取 120μl上清液,加入到一新96孔板相应孔中,按LDH细胞毒性检测试剂盒说明书进行测定。
计算公式为:靶细胞杀伤率=(实验组OD值-靶细胞自然释放孔OD值)/(靶细胞最大释放孔OD值-靶细胞自然释放孔OD值)×100%。
4.2 CFSE/PI双染法流式细胞术
标记靶细胞:K562细胞浓度调整为1.0×106个/ml,加入荧光染料CFSE对靶细胞进行标记,37℃避光,染色20min;加5倍体积预冷的含10% FBS的RPMI1640培养液,冰浴5min,终止染色;调整细胞浓度至1.0×105个/ml。共培养:加入NK细胞作为效应细胞,每组效应细胞数目分别为4×106个/ml、2×106个 /ml、1×106个 /ml和 5×105个 /ml,最终效应细胞与靶细胞的比例分别为40:1、20:1、10:1和5:1,同时设靶细胞对照孔,250×g,离心5min后,置于37℃、5% CO2培养箱中孵育4h;荧光染料PI标记死亡细胞,4℃避光,染色30min;用CytoFLEX流式细胞仪进行检测及数据分析。
计算公式: 靶细胞杀伤率=(靶细胞死亡率-靶细胞自发死亡率)/(100-靶细胞自发死亡率)×100%。
5 统计学分析
采用GraphPad Prism 6统计软件进行统计学处理。各组靶细胞杀伤率用表示,两组间均数比较采用独立样本t检验,组内均数比较采用配对样本t检验,P<0.05代表差异显著有统计学意义。
结 果
1 CFSE对靶细胞高效标记
从培养第5d开始,细胞呈对数生长。流式细胞术测定NK细胞含量显示,CD3-/CD56+细胞第0d时比例为16.14%±2.07%,培养至第14d时,CD3-/CD56+细胞的比例为72.56 %± 4.14%,人外周血NK细胞经体外诱导增殖后,纯度较高(图1)。
靶细胞经过预先标记,可明显与效应细胞区分开来。靶细胞未标记时有少量的自发荧光(8.07%);靶细胞经CFSE染色后,37℃、5% CO2培养4h,部分细胞发生增殖,荧光分子随细胞分裂分配到两个子代细胞中,故出现两个峰,可见靶细胞的标记率达99.35%。与效应细胞共孵育后,能够显著地与未标记的效应细胞进行区分(图2)。

图1 PBMCs培养前后NK细胞纯度比较。A,培养前;B,培养至14d时Fig.1 Comparison of the purity of NK cells before and after PBMCs culture. A, before culture; B, after cultured for 14d

图2 CFSE对靶细胞标记率。A,未标记;B,CFSE标记Fig. 2 CFSE labeling rate of target cells. A, unlabeled cells; B, CFSE labeled cells
2 10:1效靶比时LDH法替代流式细胞术检测NK细胞体外杀伤效能
靶细胞和效应细胞混合孵育后,于倒置显微镜下观察,效靶细胞比为5:1时,细胞之间不能有效接触;效靶细胞比为10:1时,细胞接触良好且细胞团很少;效靶比为20:1时,细胞虽接触良好但细胞团较多;效靶细胞比为40:1时,大量细胞聚集成团,细胞团太多太大,效靶细胞反而不能有效接触。因此靶细胞浓度为1×105个/ml,效靶比为10:1的细胞密度比较合适(图3)。
流式细胞术CFSE/PI双色荧光标记法以CFSE+细胞进行设门(图4中P1门),分析该群细胞PI+的细胞,CFSE+PI-为正常靶细胞,CFSE+PI+为死亡的靶细胞(图4中P3门)。LDH法和流式细胞术检测NK细胞对白血病K562细胞株的杀伤活性显示,效靶比越大,其杀伤活性越强;其中在5:1低效靶比时,流式细胞术检测出的细胞杀伤活性明显高于LDH释放法,在10:1、20:1和40:1高效靶比时,两种方法检出的靶细胞死亡率无显著差异(表1)。

图3 不同效靶比下的细胞形态。A,5:1;B,10:1;C,20:1;D,40:1;箭头,细胞团;比例尺,100μmFig.3 Cellular morphology at different E/T ratios. A, 5:1; B, 10:1; C, 20:1; D, 40:1; arrow, cell mass; scale bar, 100μm
讨 论
过继免疫疗法是取患者自体淋巴细胞或免疫力强的供者淋巴细胞,经体外活化、扩增后,再回输入患者体内发挥抗肿瘤作用。NK细胞由于独特的抗肿瘤特点,在肿瘤免疫中的作用越来越受到重视[8-11]。鉴于NK细胞治疗的广阔应用前景,亟需建立一种高效的NK细胞培养及质量评估的方法,以满足临床应用的需要。由于肿瘤患者普遍年龄偏大且免疫功能低下,外周血NK细胞比例更低、含量更少且活性较差,体外培养CD3-CD56+细胞比例也较低。
通常根据对靶细胞的杀伤作用来评估NK细胞的生物学功能,目前的检测方法有很多种,各有优缺点。通过检测从细胞膜破裂的细胞释放到培养液中的LDH活性,就可以实现对细胞毒性的定量分析。LDH释放法被认为是传统的51Cr释放法进行细胞膜完整性检测的安全有效的替代方法。
CFSE是一种穿透细胞膜的荧光染料,进入细胞后可以不可逆地与细胞内的氨基结合偶联到细胞蛋白质上。当细胞分裂时,CFSE荧光可分配至两个子代细胞中,因此其荧光强度大约是亲代细胞的一半,利用流式细胞仪在488nm 激发光和FL1检测通道可对其进行分析,可用于细胞示踪和细胞增殖研究,同时也用于细胞毒活性的测定[12]。用CFSE标记活细胞,荧光在细胞中维持时间长、不易衰减、稳定,且对细胞生理活动没有影响,对靶细胞的标记率高,荧光强度强,可在流式细胞仪的FL-1通道检测。PI是一种核酸染料,它不能通过活细胞膜,却能穿过破损的细胞膜而对核染色在合适波长激发光的激发下发出明亮的红色荧光,可在流式细胞仪的FL-2通道检测。CFSE/PI双色荧光染料标记,能同时对活细胞和死细胞染色,可有效区分靶细胞和效应细胞以及靶细胞的自发凋亡和死亡[13]。
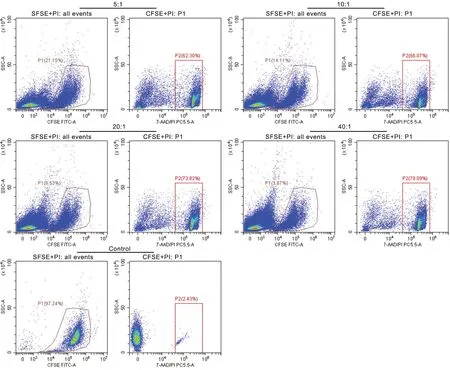
图4 CFSE/PI法流式细胞术检不同效靶比时NK细胞对K562细胞的细胞毒作用Fig. 4 Flow cytometric analysis (CFSE/PI) for cytotoxicity of NK cells to K562 cells at different E/T ratios

表1 两种方法检测NK细胞在不同效靶比下对靶细胞的细胞毒作用Tab.1 Cytotoxicity of NK cells against target cells at different E/T ratios detected by the two different detection methods
本文比较了LDH释放法及流式细胞术CFSE/PI双色荧光标记法在不同效靶比的细胞毒实验结果,并探讨了LDH法和流式细胞术的最佳实验条件。结果表明,LDH法加入显色试剂后随反应时间的增加其OD值逐渐增加,30min 以后OD值已不在检测范围内,最佳检测时间为加入反应试剂后25~30min,时间要严格控制,否则结果误差很大。在实验中发现随着效靶比的增加,其结果变异越大,当效靶比为20:1和40:1时,开始出现OD值超出范围的情况,分析认为当效靶比越高的时候,效应细胞贡献越多的LDH,使结果产生较大误差[14]。可见,LDH 法虽是常用测定细胞毒活性的简便方法,具有经济、快速且需要样本量少等优点,但该方法易受温度、培养液和反应时间等因素的影响而导致结果重复性差。流式细胞术相对耗时较长,操作较繁琐,优点是可以明确区分效应细胞和靶细胞及凋亡和死亡细胞,是一种灵敏、特异 、经济和稳定的检测 NK 细胞毒性的方法。综合比较这两种方法体外检测免疫细胞对肿瘤细胞毒活性实验,在较高的效靶比和较强的细胞毒作用下(10:1、20:1、40:1),两种方法对靶细胞死亡率检出的差异不具有统计学意义;但在效靶比弱细胞毒情况下(5:1),流式细胞术检测靶细胞死亡率要高于LDH法,具有重复性好、灵敏度高等特点。
综上所述,在体外评估NK细胞的杀伤功能实验中,考虑到所需要的样本细胞数量、细胞团的聚集程度以及显色反应的准确度,最优的效靶细胞比为10:1。在效靶比为10:1时,LDH释放法及CFSE/PI双染色法均可用来检测NK细胞杀伤活性,在其他效靶比情况下,流式细胞术要优于LDH释放法。
