胰腺实性-假乳头状瘤临床诊治分析
2010-09-14钟鹏峰曹杰刘振邦梁立源杨建荣
钟鹏峰 曹杰 刘振邦 梁立源 杨建荣
胰腺实性-假乳头状瘤(solid-pseudopapillary tumor of the pancreas,SPTP)是一种罕见的肿瘤,来源于胰腺,并具有恶性潜能的肿瘤,好发于年轻女性[1]。胰腺实性-假乳头状瘤是Franz于1959年首先报道[2]。目面前WHO将SPTP大多归为交界性或具有一定恶性潜能的肿瘤[1],并于1996年命名为胰腺实性-假乳头状瘤;由于患者临床表现缺乏特异性,因此术前诊断常出现误诊或诊断不明。近年来越来越多病例报道,并对这疾病的认识也逐渐深入。本文总结广州市第一人民医院近6年来收治的11例SPTP临床资料,并对SPTP的诊治进行分析。
1 临床资料
1.1 一般资料 病例来自于广州市第一人民医院2004年8月至2010年5月术后病理确诊为胰腺实性-假乳头状瘤的患者资料,患者全部为女性,平均年龄26.7岁(14~37岁),其中4例年龄<20岁。肿瘤位于胰头1例,胰体为2例,8例位于胰尾部。
1.2 临床表现 所有患者具有临床症状或体征而就诊;临床表现主要有一下表现:腹部包块、腹部隐痛、恶心、腹胀等,但无黄疸、发热等不适;其中6例(54.54%)出现明显腹部隐痛、恶心、腹胀等症状;余下7例表现为腹部包块(其中2例临床症状明显)。11例患者均无胆石症、胰腺炎、内分泌性疾病、腹部外伤及手术史等。
1.3 辅助检查 所有患者入院后查血糖、血电解质、三大常规、肝肾功能、血气分析等基本在正常范围内,1例患者血钙1.9 mmol/L,该患者肌肉抽搐等无低血钙表现,8例患者术前血清 CEA、AFP、CA199、CA125、CA724 等肿瘤标记物检查位于正常值范围内,其中1例CEA为6.12ng/ml(正常为0~5ng/ml),而2例CA199稍高,分别为51.23U/ml和56.00 U/ml(正常值:0~40 U/ml)。
11例患者均行B超或CT提示左上腹部有包块;B超及CT检查考虑诊断多为:胰腺囊肿、后腹膜肿瘤、内胚窦瘤、畸胎瘤。其中3例行MR检查,均无明确诊断。2例病例行CT检查考虑畸胎瘤,肿瘤较大,直径约15 cm,病程较长(12月与18月),体查肿瘤位于左侧腹部,其中1例影像学检查肿瘤内有钙化,并未见左侧卵巢,另1例CT提示肿物与左侧卵巢分界不清。目前公认为SPTP大多为包膜完整、体积较大的肿瘤,包膜内可有钙化、出血坏死等。本文病例中B超多为肿瘤边界尚清,边缘整齐,可呈圆形或椭圆形,内部回声结构紊乱呈实性为主的混合性回声等,可压迫周围组织器官,并与部分组织器官分界不清。本文病例CT多为肿瘤包膜完整,肿瘤内部密度不均匀,有时有钙化,均与胰腺分界不清,而胆道、胰管未见明显扩张。术前B超、CT及MR等影像学检查均未提示肝脏、肺等远处转移,均未见淋巴结肿大。
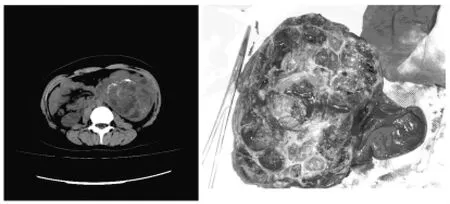
图1 广州市第一人民医院SPTP CT及术后标本图片
1.4 病理结果 有2例患者术前行穿刺病理活检,其中1例B超介导下穿刺,另1例则CT定位穿刺病理活检检查,该2例病例病理可见肿瘤细胞,形态一致呈多角状,排列成实性或假乳头结构,间质伴不同程度的纤维化。术前诊断为胰腺假乳头状瘤,且两例患者均为2009年入院治疗,均为病理科主任阅片诊断。术后病理均支持SPTP诊断,术后病理大多可见肿瘤细胞大小、形态较一致,可见多角细胞围绕纤细的血管轴心排列,类似“室管膜样”菊花团影。11例诊断提示为:胰腺实性-假乳头状瘤(恶性潜能未定)。所有病例病理组化均一样:CD10、PR、NSE、Vimentin 均强阳性;CK、SYN、Chr-A、S-100、Ki-67均为阴性。手术切除的组织为十二指肠、部分胰腺、脾、大网膜等组织,病理均未见肿瘤侵犯上述组织,均未见淋巴转移。
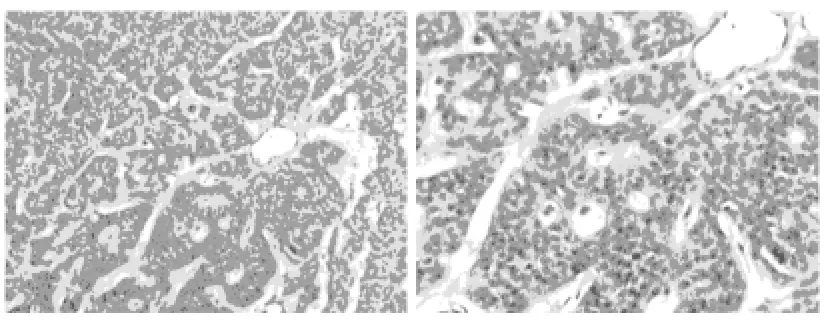
图2 广州市第一人民医院SPTP病理图片10×10
2 诊断
胰腺胰腺实性-假乳头状瘤(SPTP)临床表现缺乏特异性,多以腹部包块、腹部隐痛、恶心、腹胀等消化道症状就诊,SPTP恶性程度暂未定,邻近器官侵犯少见,上述消化道等症状多为肿瘤压迫临近器官组织有关。腹部体查时,多扪及腹部包块,局部轻压痛,多无腹膜炎体征。实验室检查暂未发现特异性指标,三大常规、肝肾功能、血电解质、血糖等大致正常,肿瘤标记物检查未见明显升高。影像学检查可提供一定参考价值,如影像学可见腹部包块,大小不一,密度不均,肿瘤可见囊性与实性混合性结构,有时可有钙化、出血坏死等;肿瘤边界尚清,边缘尚整齐,但与胰腺分界不清。无论肿瘤部位以及大小,CT等检查均不伴有胆道和胰管明显扩张[3]。术前两例患者为2009年新收治患者,并行肿瘤穿刺活检,术前病理诊断明确。本文病例中术后大体标本大多可见肿瘤包膜尚完整,边界尚清,肿瘤为圆形或椭圆形,内部可见出血坏死,肿瘤多为囊性与实性混合型结构,有时可见钙化;术后病理检查,显微镜下可见肿瘤细胞大小、形态基本一致,可见实性或假乳头,肿瘤细胞异型性及核分裂现象少见。免疫组化均见Vimentin呈弥漫包膜强阳性,并见PR呈胞核弥漫阳性,及CD56胞浆或包膜弥漫阳性,而βcatenin则为胞浆/胞核表达,包膜表达减少或消失,80%E-cadherin为阴性[4]。广州市第一人民医院所收治病例病理组化均为:CD10、PR、NSE、Vimentin均强阳性。因此术前病理检查可提高提高SPTP诊断的准确率。
3 治疗
3.1 治疗情况 所有患者均接受手术切除治疗,手术过程中均未见腹腔、肝脏等转移。位于胰头部的1病例行胰十二指肠切除术,位于胰体2例和位于胰尾的4例均行肿瘤局部切除术,位于胰尾的3例行肿瘤切除术+胰尾切除术,位于胰尾的1例与脾门粘连紧密,行肿瘤切除+胰尾切除+脾切除术,该例病例术中曾输血治疗,余病例无输血。术后切除的肿瘤直径约6~13 cm,平均直径约8.6 cm,术后病理明确诊断。术后10例患者未行放化疗治疗,1例患者行FAM方案化疗治疗(5-FU 600 mg/m2静脉滴注 第 1,8,29,36天;ADM 30 mg/m2,静脉推注 第1,29天;MMC 10 mg/m2静脉滴注 第1天),患者只进行一次化疗,化疗中患者出现恶心、呕吐等化疗反应,予以对症治疗后好转。术后定期回院复诊,均未见肿瘤复发等征象。
3.2 术后情况 术后无患者发生胰瘘、腹腔感染等并发症;行胰十二指肠切除的患者术后出现应激性溃疡出血及伤口感染,经保守治疗后治愈,未输血治疗。行肿瘤切除+胰尾切除+脾切除术的患者术后出现血小板逐渐升高,最高血小板值为721×109/L,复查B超提示脾窝积血,并予以氯吡格雷 75 mg,1次/d口服治疗,并治愈出院。余患者术后恢复良好,治愈出院。
4 预后及随访
术后11例患者定期门诊或住院复查腹部B超或CT,肝肾功能,三大常规,CEA、CA199、CA125等肿瘤指标,B超或CT均未见肿瘤复发,各种血指标未见明显异常,肿瘤指标位于正常值范围内。患者术后预后良好,无长期消瘦、高血糖、胃纳差、腹胀、厌油腻等症状,一般情况良好。随访时间(包括复查时间):7月~5年,未见肿瘤以及生活质量改变。
5 讨论
WHO在2000年将其列为胰腺外分泌源性的肿瘤。目前有学者认为SPTP既有胰腺外分泌又有内分泌及少许上皮表达的多向分化潜能,且有免疫组化不同表达的肿瘤细胞在形态学上无差别,提示该肿瘤细胞不同于任何一种胰腺起源的细胞。其超微结构的多样,也从另一方面支持该肿瘤细胞具有多向分化潜能的推测。SPTP好发于青年女性,临床上少见的肿瘤,来源于胰腺,SPTP多见于胰体和胰尾,但胰头及胰颈均有报道。该肿瘤最早由Franz发现,曾命名为Franz肿瘤,在1996年WHO命名为胰腺实性假乳头状瘤。近来来国内病例报道越来越多,也加深对SPTP的认识。
SPTP生长较缓慢,预后良好,本文所报道11例中,1例发病约2月,3例发病时间为4~6月,5例9~15月,2例为16月和18月。临床上较特殊症状为腹部包块,约占63.64%(7/11)。APTP无临床表现无特异性,临床症状通常与肿瘤大小有关[5]。较大的肿瘤可压迫周围组织器官导致相应的临床症状,并体查时可扪及腹部包块。目前大多数研究报道认为,SPTP起源于多潜能的胰腺干细胞,具有多向分化的能力,且具潜在恶性倾向,因此属于低度恶性肿瘤[6-7]。曾有学者认为SPTP起源于胚胎早期胰腺的生殖嵴-卵巢原基相关细胞[8],所以肿瘤好发于女性。Wendell等[9]研究显示几乎所有的SPTP存在β-catenin基因的突变,且β-catenin基因蛋白在Wnt信号转导通路的下游基因转录中起催化作用,而且大部分肿瘤细胞β-catenin着色异常,胞膜着色减少或消失。但在肿瘤来源及其发病机制仍存在争论。有报道认为SPTP具有恶性潜能的良性肿瘤或低度恶性肿瘤,对放化疗均不敏感[10],因此手术切除肿瘤为主要治疗方式。
根据相关文献报道及广州市第一人民医院收治的病例来看,该肿瘤生物学特性良好,肿瘤包膜完整,少侵犯周围器官组织,本文11例病例中未见肿瘤明显侵犯周围组织器官,术中均未见淋巴等转移,手术治疗疗效好。术后定期复诊资料提示患者术后恢复好,生活质量未受影响,到目前为止无死亡病例。术后患者并发症也少,但若行治疗SPTP时,需注意术后可能出现胰瘘、胆瘘、消化道出血等严重并发症,因SPTP恶性程度低,文献报道肿瘤转移复发少等,所以在根治性手术切除的前提下,尽量保留尽可能多的周围组织器官。也有报道SPTP出现胰外转移[11]。因此患者术后需定期回院复诊,不能忽视肿瘤复发及转移可能。
SPTP在临床表现及实验室检查上缺乏特异性,且与胰腺囊腺瘤或癌等肿瘤术前难以明确诊断,若出现腹部包块的女性患者,影像学检查提示与胰腺有关等,应想到本病的可能,术前必要时行穿刺病理活检。
手术是目前公认可的治疗方式,术后患者生存期较长,生活质量未受影响,肿瘤复发率低,因此,SPTP的治疗关键为早期发现、及时手术和定期随诊。但目前大多学者认为SPTP恶性潜能未定或低恶性,在组织学来源上也仍存在争议,而且分子发病机制尚不清楚,因此,仍需在SPTP上更需深入研究。
[1]Hamilton SR,Aaltonen LA.Pathology and genetics tumors of the digestive system.Lyon:IARC Press,2000:246-248.
[2]Pettinato G,Di zio D,Manivel JC,et al.Solid pseudopapillary tumor of the pancreas:a neoplasm with distinct and highly characteristic cytological features.Diagn cytopathol,2002,27(6):325-334.
[3]李萍,王淑红,石岩,等.胰腺实性-假乳头状瘤的CT诊断.医学影像学杂志,2006,16(8):814-816.
[4]冯沿芬,饶慧兰,吴秋良,等.胰腺实性-假乳头状瘤的临床病理及免疫组化分析.中山大学学报(医学科学版),2009,02(02):05.
[5]Kato T,Egawa N,Kamisura T,et al.A case of Solid-pseudopapillary neoplasm of the pancreas and tumor doubling time.Pancreatology,2002,2(5):495-498.
[6]宋金钧,周晓军,陆珍凤.胰腺实性-假乳头状瘤临床病理特征. 医学研究生学报,2007,20(8):827-829.
[7]Thambugala GM,Pereira J,Sugo E,et al.Solid and Cystic Papillary Epithelial Neoplasm of the Pancreas in an 11 Year old Girl:Imaging Features with Pathological Correlation.Australas Radiol,2006,50(4):373-376.
[8]Kosmahl M,Seada LS,Jnig U,et al.Solid pseudopapillary tumor of the pancreas:Its origin revised.Virchows Arch,2000,436(5):473-480.
[9]Wendell WT,Arwen AS,Samuel French,et al.Loss of cell-adhesion molecule complexes in Solid pseudopapillary tumor of pancreas.Modern Pathology,2007,20:509-513.
[10]Nagri S,Abdu A,Anand S,et al.Liver Metastasis Four Years after Whipple’s Resection for pseudopapillary tumor of the pancreas.J Pancreas(Online),2007,8(2):223-227.
[11]陈天宇,孙家邦.胰腺实性假乳头状瘤8例临床分析.哈尔滨医科大学学报,2006,40(2):156-158.
