大负荷运动对大鼠心肌细胞膜钠钾泵、钙泵与肌浆网钙泵活性的影响
2010-09-14许思毛刘涛波苏全生
许思毛,刘涛波,苏全生
大负荷运动对大鼠心肌细胞膜钠钾泵、钙泵与肌浆网钙泵活性的影响
许思毛1,刘涛波2,苏全生3
目的:探讨大负荷跑台运动对心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase与肌浆网Ca2+-ATPase活性的影响及其与超微结构变化的关系。方法:成年雄性SD大鼠24只,随机分为空白对照组(A组)、运动后即刻组(B组)与运动后24 h组(C组)。定磷法测定各组大鼠心室肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性与肌浆网Ca2+-ATPase活性;电镜观察各组大鼠左室前壁心肌细胞超微结构变化。结果:B组心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性显著低于其他两组,C组肌浆网Ca2+-ATPase活性显著低于其他两组;B组线粒体结构明显损伤,C组肌原纤维结构明显损伤、肌细胞及肌浆网肿胀。结论:大负荷运动引起大鼠心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase与肌浆网Ca2+-ATPase活性降低及心肌超微结构异常,但变化不完全同步;细胞膜Na+-K+-ATPase、Ca2+-ATPas活性下降可能与线粒体大面积损伤有关。
大负荷运动;Na+-K+-ATPase;Ca2+-ATPase;损伤;鼠;动物实验
1 前言
Na+-K+-ATPase(钠钾泵)、Ca2+-ATPase(钙泵)广泛存在于机体细胞膜及细胞器膜上。正常生理情况下,细胞膜Na+-K+-ATPase对于维持细胞内、外的离子梯度、膜电位稳定及细胞内外渗透压平衡、细胞体积等有重要作用;细胞膜与肌浆网上的Ca2+-ATPase主要作用是维持细胞内、外Ca2+平衡。在心肌缺血再灌注过程中,心肌细胞膜Na+-K+-ATPase活性降低引起细胞内外离子交换紊乱,主要与细胞外高K+、胞浆内高Na+、Ca2+变化密切相关;细胞膜Ca2+-ATPase或肌浆网Ca2+-ATPase活性下降,使胞浆内Ca2++泵出细胞外或泵入肌浆网内减少,促使胞浆内Ca2+浓度升高。
剧烈运动可引起运动员心肌疲劳,心功能降低,心率及心电图波形发生严重可逆性异常变化。本实验同步观察剧烈运动后心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase与肌浆网Ca2+-ATPase活性及超微结构的变化,旨在为探讨运动性心肌疲劳提供部分理论依据。
2 研究对象与方法
2.1 研究对象
成年雄性SD大鼠24只,体重205±13 g,由四川大学华西医学院实验动物中心提供。大鼠自购回后在标准啮齿目动物饲养笼内分笼喂养,自由摄食饮水。保证通风条件良好,室温控制在27℃~28℃,相对湿度40%~60%,自然光照。
2.2 研究方法
2.2.1 动物分组与运动方式
将24只大鼠随机分为A组(空白对照组,简称对照组,n=8)、B组(运动后即刻组,简称即刻组,n=8)与C组(运动后24 h组,简称24 h组,n=8)。A组不进行运动训练;B组与C组进行一次性大负荷跑台运动,跑台为天津产6跑道小动物跑台。依据Bedford制定的运动强度标准,规定大鼠以坡度为+10°、速度为19~21 m/min的强度进行大负荷跑台运动,直至大鼠出现趴伏喘息,暂时对声、电、机械刺激均无逃避反应,即终止运动。
2.2.2 测试样品的制备
各组大鼠同一天用戊巴比妥钠进行腹腔麻醉处死取心脏,其中,B组与C组分别在运动后即刻、运动后24 h进行。每组随机取6只,取心室肌,用PBS充分洗尽残留血液,横切为前、后两部分,前部分(约300 mg)用于制备细胞膜,后部分(约200 mg)用于制备肌浆网。每组另2只取心脏左室前壁肌,用3%戊二醛固定,用于透射电镜切片的制备。
心室肌细胞膜制备:按照南京建成生物有限公司的方法分级离心(10 000 rpm,20 min)制备。取心室前壁肌,去掉心内、外膜后称重,加入9倍的试剂Ⅰ(蔗糖0.1 M, EDTA 2 mM,咪唑1 mM,p H7.4)用内切式匀浆机在冰浴中剪碎匀浆,制成10%匀浆滤液,两层纱布过滤后,离心取沉淀加入到5 m l试剂Ⅰ中,离心2次取沉淀加入到10 ml试剂Ⅱ[尿素1.3 M,咪唑12 mM,EDTA 2 mM,MgCl2· 6H2O 0.1mM,(NH4)2SO47.6mM,p H7.4]中混匀,0℃放置48 h后,离心取沉淀加入到试剂Ⅲ(咪唑25 mM,组氨基酸125 mM,EDTA 13μM,p H6.8)中,离心2次取沉淀即心肌细胞膜悬于约10 ml试剂Ⅳ(咪唑25 mM,组氨基酸50 mM,EDTA 0.3μM,p H 6.8)中,置0℃中保存,48 h内测ATP酶活性。
心室肌肌浆网制备:取心室肌,称重,放入9 ml预冷的组织匀浆介质(50 mmol/L Na2HPO4;10 mol/L Na2EDTA; 25 mmol/L NaF.PH 7.4)中剪碎,用内切式匀浆机制成10%组织匀浆,匀浆时间10 s/次,间歇30 s连续3次,在冰浴中进行。将匀浆滤液以14 000×g离心20 min 2次后,取上清再以45 000×g离心60 min,取沉淀用预冷的贮存液(30 mmol/L组氨酸;0.25 mmol/L s蔗糖;10 mmol/L EDTA;10 mmol/L NaF.PH7.4)重悬,所得即为提取的心肌细胞肌浆网,-80℃存放[6]。
2.2.3 指标检测方法
心肌细胞膜Na+-K+-ATPase与Ca2+-ATPase活性、肌浆网Ca2+-ATPase活性均采用定磷法测定,双缩脲法测定总蛋白含量,所用试剂均由中国南京建成生物有限公司提供。心肌细胞超微结构采用日立H-600 IV型透射电镜(日本)观察拍照。
2.2.4 统计学分析
3 研究结果
3.1 大鼠的运动持续时间
如表1所示,B组、C组大鼠以设定的运动强度进行跑台运动,至最后不能再坚持运动时,共持续了151±11 min、153±10 min。两组大鼠运动持续时间不具显著差异。
3.2 各组大鼠心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性的比较
表2显示,与对照组(A组)相比,即刻组(B组)大鼠心肌细胞膜Na+-K+-ATPase活性明显下降,两者具有非常显著性差异;Ca2+-ATPase活性也明显下降,两者具有非常显著性差异。24 h组(C组)大鼠心肌细胞膜Na+-K+-ATPase活性基本恢复至正常,与A组相比,两者无明显差异。C组大鼠心肌细胞膜Ca2+-ATPase活性明显低于A组,两者具有非常显著性差异;但与B组相比,活性明显升高,两者具有显著性差异。
表1 本研究两组大鼠运动持续时间一览表Table 1 The exercise duration of Subjects±S)

表1 本研究两组大鼠运动持续时间一览表Table 1 The exercise duration of Subjects±S)
n 运动持续时间(min) B组8 151±11 C组8 153±10
3.3 各组大鼠心肌肌浆网Ca2+-ATPase活性的比较
表3显示,与A组相比,B组大鼠心肌肌浆网Ca2+-ATPase活性稍有下降,两者不具显著性差异。C组大鼠心肌肌浆网Ca2+-ATPase活性明显低于A组,两者具有非常显著性差异;且C组明显低于B组,两者具有显著性差异。
表2 本研究各组大鼠心肌细胞膜指标比较一览表Table 2 The comparison of M yocardial Plasmalemmal Norm in Each Group (±S,umolPi/mgp rot/h)

表2 本研究各组大鼠心肌细胞膜指标比较一览表Table 2 The comparison of M yocardial Plasmalemmal Norm in Each Group (±S,umolPi/mgp rot/h)
注:与A组相比,▲▲P<0.01;与B组相比,★P<0.05,★★P<0. 01。下同。
表3 本研究各组大鼠心室肌肌浆网Ca2+-ATPase活性比较一览表Table 3 The comparison of Myocardial Sarcoplasm ic Reticulum activity Ca2+-ATPase in Each Group (±S,umolPi/mgp rot/h)

表3 本研究各组大鼠心室肌肌浆网Ca2+-ATPase活性比较一览表Table 3 The comparison of Myocardial Sarcoplasm ic Reticulum activity Ca2+-ATPase in Each Group (±S,umolPi/mgp rot/h)
n Ca2+-A TPase活性A组6 0.123±0.019 B组6 0.116±0.026 C组6 0.063±0.004▲▲★
3.4 各组大鼠各组大鼠心肌细胞透射电镜观察结果
对照组(A组):超微结构均正常(图1);即刻组(B组):线粒体肿胀,嵴断裂或消失,出现空泡变性,且由于线粒体肿胀挤压到肌原纤维(图2);24 h组(C组):肌细胞肿胀,肌浆网肿胀;肌原纤维Z线、M线模糊不清,出现溶解消失现象;线粒体结构基本正常,轻微肿胀(图3)。
4 讨论
4.1 运动后即刻组大鼠心肌细胞膜钠钾泵、钙泵与肌浆网钙泵活性的变化
本实验中,依据Bedford等[7]制定的标准进行推算,体重205±13 g的SD大鼠,在坡度为+10°、速度为19~21 m/min的情况下进行跑台运动,运动强度约为80%O2max强度。B组与C组大鼠以这种强度进行运动直至出现趴伏、喘息以及暂时对声、电、机械刺激无逃避反应,运动时间分别共持续了151±11 min、153±10 min。综合本实验中大鼠的运动强度和运动时间,表明大鼠完成了大负荷运动。
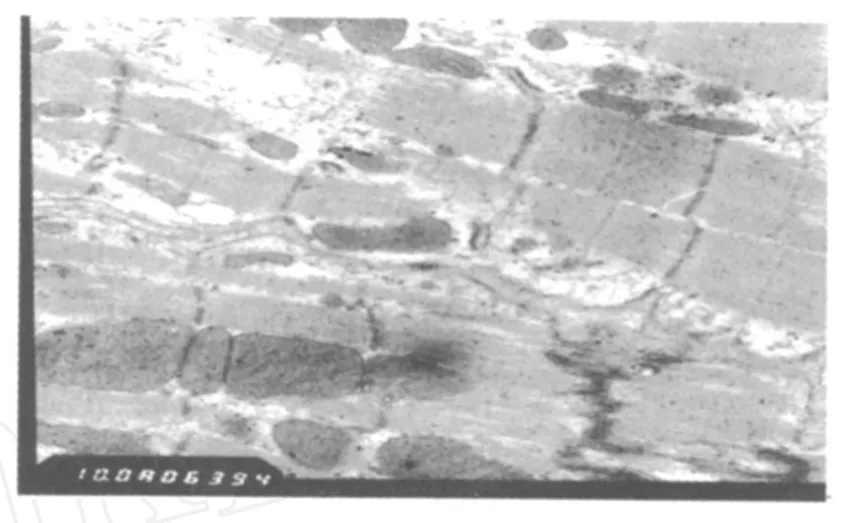
图1 本研究A组大鼠心肌细胞超微结构电镜图(×10 000)Fig.1 Myocardial Cell Ultrastructure of group A(×10 000)

图2 本研究B组大鼠心肌细胞超微结构电镜图(×10 000)Fig.2 Myocardial Cell Ultrastructure of Group B(×10 000)

图3 C组大鼠心肌细胞超微结构电镜图(×10 000)Fig.3 Myocardial Cell Ultrastructure of Group C(×10 000)
研究表明,机体运动时首先由于运动强度大,体内代谢需求增加会引起心脏相对缺血缺氧[5]。如果达到运动负荷量的话,会引起心肌一系列结构和功能的变化,且这种变化与临床上缺血再灌注损伤相似。苏全生[6]认为,运动引起机体各器官系统缺血,是在机体保护性抑制系统的监控下发生的一个主动缺氧过程,当无法忍受缺氧刺激时,机体将通过降低运动强度或完全停止运动来减少缺血程度,从而避免因过度缺血缺氧导致结构功能的不可逆改变。心肌供血供氧的不足,将使线粒体氧化磷酸化减弱, ATP生成减少。本实验中观察到,运动后即刻心肌细胞线粒体结构明显损伤,线粒体结构损伤将造成ATP合成障碍。张尧夭等[9]研究也表明,剧烈运动后即刻心细细胞线粒体结构损伤明显,ATP合成能力明显下降。尽管剧烈运动时心肌大量动用无氧供能,但产ATP效率低,另外,无氧代谢的增强使细胞内H+大量堆积,细胞内发生酸中毒,从而抑制了糖酵解过程中的限速酶一磷酸果糖激酶(PFK),使糖酵解途径受抑制,ATP生成不足更加明显[11]。研究表明,心肌在缺血缺氧过程中,心肌细胞ATP含量急剧下降[17,18]。陈嵘[3]研究显示,小鼠在大负荷运动后即刻心肌ATP含量明显下降。ATP缺乏将使得依赖ATP的酶活性下降。
本实验中,运动后即刻细胞膜Na+-K+-ATPase、Ca2+-ATPase活性显著下降,但肌浆网Ca2+-ATPase活性却无明显下降。笔者认为,剧烈运动造成机体内环境紊乱,而细胞膜直接与细胞外液接触,从而受损,酶活性降低。另外,可能细胞膜对缺血很敏感,而肌浆网不甚敏感。缺血造成细胞膜结构出现损伤、破裂[1],进而可能引起细胞膜上的酶结构失常。由于结构异常、ATP的缺乏,细胞膜Na+-K+-ATPase、Ca2+-ATPase活性表现出明显低下,而肌浆网由于结构相对正常,对ATP的利用能力未受明显影响;虽然缺血缺氧使心肌细胞内总ATP量明显不足,但由于细胞膜等其他结构受损耗能减少,肌浆网ATP酶所分配ATP的比例增加。上述缘由,最终肌浆网Ca2+-ATPase活性无明显下降。
4.2 运动后24 h组大鼠心肌细胞膜钠钾泵、钙泵与肌浆网钙泵活性的变化
当运动停止后,心肌的相对缺氧开始恢复,心肌ATP含量有所恢复。但临床上的研究表明,在心肌复灌后最初一段时间内,心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase或肌浆网Ca2+-ATPase功能却进一步下降。郭志凌等[4]研究表明,心肌在缺血90 min后再灌注60 min时,心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性较缺血150 min更为严重。陈龙等[2]发现,心肌缺血60 min后再灌注60 min时,猫心肌细胞膜Ca2+-ATPase活性及肌浆网摄钙能力较缺血期进一步下降。研究证实,在心肌复灌后一段时间内,氧自由基大量产生。心肌在复灌后生物膜ATP酶活性下降可能与氧自由基大量生成有关。氧自由基使与膜结合的酶的巯基氧化,导致酶活性下降[1]。氧自由基可引起蛋白质的交联、聚合和肽链的断裂,也可使蛋白质与脂质结合形成聚合物,从而使蛋白质功能丧失,ATP酶活性下降[1,16]。
其实,氧自由基的生成和钙超载是同一病理生理过程中的两种不同现象,且互为因果关系。研究表明,心肌在运动后恢复供血的一段时间内,也会产生大量氧自由基[8,11];心肌细胞内Ca2+浓度升高且持续加重[7,8]。那么,心肌细胞内氧自由基水平、Ca2+浓度何时开始恢复呢?张尧天等[9]的实验结果表明,大鼠力竭性运动后24 h时,心肌ATP合成能力以及MDA含量基本恢复正常。张钧等[12]的实验结果表明,力竭运动后24 h时,大鼠心肌线粒体脂质过氧化水平、抗氧化能力、游离钙浓度、磷脂酶A 2活性基本恢复正常。本实验在运动后24 h时也观察到线粒体结构基本恢复正常,也提示可能此时心肌氧自由基、钙超载损伤基本恢复。
本实验结果显示,较对照组、即刻组来说,运动后24 h组肌浆网Ca2+-ATPase活性明显低下,肌原纤维异常及肌细胞肌浆网肿胀,表明在运动后恢复过程中心肌细胞结构功能遭受了明显损伤。本实验中,运动后24 h时细胞膜Na+-K+-ATPase活性基本恢复正常,Ca2+-ATPase活性也较即刻组明显升高。笔者认为,在运动后24 h时,运动性缺氧复氧造成的心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase功能障碍,伴随着心肌氧自由基、Ca2+浓度水平及线粒体ATP合成能力的恢复而恢复正常(或明显恢复)。为何肌浆网Ca2+-ATPase功能及肌原纤维等结构何恢复延迟?其机理尚不清楚。
5 结论
1.大负荷跑台运动引起大鼠心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase与肌浆网Ca2+-ATPase活性下降;但肌浆网Ca2+-ATPase活性下降主要发生在运动后恢复期,其恢复也晚于细胞膜Na+-K+-ATPase活性的恢复。
2.大负荷跑台运动引心肌线粒体、肌原纤维结构损伤及肌细胞、肌浆网肿胀;但肌原纤维结构损伤及肌细胞、肌浆网肿胀主要发生在运动后恢复期,其恢复也晚于较线粒结构的恢复。
3.运动后即刻时心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性明显下降,线粒体大面积损伤;运动后24 h时细胞膜Na+-K+-ATPase基本恢复正常、Ca2+-ATPase活性有明显恢复,线粒体结构基本恢复正常,提示细胞膜Na+-K+-ATPase、Ca2+-ATPase活性下降可能与线粒体损伤有关。
[1]陈国强,冉丕鑫.基础病理生理学[M].上海:上海科学技术出版社,2009:212-301.
[2]陈龙,胡寿鹏,张荣起,等.猫心肌缺血再灌注对Ca2+-A TPase活力及肌浆网钙摄取能力的影响[J].第二军医大学学报,1998, 19(4):347-349.
[3]陈嵘.丹参对小鼠运动负荷后心肌A TP含量的影响[J].北京体育大学学报,2000,23(4):488-489.
[4]郭志凌,赵华月,郑信华.局限缺血-再灌注心肌细胞内钙超负荷发生机制的探讨[J].同济医科大学学报,1995,17(3):198-201.
[5]彭峰林,谢小龙,邓树勋.运动抗心肌缺血再灌注损伤的预处理作用和机制[J].体育科学,2006,26(5):64-68.
[6]苏全生.运动后复氧对心脏结构功能的影响[J].成都体育学院学报,2004,30(3):61-64.
[7]苏全生,李岩,步斌,等.超速驱动对离体大鼠心脏的影响及Mg2 +的保护作用[J].中国运动医学杂志,2001,20(4):434-436.
[8]苏全生,郑兵,熊若虹,等.VC、VE和硒联合抗氧化剂对大鼠力竭游泳后心肌缺血再灌注损伤的保护[J].成都体育学院学报, 2005,31(6):34-37.
[9]张尧天,吕国枫.急性运动对小鼠心肌线粒体功能的影响[J].中国康复,2006,21(6):366-367.
[10]赵敬国,王福文.大鼠剧烈性游泳运动过程中心电图的动态观察[J].现代康复,2004,4(8):1194-1195.
[11]赵敬国,王福文.力竭性运动后不同时相大鼠心肌形态结构的改变观察[J].中国运动医学杂志,2001,20(3):316-317.
[12]张钧,邓蜀李.运动对大鼠心肌线粒体功能的影响[J].北京体育大学学报,2003,26(2):198-200.
[13]ALBRRT CM,M ITTLEMAN M A,CHAECU,et al.Triggering of sudden death from cardiac causesby vigorous rxertion [J].N Engl J Med,2000,34(3):1355-1461.
[14]BEADFORD T G,TIPTON C M,W ILSON N C.Maximum oxygen consump tion of rats and its changesw ith various experimental p rocedures[J].J App l Physiol,1979,47(6):1278-1283.
[15]JUN ICH IRO H,ALLAN K B,A TSUNORI K,et al.A ssessment of pulse rate variability by the method of pulse frequency demodulation[J].Biomed Eng Online,2005,21(4):62.
[16]Haiyun Ling,Yijia Lou.Total flavones from elshohzia blanda reduce infarct size during acute myocardial ischemia by Inhibiting myocardal apoptosis in rats[J].J Ethnopharmacol,2005, 101(1-3):169-175.
[17]LOPASCHU K G.Regulation of carbohydrate metabolism in rschemia and reperfusion[J].Am Heart J,2000,139(2):Sl15-119.
[18]LORENTZON M,RAMUNDDALl T,BOLLAANO E,et al.In Vivo effects of myocardial creatine depletion on left ventricular function,motphology,and energy metabolism-consequences in acute myoeardial infartion[J].J Card Fail,2007,13(3):230-237.
[19]MARINHO N V,KEOGH B E,COSTA D C,et al.Pathophysiology of chroic left ventricular dysfunction.New insights from themeasurementof absolutemyocardial blood flow and glucose utilization[J].Circulation,1996,93(4):737-744.
[20]M EL ISSA S F,LAURIEQ,JAMES H.RIMM ER,et al.Cardiovascular effects of strenuous exercise in adult recreational hockey:the hockey heart study[J].CMAJ,2002,166(3):303-307.
[21]PANDE M,CAM ERON J A,V IG P J,et al.Phencyclidine biock of Ca2+-A TPase in rat heart sarcoplasmic reticulum[J]. Toxicology,1998,129(2-3):95-102.
[22]ROBERT F.A thlete’s heart[J].Heart,2003,89(12):1455-1461.
Effects of Heavy Load Train ing on M yocardial Cellular Membrane Na+-K+-ATPase,
Ca2+-ATPase Activity and Sarcop-lasm ic
Rreticulum Ca2+-ATPase Activity in Rat
XU Si-mao1,L IU Tao-bo2,SU Quan-sheng3
The purpose of this study was to exp lore the effects on myocardial cellular membrane Na+-K+-ATPase,Ca2+-A TPase activity,and sarcoplasmic reticulum Ca2+-A TPase activity of rats after once high intensive exercise on treadmill,and exp lo re the relationship between that and myocardial ultrastructure.24 grow n male SD rats were divided into no rmal contrapositive group(group A),instantly after exercise group(group B)and 24 hour after exercise group (group C).The activity of ventricular myocardial cellular membrane Na+-K+-A TPase,Ca2+-A TPase and sarcop lasmic reticulum Ca2+-A TPase were determined using the method of phosphorus,the left ventricular antetheca cardiac muscle cell ultrastructure was observed under Transmission Electron M icroscope(TEM).The result showed that the myocardial cellular membrane Na+-K+-A TPase&Ca2+-A TPase activity of group B was significant lower than o ther two groups,the sarcop lasmic reticulum Ca2+-A TPase activity of group C was significant lower than other two groups.M yocardial mitochondrial significant damage of group B was observed under TEM,and myofibril significant damage,cell&sarcop lasmic reticulum swelling of group C.It concludes that heavy load training may induce m yocardial cellular membrane Na+-K+-A TPase,Ca2+-A TPase activity and sarcop lasmic reticulum Ca2+-A TPase activity decreasing,also induce ultrastructure to damage,but no comp letely in sync.It also hints that there might be some certain relationship between low ing of cellular membrane Na+-K+-A TPase, Ca2+-ATPase activity and the large area injury of mitochondrial.
heavyloadtraining;Na+-K+-ATPase;Ca2+-ATPase;damage;animalexperiment
G804.7
A
1000-677X(2010)12-0082-05
2010-10-09;
2010-11-18
四川省科技计划项目(2006J13-019)。
许思毛(1978-),男,安徽芜湖人,讲师,硕士,主要研究方向为运动生理学和体育保健学,Tel:(0773)5845941,E-mail:xusimao666@163.com。
1.广西师范大学体育学院,广西桂林541004;2.解放军军事体育进修学院,广东广州510502;3.成都体育学院,四川成都610041 1.Guangxi Normal University,Guilin 541004,China; 2.Military Physical Education College of PLA,Guangzhou 510502,China;3.Chengdu Sport University,Chengdu 610041,China.
