铁促进黄铜矿浸出的研究进展
2010-09-13王翠红张卫民
王翠红,张卫民
(东华理工大学土木与环境工程学院,江西抚州 344000)
铁促进黄铜矿浸出的研究进展
王翠红,张卫民
(东华理工大学土木与环境工程学院,江西抚州 344000)
综述了铁促进黄铜矿浸出机理及影响因素的研究状况,指出铁是一种有效的助浸剂,其作用效果与氧化还原电位、铁离子浓度、p H以及介质类型等因素有关。
黄铜矿;铁离子;浸出
黄铜矿是铜矿资源的主体矿物,也是铜矿开采最多的矿物。促进黄铜矿浸出一直是国内外多年来的一个重要热点课题。Naoki Hiroyoshi,et al.[1]的研究表明,添加助浸剂,如,Ag+离子、表面活性剂、铁粉、活性炭粉等,是一种提高浸出率和浸出速度的有效方式,但生产成本较高,难于在实践中推广。
通常认为,在硫酸溶液中,黄铜矿被 Fe3+和溶解氧溶解并释放出 Fe2+。当有氧化亚铁硫杆菌(thiobacillus f errooxidans)等铁氧化细菌存在时,Fe2+被迅速氧化成 Fe3+,Fe3+继续参与黄铜矿的溶解作用。在整个浸出过程中,Fe2+只起到提供Fe3+的作用。近年来,有研究表明:在酸性溶液中,高浓度的Fe2+的存在有助于溶解氧对黄铜矿的氧化浸出。尽管众说纷纭,但都支持铁可以提高黄铜矿浸出效率这一观点。黄铜矿的浸出受多种因素影响,本文介绍了国内外对铁促进黄铜矿浸出机理及影响因素的研究状况。
1 铁促进黄铜矿浸出的机理
根据Naoki Hiroyoshi,et al.[1-3]关于 Fe2+促进黄铜矿浸出模型的观点:在含有适度铜离子的溶浸液中,Fe2+能够加速铜的浸出。Fe2+能够将黄铜矿还原生成Cu2S,Cu2S具有更好的可溶性,比黄铜矿更容易被三价铁或氧气氧化。不同硫化铜矿物(黄铜矿和辉铜矿)在不同介质中有不同的电化学行为。在硫酸溶液中,黄铜矿的浸出取决于由Fe3+/Fe2+决定的氧化还原电位,当氧化还原电位比较低(低于某一临界电位)时,黄铜矿的浸出过程分2步进行:首先黄铜矿先被 Fe2+还原为中间产物辉铜矿(Cu2S)(反应(1)),然后辉铜矿被 Fe3+或 O2氧化释放出 Cu2+(反应(2)、(3)),辉铜矿的氧化速率比黄铜矿更快,因此当电位低于某临界电位时,铜的浸出更快;当氧化还原电位比较高(高于某一临界电位)时,黄铜矿直接被 Fe3+或O2氧化释放出 Cu2+,但 Cu2+从黄铜矿中浸出的速度很慢(反应(4)、(5))。
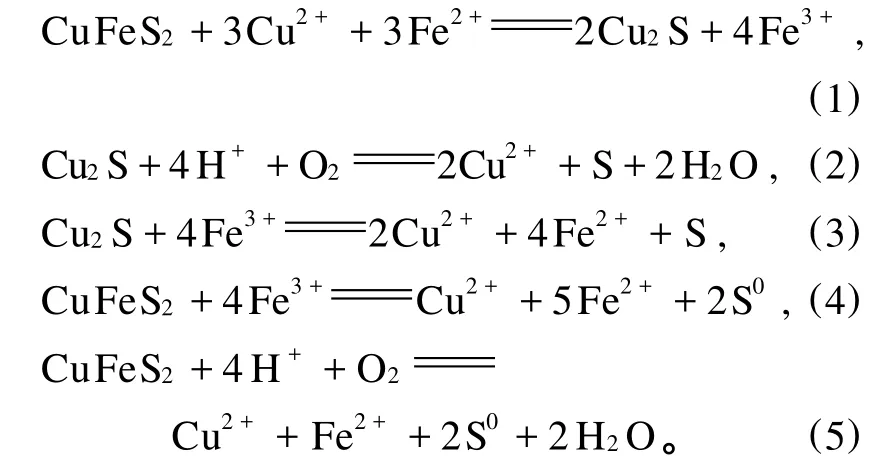
2 铁促进黄铜矿浸出的影响因素
2.1 氧化还原电位的影响
早在1910年,V.Gottschalk,et al.[4]研究发现,加入白铁矿、黄铁矿可以加速一些硫化矿物的氧化速度,氧化速度提高的原因是由于氧的存在,铁的硫化矿物被氧化形成铁盐和硫酸。M.J.Nicol,et al.[5]对 Fe、Cu、Pb在酸性环境中还原黄铜矿的原电池效应的研究结果表明:当加入 Fe、Cu、Pb等金属时,Cu2+的浸出率明显提高。黄铁矿和黄铜矿的电对效应可加速铜矿石的分解[6-7]。
硫化铜矿的浸出过程是电极腐蚀过程。在阳极,矿物中的低价金属离子被氧化为高价离子,或硫离子被氧化为元素硫或硫酸根;在阴极,氧化剂O2、Fe3+等接受电子被还原。伴随着电子的转移,有价金属离子从固相转移入浸出介质中,其反应式为:

具有半导体特性的天然硫化矿物在浸出介质中都有其相应的电极电位。一般情况下,浸出体系中含有多种金属硫化矿物,而各种硫化矿物的静电位不同。常见的硫化矿物的静电位由高到低的顺序为黄铁矿>黄铜矿>方铅矿>闪锌矿。在多组分混合硫化矿物体系中,电位不同的2种矿物相接触时形成原电池,静电位低的矿物被加速溶解,静电位高的矿物受到阴极保护而不溶[8-9]。如,将黄铁矿和黄铜矿的纯矿物粉混合时,在硫酸介质中,铜的溶解量比黄铜矿单独浸出时增大4.6倍,电化学反应在黄铜矿的加速溶解过程中起了作用,用电镜观察浸出的黄铜矿电极对时发现,由于电化学反应作用,与黄铁矿紧密接触的黄铜矿被加速腐蚀,而黄铁矿作为阴极受到保护。
张杰等[10]通过热力学分析认为:无氧条件下,含有一定浓度Fe3+的溶浸液将与黄铁矿发生下列反应:
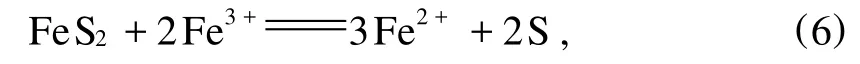
反应所需的溶液电位范围覆盖了Fe2+促进黄铜矿浸出的电位范围,从而可以肯定,在黄铁矿和黄铜矿共存的溶浸液环境中,反应(1)、(3)和(4)是能够同时进行的。他们的研究还表明:有黄铁矿存在时,黄铜矿的浸出速率明显大于无黄铁矿存在时的浸出速率,浸出的前12 d,两者Cu2+浓度最大时相差1 mmol/L左右;浸出30 d后,有黄铁矿存在的浸出体系中,铜的浸出率约为56%,而不加黄铁矿的浸出体系中,铜的浸出率为42%。同时,他们认为,黄铁矿的参与加速了 Fe3+与Fe2+浓度之比值的降低和电位降低,进而促进了黄铜矿的浸出。
2.2 铁离子浓度的影响
根据反应(4):随着溶液中Fe3+浓度的增大,浸出的铜增多。但有研究表明:当 Fe3+的浓度大于0.01 mol/L后对黄铜矿的浸出影响不明显[11]。Tomas Havlik,et al.[12]的研究结果表明,黄铜矿的浸出依赖于 Fe3+的浓度:当 Fe3+匮乏时,黄铜矿浸出动力学明显较慢;当 Fe3+浓度达到0.5 mol/L时,它可以为浸出反应的进行提供充足的Fe3+,从而使浸出反应不受外部扩散的限制;而当Fe3+浓度超过0.5 mol/L后,对浸出反应的进行影响不大。
Javier Vilcáez,et al.[13]的研究表明 :在 65℃、初始p H=1时,硫酸铁介质中加入200 mg/L Fe3+时,黄铜矿的最终浸出率明显提高。如,针对Atacama精矿和 Hanaoka矿石,不加 Fe3+时,浸出12 d,铜浸出率分别为92%和75%;而加入Fe3+后,浸出仅7 d,铜浸出率分别达到了100%和80%。为了证明过量 Fe3+的存在,即使在p H=1时对黄铜矿D浸出的负面影响,他们对Fe3+质量浓度分别为0.2,1.0,6.0和12.0 g/L的Hanaoka矿石进行了研究,结果表明:当 Fe3+质量浓度达到1.0 g/L时,铜浸出率明显增大;而当Fe3+浓度超过这个值时,浸出率明显下降。
张卫民等[14]认为:不仅Fe3+对黄铜矿的浸出起到催化作用,Fe2+同样也在一定条件下起催化作用。在活性炭、Ag+、Fe2+组合的浸矿体系中,随着初始Fe2+浓度的增加,铜浸出速度和浸出率不断增大。但当初始Fe2+浓度达到8.0 g/L以后,随初始Fe2+浓度的增加,铜浸出率增加不明显,浸出168 h后,铜浸出率为83%,比不加 Fe2+时提高了 32%;浸出 321 h后,浸出率达到93.5%,比不加 Fe2+时提高了22%。
张德诚等[15]研究了在低温(15℃)条件下,Fe2+起始浓度对细菌浸铜工艺的影响。Fe2+是氧化亚铁硫杆菌获得生命所需能量的主要物质之一,所以,选择适当的起始 Fe2+浓度是必须的。但Fe2+浓度过高会产生过多的Fe3+,以致形成过多的沉淀,影响浸出效果。研究表明:在整个浸出过程中,初始 Fe2+质量浓度为6 g/L时,铜浸出率始终大于其他3个水平(2 g/L,4 g/L,8 g/L),最终浸出率可达到65%以上,而其他3个水平的浸出率均未超过35%;在前30 d的浸出过程中,初始Fe2+质量浓度为6 g/L时,平均Fe2+质量浓度下降相对较快,铜浸出速率也相对较快,说明Fe2+初始质量浓度为6 g/L时可能会刺激细菌适应新的生存环境,加速铜的浸出速率。原因可能在于加入过多的Fe2+时,细菌会优先利用Fe2+而较少利用黄铜矿,而加入的 Fe2+过少时,则有可能影响到Fe2+的氧化耗酸和铁矾产酸过程。
Z.Sadowski,et al.[16]研究表明,在细菌浸出黄铜矿时,添加2 g/L的Fe2+可以增大黄铜矿的最初浸出速率,浸出48 h时,铜浸出率急剧增加到60%;此后,浸出速度减缓,在浸出312 h时,铜浸出率为86%;但当Fe2+质量浓度增大至9 g/L时,黄铜矿的浸出却明显受阻。
Naoki Hiroyoshi,et al.[3]研究表明:在氮气环境下,500 mL烧瓶中加入250 mL浸出液和25 g黄铜矿,水浴温度303 K,振幅40 mm,振动速度120次/min,不加 Fe2+和 Cu2+时,27 d后,黄铜矿的浸出率只有10%;而向含有Fe3+的溶液中只加入Fe2+时,铜浸出率在浸出初期时与不加Fe2+时的情况几乎一样,4 d之后,铜浸出率增大,27 d后,铜浸出率约为75%。
2.3 pH的影响
黄铜矿的浸出过程耗酸,因此,随着浸出反应的进行,体系p H增大。p H增大会使铁离子发生水解沉淀,使浸出反应发生钝化。浸出过程中,可以加入过量的硫酸来避免浸出反应的钝化(反应(7))。但是,黄铜矿细菌浸出过程中,由于大多数嗜热细菌无法适应p H低于1的环境,因此,虽然加入过量的硫酸可以阻止铁离子的水解沉淀(如黄钾铁矾的水解沉淀),但一般不这样做。J.E.Dutrizac,et al.[17]指出:酸的作用是控制 Fe3+的水解。溶液中的铁在一定p H范围内会生成铁矾,铁矾的生成对浸出极为不利,因此,选取合适的p H范围非常重要。
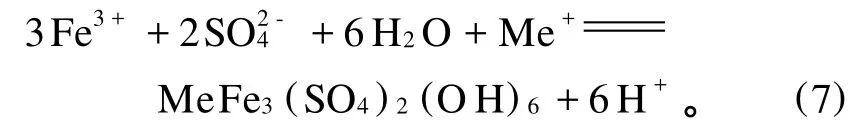
T omas Havllk,et al.[12]的研究表明:在70℃下,加入0.5 mol的 Fe3+,盐酸浓度分别为0.25,0.5,0.75,1 mol/L,对黄铜矿浸出动力学几乎没有影响。
Naoki Hiroyoshi,et al.[2]研究了初始p H=1.8、浸出168 h对铜浸出率的影响。结果表明:当加入硫酸亚铁溶液(0.04 mol/L)后,铜浸出率在很大程度上依赖于p H并随p H的降低而增大,铜最终浸出量为0.41×10-3mol/g矿石。
舒荣波等[18]研究了在30℃下、加入8 g/L Fe2+时,p H值对黄铜矿浸出效果的影响。试验结果表明:随p H从1.5降到1.0,铜浸出率增大。由于p H越低,H+浓度越高,H+与矿物表面接触发生反应的几率越大,也就越有利于黄铜矿的溶解,这一现象与反应式(5)吻合。
Javier Vilcáez,et al.[13]研究表明:在不加细菌和铁离子条件下,控制体系温度为65℃,出人意料的是,随pH从1.5降到1.0时,铜浸出量明显增加。
2.4 浸出介质的类型
J.D.Sullivan,et al.[19]研究表明:与硫酸铁相比,在黄铜矿浸出过程中,氯化铁是最好的介质,而且在高温条件下作用更明显。J.E.Dutrizac,et al.[17]研究发现:温度在50~100 ℃范围内,盐酸介质中,黄铜矿的浸出率曲线为直线,而在硫酸介质中为抛物线。随后的进一步研究表明:温度高于50℃时,在硫酸铁介质中,氯离子的增加会加速黄铜矿的溶解,而在低温条件下没有这种现象[20]。H.Majima,et al.[21]研究认为:在硫酸铁介质中,黄铜矿的浸出率低于在氯化铁介质中的浸出率,因为氯化铁介质中形成的硫元素比硫酸铁介质中形成的更具有多孔性。氯化物系统中盐酸作为浸出剂,阻止了起催化作用的FeCl3的水解,反应(8)代表了氯酸铁介质中黄铜矿的溶解[22]。对比硫酸铁介质中黄铜矿的浸出,氯化铁介质中的浸出更快,反应更强烈,氯化铁可以再生而且黄铁矿不被侵蚀。
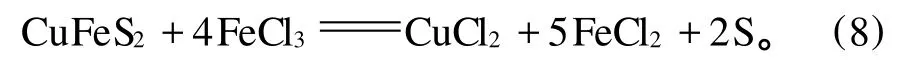
在黄铜矿浸出体系中,氯化铁比硫酸铁具有更大的氧化能力,但是,有以下几个因素限制了氯化铁在工业上的应用:氯离子与很多元素具有亲和力,使得从溶液中分离铜的过程更复杂;氯化溶液具有很大的腐蚀性;盐酸比硫酸更昂贵。
3 结论
总之,铁能很好地提高黄铜矿的浸出,但它要受到氧化还原电位、离子浓度、p H以及介质类型的影响。一般情况下,静电位较低的矿物优先溶解,因此可以加入静电位高于黄铜矿的矿物来加速黄铜矿的浸出;黄铜矿的浸出速率随铁离子浓度的增加而增大,但当浓度高于某一值时,对黄铜矿的浸出几乎没有影响;p H控制了溶浸液中黄钾铁矾的形成,进而影响了黄铜矿的浸出,一般情况下,黄铜矿浸出最佳p H范围为1.0~1.5;盐酸溶液虽然较硫酸溶液更有利于黄铜矿的浸出,但从经济上考虑选择硫酸更合适。因此,了解并人为控制黄铜矿浸出的影响因素,可为工业生产降低成本提供有力的科学依据。
[1]Naoki Hiroyoshi,Hajime Miki,Tsuyoshi Hirajima,et al.A Model for Ferrous-promoted ChaIcopyrite Leaching[J].Hydrometallurgy,2000,57(1):31-38.
[2]Hiroyoshi N,Hirota M,Hirajima T,et al.A Case of Ferrous Sulfate Addition Enhancing Chalcopyrite Leaching[J].Hydrometallurgy,1997,47(1):37-45.
[3]Hiroyoshi N,Mild H,Hirajima T,et al.Enhancement of Chalcopyrite Leaching by Ferrous Ions in Acidic Ferric Sulfate Solutions[J].Hydrometallurgy,2001,60(3):185-197.
[4]Gottschalk V,Buehler H.Oxidation of Sulfides[J].Econ Geol,1910,10(5):28-35.
[5]Nicol M J.Mechanism of Aqueous Reduction of Chalcopyrite by Copper Iron and Lead[J].Trans Min Metall,1975,84(12):C206.
[6]Brierley J A,Brierley C L.Present and Future Commercial Applications of Biohydrometallurgy[J].Hydrometallurgy,2001,59(2):233-239.
[7]Mehta A P,Murr L E.Kinetic Study of Sulfide Leaching by Galvanic Interaction Between Chalcopyrite,Pyrite and Sphalerite in the Presence of T.Ferroxidans and Thermophilic Micro-organism[J].Biotech Bioeng,1982,24(4):919-940.
[8]Elsa M Arce,Ignacio González.A Comparative Study of Electrochemical Behavior of Chalcopyrite,Chalcocite and Bornite in Sulfuric Acid Solution[J].Int J Miner Process,2002,67(1):17-28.
[9]李宏照,刘晓荣.黄铁矿和镍黄铁矿混合细菌浸出过程的原电池效应[J].有色金属,2002,54(4):47-55.
[10]张杰,吴爱祥.排土场黄铁矿促进黄铜矿浸出研究[J].金属矿山,2008,381(3):38-41.
[11]Dutrizac J E.The Dissolution of Chalcopyrite in Ferric Sulfate and Ferric Chlorite Media[J].Metallurgical Transactions,1981,B12B,371-378.
[12]Tomas Havlik,Milan hrobian,Peter Balaz,et al.Leaching of Chalcopyrite Concentrate With Ferric Chloride[J].Int J Miner Process,1995,43(1/2):61-72.
[13]Javier Vilcáez,Ryoichi Yamada,Chihiro Inoue.Effect of pH Reduction and Ferric Ion Addition on the Leaching of Chalcopyrite at Thermophilic Temperatures[J].Hydrometallurgy,2009,96(1/2):62-71.
[14]张卫民,谷士飞,孙占学.催化剂组合对低品位原生硫化铜矿细菌浸出的催化效应[J].矿业开发与研究,2008,29(2):46-48.
[15]张德诚,罗学冈.较低温度下细菌浸出黄铜矿工艺影响因素研究[J].金属矿山,2007,377(11):65-68.
[16]Sadowski Z,Jazdzyk E,Karas H.Bioleaching of Copper Ore Flotation Concentrates[J].Minerals Engineering,2003,16(1):51-53.
[17]Dutrizac J E,MacDonald R J C,Ingraham T R.The Kinetics of Dissolution of Synthetic Chalcopyrite in Aqueous Acidic Ferric Sulfate Solutions[J].Trans Metall Soc,1969,245:955-959.
[18]舒荣波,阮仁满,温建康.低电位化学浸出云南大红山黄铜矿[J].矿产综合利用,2008(4):3-5.
[19]Sullivan J D.Chemical and Physical Features of Copper Leaching[J].Trans Am Inst Min Metall,1933,106:515-546.
[20]Dutrizac J E,MacDonald R J C.The Effect of Sodium Chloride on the Dissolution of Chalcopyrite Under Simulated Dump Leaching Conditions[J].Metall Trans,1971(2):2310-2312.
[21]Majima H,Awakura Y,Hirato T,et al.The Leaching of Chalcopyrite in Ferric Chloride and Ferric Sulfate Solution[J].Can Metall Q,1985,24(4):283-291.
[22]O’Malley M L,Liddell K K.Leaching of CuFeS2by Aqueous FeCl3,HCl and NaCl:Effects of Solution Composition and Limited Oxidant[J].Metall Trans,1987,18B:505-510.
Abstract:The article summarizes the mechanisms and influencing factors on chalcopyrite leaching,points out that iron is an effective infusion,but its effect is relation to oxidation-reduction potential,iron ion concentration,p H,media types and other factors.
Key words:chalcopyrite;iron ion;leaching
Research Progress on Promoted Leaching of Chalcopyrite by Iron Ion
WANG Cui-hong,ZHANG Wei-min
(School of Civil and Environmental Engineering,East China Institute of Technology,Fuzhou,Jiangxi 344000,China)
TF803.21
A
1009-2617(2010)02-0067-04
2009-12-19
王翠红(1984-),女,陕西西安人,硕士研究生,主要研究方向为溶浸水文地质。
