六偏磷酸钠及硅酸钠对海水浮选黄铜矿的影响机理
2020-11-14李育彪朱虹嘉魏桢伦
李育彪 杨 旭 朱虹嘉 魏桢伦
(武汉理工大学资源与环境工程学院,湖北武汉430070)
黄铜矿是最重要的含铜矿物,往往通过浮选获得。随着淡水资源的日益匮乏,海水浮选黄铜矿引起了工业界和学术界越来越多的关注[1],但海水中Ca2+、Mg2+等离子易生成亲水性沉淀抑制矿物浮选[2]。笔者课题组[3]研究了海水中常见阳离子对黄铜矿浮选的影响,发现pH=10时,亲水的Mg(OH)2是抑制黄铜矿浮选的主要原因。进一步研究表明[4],海水浮选中使用黄药作为捕收剂时,Na+、K+可以促进黄药在黄铜矿表面的吸附,Ca2+影响不大,但Mg2+生成的氢氧化物沉淀强烈抑制黄药吸附,从而抑制黄铜矿浮选。
许多研究者尝试消除Ca2+、Mg2+等离子对矿物浮选的不利影响[5,6]。JELDRES等[7]使用CaO与Na2CO3摩尔比为1∶1的混合药剂预处理海水来改善黄铜矿和辉钼矿的浮选环境,显著提高了辉钼矿的浮选回收率(提高了60.4个百分点)。SUYANTARA等[8]发现在碱性条件下,乳化煤油与水中沉淀物形成聚合物,从而减少亲水沉淀在辉钼矿表面的吸附。
六偏磷酸钠(SH)和硅酸钠(SS)是常用的分散剂。LI等[9]在海水浮选辉钼矿中加入SH成功消除了Ca2+、Mg2+离子对辉钼矿浮选的负面影响。进一步把SH应用到海水浮选黄铜矿中[10],发现SH主要是阻止带正电的沉淀吸附在黄铜矿表面,其次是通过与Ca2+、Mg2+生成络合物从而减少沉淀。而SS也可恢复海水中黄铜矿的可浮性[11]。另一方面,海水浮选辉钼矿动力学研究表明[12],一级矩形分布模型能很好地拟合浮选曲线,但目前尚无分散剂对海水浮选黄铜矿动力学及作用机理的研究。
本文同时使用SS和SH两种分散剂,在纯水、海水和Mg2+溶液中进行黄铜矿浮选试验,基于浮选动力学并结合XPS、分子动力学模拟等手段研究两种分散剂的影响机理。
1 试验材料与研究方法
1.1 试验材料
本文所用黄铜矿取自湖北大冶,经破碎、研磨、湿筛、乙醇超声清洗,获得粒级为38~75 μm的粉末样品,置于真空干燥箱中制备成试验所用矿样。XRF测试分析可知,元素Cu、Fe和S含量总计97%,符合试验样品纯度要求。试剂(SS、SH、NaOH、HCl、Mg-Cl2·6H2O、NaCl、KCl、NaHCO3和 MgSO4)均为分析纯,试验用水为电阻率≥18.2 MΩ·cm的超纯水。
1.2 试验方法
取1 g黄铜矿放入装有25 mL溶液(纯水、海水[8]、0.05 mol/L MgCl2)的浮选槽中(XFG-Ⅱ挂槽式浮选机,武汉探矿机械厂),转速1 200 r/min,充气量6 L/h,加入100 mg/L SS或SH,使用NaOH或HCl调节矿浆 pH=10[10],分别在 1、3、5、8和 10 min分批刮泡,刮泡速度为6次/min。将1 g粒度为-38 μm黄铜矿倒入250 mL锥形瓶中,加入100 mL溶液后放入恒温振荡器(25℃)充分摇匀30 min,插入泡沫管(d=5 cm、h=80 cm,底部带石英砂芯),开启气阀(流速40 L/h)。待泡沫层平衡后,记录最高起泡高度,然后关闭气阀,记录泡沫半衰期。
将黄铜矿用磨砂纸抛光后置于溶液中浸泡并搅拌与浮选相同时间,用超纯水轻柔洗涤表面,在空气中自然晾干后用JC2000D进行接触角测定。采用电泳法(ZS90电位测试仪,英国Malvern公司)测量黄铜矿Zeta电位。称0.05 g粒度为-5µm黄铜矿粉末放入50 mL烧杯中,加入溶液及药剂,磁力搅拌10 min以保证悬浮液混匀,取上层悬浮液注入测试槽中测试。用具有单色器铝靶的Thermo Fisher ESCALAB 250Xi光电子能谱仪测试黄铜矿样品表面,每个光谱扫描5次,停留时间0.1 s,通过XPS Peak 4.1软件进行拟合分析。
采用一级矩形分布模型作为黄铜矿浮选的动力学模型[12]。采用经典DLVO理论计算黄铜矿颗粒与Mg(OH)2之间的作用力。除双电层静电作用能VE、分子间范德华作用能VW[13],高分子分散剂SH还会产生空间位阻效应,导致位阻排斥作用能VSR的出现[14]。此时,颗粒间的相互作用能由式(1)表示[15]:

采用Materials Studio中Forcite模块进行分子动力学计算,在universal力场下采用Ewald和Atom based求和法分别计算静电能和范德华力。截距为1.25 nm,采用包括八层原子的10×10黄铜矿(112)面的超胞进行计算[16]。使用3 000个水分子和50个Mg(OH)2分子、50个SS分子或5个SH分子。
2 试验结果与讨论
2.1 浮选试验
图1(a)为pH=10时,纯水中黄铜矿浮选回收率随时间的变化。未加入分散剂时,前5 min黄铜矿累积回收率急剧增加,5~10 min时增加趋势变缓,最终稳定在70%左右。分别加入100 mg/L的SS和SH后,黄铜矿累积回收率整体增加并不明显,表明两种分散剂对黄铜矿可浮性影响不大。图1(b)中,pH=10,未加入分散剂时,黄铜矿在海水中的累积回收率随时间的增加逐渐增加,10 min时累积回收率稳定在58%左右。分别加入100 mg/L的SS和SH后,累积回收率分别增加到76%和92%,表明SS和SH能有效改善海水对黄铜矿的抑制作用,且SH效果更好。此外,浓度为0.05 mol/L的MgCl2溶液中无分散剂时,黄铜矿10 min时的累积回收率仅为5%,且回收率与时间成线性关系。加入100 mg/L的SS和SH后,10 min时累积回收率分别增加到49%和79%,表明SH能更显著提高黄铜矿回收率,与已发表文献[4,9-10]一致。
2.2 三相泡沫稳定性试验
三相泡沫稳定性可用泡沫层厚度表示,泡沫层越厚,泡沫稳定性越好,反之越差[17]。在纯水、海水和0.05 mol/L MgCl2溶液中分别加入100 mg/L的SS和SH后测量矿浆泡沫层厚度,结果如图2所示。


由图2可知,分散剂对矿浆泡沫稳定性影响很小。然而,由浮选结果可知,分散剂明显增加了海水中黄铜矿回收率,说明分散剂的促进作用并非通过影响泡沫稳定性实现的。
3 动力学分析
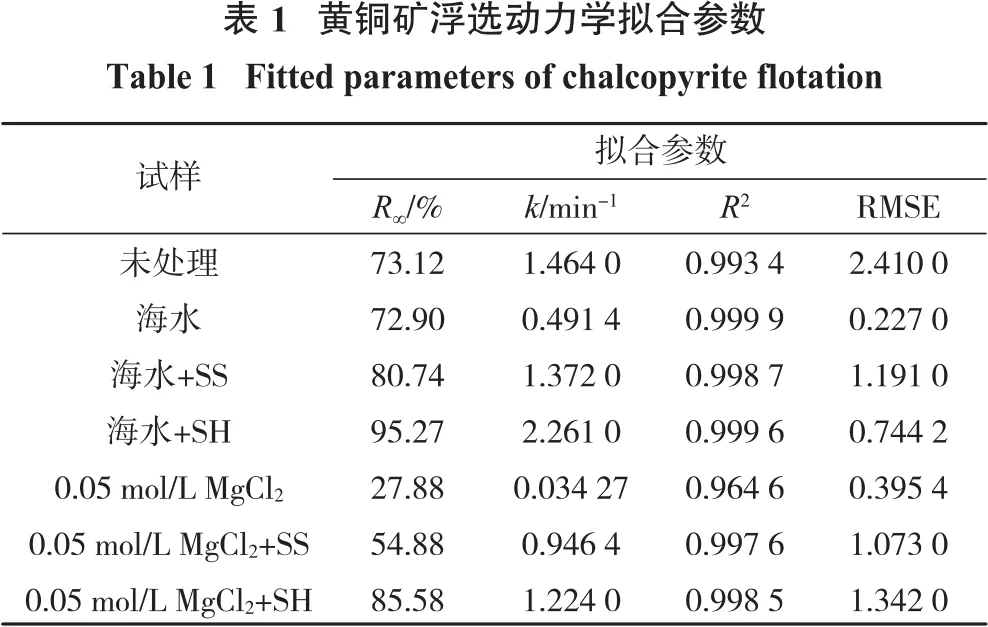
采用一级矩形分布模型对黄铜矿在pH=10、未添加分散剂和添加100 mg/L分散剂后的浮选结果进行拟合,如表1所示。对比理论最大回收率R∞和浮选速率k,发现纯水中加入分散剂后黄铜矿R∞和k均无明显变化,表明分散剂对黄铜矿在纯水中的浮选动力学无明显影响。在海水中加入SS和SH后,R∞由72.90%分别增加至80.74%和95.27%,k由0.491 4 min-1分别增加至 1.372 min-1和 2.261 min-1。因此,分散剂能有效提高黄铜矿在海水中的浮选速率,且SH作用效果更好。在浓度为0.05 mol/L的MgCl2溶液中加入SS和SH后,R∞由27.88%分别增加至54.88%和85.58%,k也随分散剂加入而显著提高,进一步说明黄铜矿浮选回收率的提高主要是分散剂作用于Mg(OH)2的结果。
4 机理分析
4.1 接触角分析
为了研究分散剂对黄铜矿表面润湿性的影响,测量了pH=10时,加入100 mg/L分散剂后3种溶液中黄铜矿的接触角,结果如图3所示。
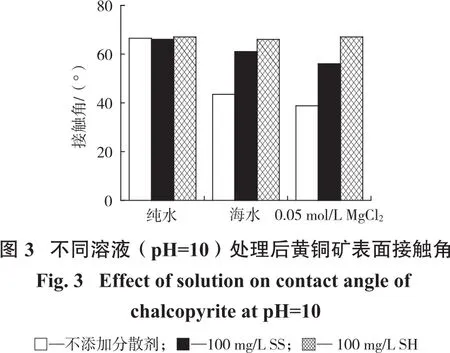
由图3可知:纯水中加入分散剂后,黄铜矿表面疏水性变化并不明显,证明分散剂对黄铜矿表面疏水性无明显影响;海水中加入SS和SH后,黄铜矿接触角从44°分别增加至61°和66°,说明两种分散剂均能有效改善海水中亲水物质对黄铜矿浮选的不利影响,且SH效果更佳。类似的,在浓度为0.05 mol/L的MgCl2溶液中加入SS和SH后,黄铜矿表面接触角从35°分别增加至56°和67°。
4.2 Zeta电位分析
为进一步了解三种溶液中分散剂对矿物表面电性的影响,测量pH=10时,加入100 mg/L分散剂后黄铜矿的Zeta电位,结果如表2所示。
以表2可以看出:纯水中加入SS和SH后,黄铜矿Zeta电位变得更负。黄铜矿在海水中Zeta电位为3.05 mV,可能是海水中形成的带正电沉淀物吸附在黄铜矿表面[18],加入SS和SH后,Zeta电位分别降低至-1.8 mV和-6 mV,可能是由于分散剂减少了沉淀的吸附,且SH效果更显著;pH=10时,黄铜矿在浓度为0.05 mol/L的MgCl2溶液中的Zeta电位为17.8 mV,可能是由于碱性条件下生成大量带正电Mg(OH)2沉淀吸附在黄铜矿表面[10];加入100 mg/L分散剂后,黄铜矿表面Zeta电位均急剧下降,特别是浓度为100 mg/L的SH的加入导致黄铜矿Zeta电位由正到负,说明两种分散剂均能通过降低黄铜矿Zeta电位影响其浮选回收率,且SH作用更显著。
4.3 XPS分析
在纯水、海水和0.05 mol/L MgCl2中加入分散剂前后,黄铜矿表面元素相对含量变化如表3所示。相对于纯水,海水中黄铜矿表面Mg和O含量明显增加,分别从1%和25%增加到5%和34%,说明形成Mg(OH)2沉淀并吸附在黄铜矿表面,少量Ca主要是由于生成的 CaCO3沉淀吸附在黄铜矿表面[6,19]。在浓度为0.05 mol/L的MgCl2中,黄铜矿表面元素含量出现了相同的变化趋势。海水中加入SS后,黄铜矿表面Mg、Ca和O的相对含量分别降低至2%、0和28%,表明SS能有效减少Mg(OH)2和CaCO3沉淀在黄铜矿表面的吸附。加入SH后,黄铜矿表面Mg、Ca和O的相对含量分别降低至1%、0%和26%,说明SH能更有效阻止海水中Mg(OH)2沉淀在黄铜矿表面的吸附。在浓度为0.05 mol/L的MgCl2中加入SS后,黄铜矿表面Mg和O的相对含量分别由5%和32%降低至2%和28%,而加入SH后,Mg和O的相对含量降低更多,说明海水中起主要抑制作用的是Mg2+,且SH较SS能更有效减少Mg(OH)2沉淀在黄铜矿表面的吸附。

4.4 DLVO理论计算
pH=10时,黄铜矿颗粒和 Mg(OH)2胶体的 Zeta电位分别为-46.5 mV和14.9 mV;加入SS后其Zeta电位分别变为-51.5 mV和-16.9 mV,加入SH后变为-55.1 mV和-22.8 mV。黄铜矿与Mg(OH)2胶体之间的作用势能的计算结果如图4所示。

从图4可以看出:未加入分散剂时,黄铜矿颗粒与Mg(OH)2颗粒间VW和VE均为负值,导致VT也为负值,表明两者之间主要为吸引力,亲水性Mg(OH)2沉淀吸附在黄铜矿表面;加入SS后,黄铜矿与Mg(OH)2颗粒间VW与未加入分散剂时相同,而VE随颗粒间距的增加逐渐由负向正增加。此时,黄铜矿与Mg(OH)2颗粒间的VT随颗粒间距的增加由负值逐渐增加为正值,表明两者之间逐渐由吸引力变为排斥力,进一步证明SS的分散作用;加入SH后,VW保持不变,VE在计算的颗粒间距离内都为正值,绝对值大于VW,且比加入SS时明显增加。此时,VSR为正值,且绝对值明显大于VW和VE,表明VSR主导了黄铜矿与Mg(OH)2胶体之间的作用力。颗粒间的VT为正值,且明显大于加入SS的条件,说明两者之间为较大的排斥力,导致黄铜矿与Mg(OH)2强烈分散。
4.5 分子动力学模拟
亲水性Mg(OH)2沉淀是海水抑制黄铜矿浮选的最重要原因[3]。pH=10时,SS在溶液中主要水解成SiO(OH)3-[20],而SH主要是一种由[HPO4]2-组成的长链状聚合物[20]。根据前期研究结果[16],使用热力学上最稳定的黄铜矿(112)面进行模拟,结果如图5所示。未加分散剂时,Mg(OH)2吸附在黄铜矿表面,形成亲水性屏障,从而降低其可浮性[4,10]。加入SS后,少量SS吸附在黄铜矿表面,改变黄铜矿表面电性,使黄铜矿与Mg(OH)2之间的静电吸引力变成排斥力,显著减少Mg(OH)2在黄铜矿表面的吸附。加入SH后,可增加矿物表面与Mg(OH)2之间的静电排斥力[21],其大分子在黄铜矿表面的吸附会产生很强的VSR[5],使Mg(OH)2颗粒更加远离黄铜矿表面,能更有效地阻止Mg(OH)2在黄铜矿表面的吸附,因此SH效果优于SS。

5 结 论
(1)SH和SS两种常见分散剂能有效缓解海水在碱性条件下对黄铜矿浮选的抑制作用。分散剂吸附在黄铜矿和Mg(OH)2表面,使Mg(OH)2的电性由正到负、增大黄铜矿表面电负性,导致黄铜矿与Mg(OH)2沉淀之间的作用力由吸引力变为排斥力,阻止Mg(OH)2沉淀在黄铜矿表面的吸附,且SH比SS分散作用更好。
(2)黄铜矿浮选符合一阶矩形动力学模型。无分散剂时,R∞纯水>R∞海水>R∞0.05mol/LMgCl2,k纯水>k海水>k0.05mol/LMgCl2,表明海水溶液降低了黄铜矿的浮选速率及理论最大回收率。在海水中,SS和SH使黄铜矿的R∞和k分别提高了7.84%和0.88 min-1、22.37%和1.77 min-1;在0.05 mol/L MgCl2中,SS和SH使黄铜矿的R∞和k分别提高了27%和0.91 min-1、57.5%和1.19 min-1,表明SH效果优于SS。
