实验性脑出血大鼠急性期脑组织含水量与ET、NO含量的关系
2010-09-13刘文立张生林
刘文立,张生林
脑出血是急性脑血管疾病的危重类型,其发生率、致残率和病死率均较高。脑出血后脑水肿形成是脑出血的重要并发症,也是临床脑出血病人病情加重和死亡的主要原因之一,但脑出血后脑水肿形成的病理机制至今尚未完全阐明。内皮素(endothelin,ET)和一氧化氮(nitric oxide,NO)是近年来发现的血管活性物质,两者在脑血流调节中起重要作用[1]。本实验旨在通过建立大鼠脑出血模型,观察脑出血后血肿周围脑组织含水量与ET、NO含量之间的关系,探讨ET、NO在脑出血后脑水肿形成中的作用,为临床治疗提供新的理论依据和方法。
1 材料与方法
1.1 实验动物及分组 选用健康雄性SD大鼠48只,体重250 g~300 g,由山西医科大学实验动物中心提供。将大鼠随机分为脑出血组和假手术对照组,每组24只,两组动物再随机分为术后1 d,3 d,5,7 d 4个时间点,每个时间点6只,分别用于测定脑组织含水量与ET、NO含量。
1.2 动物模型制备 采用Rosenberg等报道的方法,将大鼠用20%乌拉坦(0.35 mg/100 g)腹腔注射麻醉,固定于立体定向仪(江湾I型)上。头皮下正中切口约1.0 cm,于颅骨背侧前囟后1.0 mm,右侧旁开3.0 mm处钻孔,用微量注射器沿钻孔垂直进针约5.8 mm。脑出血组在右侧尾状核注射溶有Ⅶ型胶原酶(0.5 U/2 μ L)的生理盐水2μL,2 min内注射完毕,留针5 min。Ⅶ型胶原酶由美国Sigma公司提供。对照组在右侧尾状核注入2 μ L生理盐水,然后缝合头皮。术后观察神经系统症状,大鼠出现病灶对侧偏瘫、行走时有不同程度的旋转、患侧前肢内收及后肢外展,视为模型成功[2]。
1.3 脑组织样本的采取 按各组预定时间过量麻醉处死大鼠,开颅取脑。脑出血组将脑血肿所在的右侧大脑沿血肿正中冠状切面切开,取血肿前部脑组织200 mg做脑含水量测定,取血肿后内脑组织约200 mg测定NO含量,取血肿后外脑组织约100 mg测定ET含量。对照组取右侧大脑按上述方法进行操作。
1.4 脑组织含水量的测定 用干湿重法测定脑组织含水量。脑组织含水量(%)=(湿重-干重)/湿重×100%[3]。
1.5 脑组织ET含量的测定 采用放射免疫分析法测定ET,试剂盒购自解放军总医院科技开发中心放免研究所。
1.6 脑组织NO含量的测定 采用硝酸还原酶法测定NO,试剂盒购自南京建成生物工程研究所。
2 结 果
2.1 脑组织ET、NO含量及脑含水量变化 脑出血组各时间点脑组织ET、NO含量及脑含水量均高于假手术对照组(P<0.05或 P<0.01)。脑出血组脑组织ET、NO含量及脑含水量均于1 d升高,3 d达高峰,5 d下降(P<0.05)。详见表1。
表1 各组大鼠脑组织ET、NO含量及脑含水量(±s)
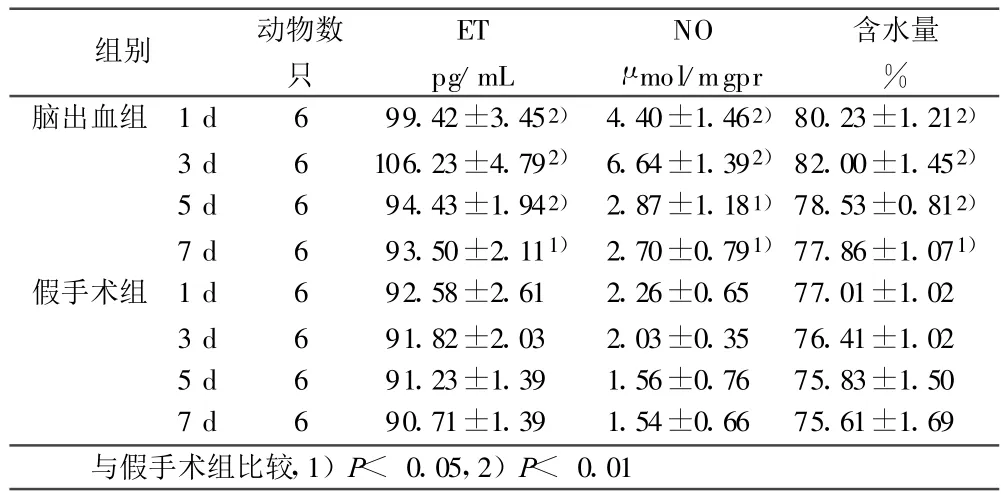
表1 各组大鼠脑组织ET、NO含量及脑含水量(±s)
组别 动物数只ET pg/mL NO μ mol/mgpr含水量%脑出血组 1 d 6 99.42±3.452) 4.40±1.462)80.23±1.212)3 d 6 106.23±4.792) 6.64±1.392)82.00±1.452)5 d 6 94.43±1.942) 2.87±1.181)78.53±0.812)7 d 6 93.50±2.111) 2.70±0.791)77.86±1.071)假手术组 1 d 6 92.58±2.61 2.26±0.65 77.01±1.02 3 d 6 91.82±2.03 2.03±0.35 76.41±1.02 5 d 6 91.23±1.39 1.56±0.76 75.83±1.50 7 d 6 90.71±1.39 1.54±0.66 75.61±1.69与假手术组比较,1)P<0.05,2)P<0.01
2.2 脑组织含水量与ET、NO含量的关系 经相关分析,结果显示脑出血大鼠急性期脑组织含水量与ET、NO含量均呈正相关关系(P<0.05或P<0.01)。详见表 2。
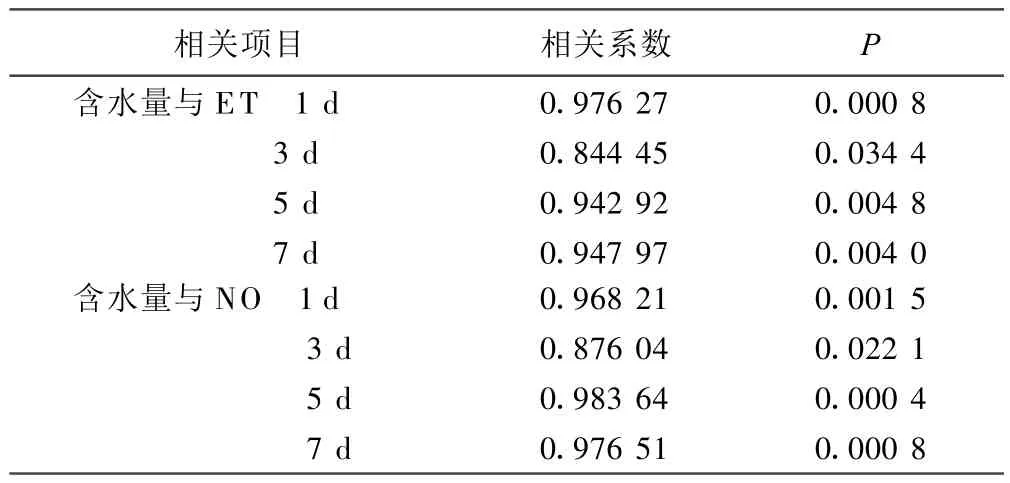
表2 脑出血大鼠急性期脑组织含水量与ET、NO含量相关分析
3 讨 论
3.1 脑出血后脑水肿与ET的关系 ET是一种由21个氨基酸组成的血管活性多肽,是目前所知作用最强的长效血管收缩剂[4]。ET不仅存在于神经系统的一些内皮细胞中,也广泛分布于神经细胞内[5]。已证实神经胶质细胞也产生ET,并以旁分泌的方式对神经胶质细胞和神经元发挥作用,证明ET可能为一种潜在的神经调节因子,并具有强大的缩血管作用[6]。刘爱芬等[7]测定观察了57例脑出血患者血浆ET含量的变化,结果发现脑出血后24 h内血浆ET水平即开始升高,1 d~3 d达高峰,之后维持在较高水平直至14 d,半月后开始下降,1月后基本降至正常水平。这与脑出血后脑水肿的形成时程一致。张微微等[8]报道大鼠脑出血后脑内ET-1的表达与脑水含量的变化规律基本一致。陈红霞等[9]报道急性脑出血患者在出血后第1天、第4天的血浆内皮素含量明显高于对照组。
本研究结果显示大鼠脑出血后,血肿周围脑组织含水量与ET含量均于1 d时升高,3 d时达高峰,5 d降低,7 d与5 d差别不显著,脑组织含水量与ET含量呈正相关关系。表明ET参与了脑出血后脑水肿的发生、发展。脑出血后ET升高可能与下列因素有关:应激状态下儿茶酚胺大量生成诱导ET过量合成。脑出血时,红细胞破坏释放氧合血红蛋白(HbO2),刺激血管内皮细胞产生ET,还可能通过抑制cGMP或cAMP促进ET释放增多[10]。局部因素如肾上腺素、凝血酶增多等加速ET合成。脑出血时,颅内压增高,灌注压降低,缺血缺氧使ET合成、释放增多[11]。脑出血后内皮素过量合成,通过ET受体诱导细胞内Ca2+超载,血管收缩,细胞水肿;此外,内皮素分泌增多,调控Na+-H+交换,促进Na+内流,使细胞内 Na+浓度增高[12];内皮素还激活磷脂酶A2产生花生四烯酸,后者及其代谢产物可引起毛细血管通透性升高。因此,ET促进了脑出血后脑水肿的发生及发展。
3.2 脑出血后脑水肿与NO的关系 NO在体内扮演着生理和病理的双重角色,它产生异常与临床多种疾病的发生发展有密切关系。脑内NO既可起脑保护作用,又可起神经细胞毒性作用[13]。NO是由 L-精氨酸在NO合酶(NOS)催化下生成的。生理量的NO可扩张血管,改善微循环及抗血小板凝聚等,但NO产生过多则会损害神经原,产生病理效应。王永志等[14]通过临床研究报道,脑出血急性期血清NO水平较恢复期明显升高,稳定期血清NO水平仍高于对照组,恢复期接近正常水平。这与脑出血后脑水肿的变化规律基本一致。Chen等[15]报道,通过检测351例脑出血患者急性期血浆NO值及100例健康成人血浆NO值,结果发现,脑出血患者急性期血浆NO均值较健康成人血浆NO均值显著升高。杨文清等[16]报道,大鼠脑出血后4 h脑组织中NO含量增加,72 h达到高峰。
本研究发现,大鼠脑出血后血肿周围脑组织含水量与NO含量均于1 d时升高,3 d时达高峰,5 d降低,7 d与5 d差别不显著,脑组织含水量与NO含量呈正相关关系。说明NO参与了脑出血后脑水肿的发生、发展。脑出血后NO升高的原因可能是,脑出血时脑细胞释放大量谷氨酸;激活了N-甲基-D-天门冬氨酸(NMDA)受体,促进Ca2+大量内流并与CaM结合,从而激活了 Ca2+依赖性cNOS,产生大量的 NO[17];同时,出血灶周围大量白细胞浸润和聚集,激活了iNOS,从而导致NO的大量产生。高浓度的NO可与周围的超氧阴离子(O2-)迅速反应,生成另一具有强氧化作用的自由基-过氧亚硝基阴离子(ONOO-)而产生细胞毒性作用[18-20]。ONOO-可有效地氧化蛋白质疏基、Fe/s中心、锌指结构、硝基化蛋白质的酪氨酸残基,使许多重要的蛋白质或酶失活,影响细胞代谢,并抑制呼吸链酶,破坏线粒体结构,使DNA断裂,并可启动脂质过氧化[21],导致大脑微血管内皮细胞坏死,通透性增强,脑水肿形成。
脑出血后脑组织内ET和NO含量均升高,且与脑水肿程度呈正相关关系。ET和NO参与了脑出血后脑水肿的发生及发展。这为今后脑出血患者的治疗提供了一定的理论根据。可否应用ET受体拮抗剂和适量应用NOS抑制剂治疗急性脑出血,有待于进一步研究。
[1]Bederson JB,Germano M,Guarino L.Gortical blood flow and cerebral perfusion in a new noncraniotomy model of subarachnoid hemorrhage in rats[J].Stroke,1995,26(6):1087.
[2]Rosenberg GA,M un-bryce S,Wesley M,et al.Collagenase-induced intracerebral hemorrhage in rat[J].Stroke,1990,21:801-807.
[3]Yang GY,Beta AL.Ex perimental intracereral hemorrhage:Rrelationship between brain edema,blood flow,and blood-brain barrier permeability in rats[J].J Neurosurg,1993,81:93.
[4]Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cell[J].Nature,1988,332:411-420.
[5]Greenberg DA,Chan J,Sampson HA.Endothelins and the nervous sy stem[J].Neurology,1992,42:25-31.
[6]王晓,陶志宇,肖龙坡,等.颅脑损伤后一氧化氮、内皮素活性变化及其意义[J].中国现代医学杂志,2002,12(4):94-95.
[7]刘爱芬,李义召,孙琳,等.脑出血患者血浆内皮素水平的变化[J].脑与神经疾病杂志,1998,6(1):9-11.
[8]张微微,黄勇华,赵瑞娟,等.鼠脑出血后部分脑区内皮素-1表达与脑水含量变化[J].中华老年心脑血管病杂志,2001,3(4):264-267.
[9]陈红霞,刘远新,贾红娥.便秘对脑出血病人内皮素和一氧化氮及病情的影响[J].中西医结合心脑血管病杂志,2007,5(9):889-890.
[10]Cosentino F,Katusis ZS.Does endothelin-1 play a role in the pathogenesis of cerebral vasospasm[J].Stroke,1994,25(4):904-908.
[11]陈馥.内皮素和一氧化氮与脑血管病[J].国外医学:脑血管疾病分册,1997,5(2):83-87.
[12]Vigne P,Ladoux A,Frelin C.Endothelins activate Na+/H+exchange in brain capillary endothelial cells via a high affinity endothelin-3 receptor that is not coupled to PLC[J].J Biol Chem,1991,266(9):5925-5928.
[13]Lipton SA,Choi YB,Pan ZH,et al.A redox-based mechanism for the neuroprotective and neuroplest-ructive effects of nitric oxide and related nitrosocompounds[J].Nature,1993,364:626-632.
[14]王永志,陈炜,邢红云,等.血管活性物质与脑血管病的相关性研究[J].中国危重病急救医学,2000,12(5):270-272.
[15]Chen HH,Zhou JF.Low Cholesterol in erythrocy te membranes and high lipoperoxides in erythrocytes are the potential risk factors fo r cerebral hemorrhagic stroke in human[J].Biomed Enriron Sci,2001,14(3):189-198.
[16]杨文清,任玉录,郭克锋,等.安宫牛黄丸对急性脑出血大鼠脑组织中一氧化氮合酶及单胺类神经递质的影响[J].中国中医急症,2009,18(1):83-84.
[17]Inddecola C,Zhang F,Casey R,et al.Inducible nitric oxide synthase gene expression in vascular cells after transient focal cerebral ischemia[J].Stroke,1996,27:1373-1380.
[18]钟慈声,孙安阳.一氧化氮的生物医学[M].上海:上海医科大学出版社,1997:101-217.
[19]张忠兵.一氧化氮与某些临床疾病[J].中华内科杂志,1994,33(3):204.
[20]Nguyen T,Saberg HD.DN A damage and mutation in human cells exposed to nitric oxide in vitro[J].Proc Natl Acad Sci USA,1992,89(10):3030.
[21]孙素群,许霖水.一氧化氮间接作用机制的研究进展[J].生理科学进展,2002,33(2):167-169.
