诱导型一氧化氮合酶在衰老大鼠心肌对缺血再灌注损伤敏感性增加中的作用1)
2010-09-13马秀瑞吕婷婷刘慧荣
田 珏,燕 子,王 瑾,马秀瑞,吕婷婷,刘慧荣
大量的动物实验和临床研究表明,衰老心脏对缺血再灌注损伤较成年更为敏感[1,2],衰老的心脏梗死面积大、病人的疗效和预后差[3-5]。全球60岁以上衰老人口比例将从2000年的10.0%增至2050年的21.8%、2100年的32.2%[6]。这促使我们要努力揭示衰老对心肌缺血再灌注损伤的敏感性增加的机制,进而寻求更有效的防治措施。有研究表明衰老大鼠心肌缺血再灌注时过氧亚硝基阴离子(ONOO-)含量增加[7],但ONOO-的增加与心肌缺血再灌注损伤敏感性增加的关系有待进一步证实,ONOO-增加的原因也有待进一步研究。一氧化氮(NO)及其衍生物活性氮簇(RNS)具有促凋亡和抗凋亡的双重作用,普遍认为低浓度/低活性的RNS,如:eNOS催化生成的NO具有细胞保护作用;高浓度/高活性的RNS,如:iNOS催化生成的NO及其与超氧化物的双自由基反应产物ONOO-具有细胞毒性[8-11],衰老大鼠心肌缺血再灌注时ONOO-含量增加是否与iNOS有关,目前仍不清楚。
1 材料与方法
1.1 材料 健康雄性SD大鼠,成年大鼠(4~6月龄),衰老大鼠(22~24月龄),购自四川省医学科学院实验动物研究所。随机分为 3组,成年缺血再灌注组(缺血30 min,再灌注24 h)、衰老缺血再灌注组(缺血30 min,再灌注24 h),衰老缺血再灌注+1 400W 组(缺血 30 min,再灌注 24 h,缺血前 24 h及再灌注前25 min分别腹腔注射iNOS特异性阻断剂1 400 W,2 mg/kg)。每组6只。
1.2 在体大鼠心肌缺血再灌注模型的建立 10%水合氯醛麻醉动物。行气管插管,机械通气,频率60/min,潮气量 8 mL,吸呼比1:2。连接心电电极检测Ⅱ导心电图。沿胸骨左缘心脏搏动处纵行切开皮肤约2 cm,将6-0无创缝合针于左心耳根部下方2 mm处穿过心肌表层,在肺动脉圆锥旁出针。观察心电图,待其恢复稳定15 min后打一活结以结扎左冠脉前降支(LAD),心肌缺血成功的标志为:心电图Ⅱ导联ST段弓背向上抬高0.4 mV以上。30 min后松结扎线,心电图Ⅱ导联ST段下降1/2以上作为心肌组织恢复血液灌流的标志。缺血30 min,再灌注 24 h。
1.3 心肌梗死面积测定 心肌缺血30 min再灌注24 h后,再次结扎 LAD,经股静脉注入2%Evans blue,30 s~60 s内摘取心脏,用扫描仪对心脏切面进行扫描,利用Image-ProPlus5.0图像分析系统分析,分别测定蓝色、红色、白色区域面积,左心室面积(left ventricle,LV)为蓝色、红色和白色面积之和;危险区总面积(area at risk,AAR)为红色和白色面积之和;梗死区面积(area of necrosis,AN)为白色面积。结果以危险区面积与左心室面积的比值来判断手术手法有无差异性,以梗死区面积与危险区总面积的比值来表示心肌梗死面积大小。
1.4 心肌组织硝基酪氨酸含量检测 应用双抗体夹心ELISA法检测BCA法检测蛋白浓度。使用酶标仪在波长490 nm处测定光密度(OD)值。用含有已知剂量硝基酪氨酸的、硝酸化的BSA制作标准曲线,通过标准曲线计算组织样本中硝基酪氨酸含量,结果用每克蛋白含硝基酪氨酸量表示。
1.5 Western-blot测定iNOS蛋白表达 利用SDS-PAGE电泳技术分离组织匀浆中的蛋白,再转移至硝酸纤维素膜,用iNOS单克隆抗体(BD Transduction Laboratories)进行免疫印迹检测心肌组织iNOS含量。以大鼠心肌组织GAPDH的蛋白表达量作为内参。
1.6 统计学处理 采用SPSS 13.0统计软件对数据进行分析。实验结果以均数±标准差(±s)表示,多个样本均数比较采用单因素方差分析,两样本均数组间比较采用t检验。
2 结 果
2.1 年龄因素对缺血再灌注大鼠心肌梗死面积的影响心肌缺血再灌注后,衰老大鼠心梗面积较成年大鼠明显增大(P<0.05)。YI/R为成年缺血再灌注组;OI/R为衰老缺血再灌注组;OI/R+1400W为衰老缺血再灌注+1400W组。详见图1。
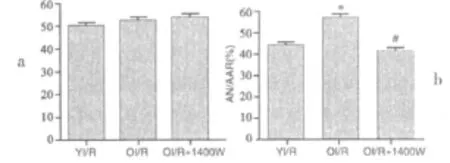
图1 各组心肌梗死面积比较
2.2 衰老组大鼠心肌ONOO-含量 衰老缺血再灌注组心肌组织NT含量较成年缺血再灌注组明显增高(7.29±0.1vs 3.2±0.1,P<0.05)。详见图 2。
2.3 衰老组大鼠心肌组织iNOS表达增高 与正常成年大鼠比较,正常衰老大鼠iNOS表达升高(P<0.05);与成年缺血/再灌注组比较,衰老缺血/再灌注组iNOS表达升高(P<0.05)。详见图3。
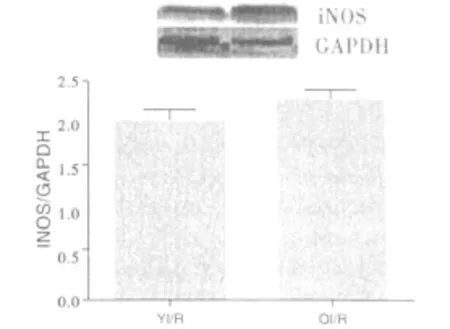
图3 各组心肌组织iNOS的表达
2.4 衰老大鼠心肌组织中NT含量 用iNOS的特异性阻断剂1 400 W阻断iNOS后发现,缺血再灌注后,衰老大鼠心肌组织的 NT明显下降(P<0.05)。详见图2。
2.5 衰老大鼠梗死面积 衰老心肌缺血再灌注+1400W组大鼠心梗面积较衰老心肌缺血再灌注组明显减小(P<0.05)。详见图1。
3 讨 论
缺血再灌注损伤直接影响着缺血性疾病的治疗效果和预后,衰老的心脏对缺血再灌注损伤的敏感性增加,衰老患者溶栓率低、心衰、休克、心律失常等并发症较为常见,病死率高[12]。
凋亡在心肌再灌注损伤中发挥重要作用,降低心肌细胞凋亡可以显著减少心梗面积,改善心功能。已有研究显示衰老时心肌细胞凋亡增加,如能揭示衰老时心肌细胞凋亡增加的潜在机制,有利于解释衰老时心脏对缺血再灌注损伤易感性增加的原因,还可能为特异性扭转机体这一系列损伤提供新的思路。
前期的研究结果表明,心肌缺血再灌注时,衰老大鼠心肌细胞凋亡指数和Caspase-3的活性明显高于成年大鼠,提示衰老大鼠对心肌缺血再灌注损伤的敏感性增加;同时发现衰老大鼠缺血再灌注心肌组织ONOO-含量增加。但ONOO-增加与衰老大鼠对心肌缺血再灌注损伤的敏感性增加的关系有待进一步明确,ONOO-的来源也有待研究。本实验观察到,衰老大鼠缺血再灌注时心梗面积较成年大鼠增大,衰老心肌组织缺血再灌注时ONOO-的水平增高,同时衰老大鼠iNOS表达升高,当给予iNOS特异性阻断剂1 400 W后,衰老大鼠缺血再灌注心肌组织ONOO-下降,同时心梗面积减小。因此衰老大鼠对心肌缺血再灌注损伤敏感性增加可能是由于衰老心脏中iNOS表达升高,催化生成大量NO进而生成毒性的ONOO-,从而损伤引起心肌损伤。
本研究结果提示,在临床治疗中或许可以通过降低iNOS表达、抑制iNOS活性或使用ONOO-解毒剂来部分减轻老年患者对心肌缺血再灌注损伤的敏感性,从而提高老年冠心病患者的疗效,降低病死率,改善老年冠心病患者的生命质量。但为何衰老的心肌iNOS表达会增高?升高的NO及其毒性衍生物ONOO-又是通过何种机制使得衰老心肌凋亡增加、对缺血再灌注损伤更加敏感?这些均有待于进一步研究,以更好地揭示衰老心脏对缺血再灌注损伤易感性增加的机制。
[1]Kostyak JC,Hunter JC,Korzick DH.Acute PKCdelta inhibition limits ischaemia-reperfusion injury in the aged rat heart:Role ofGSK-3beta[J].Cardiovasc Res,2006,70(2):325-334.
[2]Lakatta EG,Levy D.Arterial and cardiac aging:Major shareholders in cardiovascular disease enterprises:Part I:Aging arteries:A“set up” for vascular disease[J].Circulation,2003,107(1):139-146.
[3]Gould KE,T affet GE,Michael LH,et al.Heart failure and greater infarct expansion in middle-aged mice:A relevant model for postinfarction failure[J].Am J Phy siol Heart Circ Phy siol,2002,282(2):H615-H621.
[4]Abete P,Testa G,Ferrara N,et al.Cardioprotective effect of ischemic preconditioning is preserved in food-restricted senescent rats[J].Am J Physiol Heart Circ Physiol,2002,282(6):H1978-H987.
[5]White HD,Barbash GI,Califf RM,et al.Age and outcome with contemporary thrombolytic therapy.Resultsfrom the GUSTO-I trial.Global Utilization of Streptokinase and TPA for occluded co ronary arteries trial[J].Circulation,1996,94(8):1826-1833.
[6]Lutz W,Sanderson W,Scherbov S.The coming acceleration of global population ageing[J].Nature,2008,451(7179):716-719.
[7]武烨,王晓樑,燕子,等.衰老大鼠心肌对缺血再灌注损伤的敏感性研究[J].中华老年医学杂志,2006,25(12):912-915.
[8]Beckman JS,Koppenol WH.Nitric oxide,superoxide,and peroxynitrite:The good,the bad,and ugly[J].Am J Phy siol,1996,271(5 Pt 1):C1424-437.
[9]Boy d CS,Cadenas E.Nitric oxide and cell signaling pathways in mitochondrial-dependent apoptosis[J].Biol Chem,2002,383(3-4):411-423.
[10]Fierro IM,Nascimento-DaSilva V,Arruda MA,et al.Induction of NOS in rat blood PMN in vivo and in vitro:Modulation by tyrosine kinase and involvement in bactericidal activity[J].J Leukoc Biol,1999,65(4):508-514.
[11]Wheeler M A,Smith SD.Bacterial infection induces nitric oxide synthase in human neutrophils[J].J Clin Invest,1997,99(1):110-116.
[12]侯维宁,陈锐,简振尧.老年急性心肌梗死的临床特点、影响因素与处理[J].中国心血管病研究杂志,2003,1(2):102-103.
