中药对Ⅱ相药物代谢酶GST和UGT的影响Δ
2010-09-11韩永龙李丹孙习鹏郭澄上海交通大学附属第六人民医院药剂科上海市200233上海中医药大学上海市20203大庆油田总医院临床药学科大庆市6300
韩永龙,李丹,孙习鹏,郭澄#(.上海交通大学附属第六人民医院药剂科,上海市200233;2.上海中医药大学,上海市 20203;3.大庆油田总医院临床药学科,大庆市 6300)
中药虽然成分复杂,但药效的物质基础大多数仍要通过药物代谢酶代谢,或对药物代谢酶产生诱导或抑制作用,从而影响其它药物的代谢或产生药物相互作用,对药物的有效性和安全性产生影响。因此,从药物代谢酶的角度研究中药,既有利于从分子水平探讨中药的作用机制,又有可能揭示中药-西药或中药-中药之间产生相互作用的关系,对提高中药的有效性和安全性具有重要的意义。以前,国内、外均偏重于研究中药与细胞色素P450酶的相互作用[1~3],但随着对药物代谢酶研究的深入,Ⅱ相酶系在药物发现和发展中变得越来越重要。因此,近年来中药对Ⅱ相药物代谢酶影响的研究也逐渐增多。本文着重就中药对Ⅱ相药物代谢酶谷胱甘肽硫转移酶(Glutathione S-transferase,GST)和尿苷二磷酸葡糖醛酸转移酶(UDP-glucuronyltransferase,UGT)影响的进展进行综述,以供大家参考。
1 主要Ⅱ相药物代谢酶简介
药物代谢酶是参与各种化学物质在体内进行生物转化的重要酶系,按其催化反应类型可分为Ⅰ相酶系和Ⅱ相酶系。Ⅱ相酶主要包括UGT、GST、磺基转移酶(ST)、巯嘌呤甲基转移酶(TPMT)、N-乙酰基转移酶(N-acetyltransferase,NAT)和儿茶酚邻位甲基转移酶(COMT)等。Ⅱ相酶系中的各种酶的比例分布见图1。其参与糖苷结合、硫酸化、甲基化、乙酰化、氨基酸结合、谷胱甘肽结合、脂肪酸结合、缩合反应等结合反应,使产生的代谢产物具有更大的水溶性,加速药物或化学毒物本身及代谢产物以结合物的形式排出体外,这才产生了真正意义上的对药物的解毒作用。
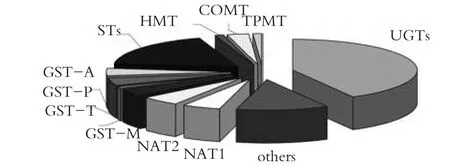
图1 Ⅱ相酶系中的各种酶的比例分布
1.1 GST[4,5]
GST(EC 2.5.1.18)是一个同源二聚体酶的超基因家族,是普遍存在于各种生物体内的Ⅱ相代谢酶,它能催化还原型谷胱甘肽(GSH)与各种亲脂性和亲电子底物的结合反应,且具有广泛的底物专一性,是体内重要的解毒酶系之一。GST几乎在所有的细胞和组织中都有表达,以肝脏、结肠和生殖腺中表达最高。GST的生物学功能主要是减少GSH的酸解离常数,使得其具去质子化作用及有更多的反应性巯基形成,从而催化其与亲电性物质轭合。环境中许多化学致癌物(如多环芳烃类化合物)和烷化剂等化疗药物均为亲电性物质。所以,GST既能代谢化学致癌物,以保护机体,又能使机体产生耐药性。综观GST的作用主要有:(1)催化GSH的巯基攻击亲电性物质的亲电中心,产生一种硫醚连接的谷胱甘肽结合物,经肾排出体外。(2)以高亲和力直接结合胆红素、甾醇和其它亲脂性物质。(3)某些GST具有GSH过氧化酶活性,即具有抑制脂质过氧化作用。可见,GST在生物体内主要以一种解毒酶的形式出现。不过,近几年的研究也发现,GST同工酶对一些底物具解毒作用(如1,2-环氧3-丙烷),而对另一些底物(如乙基二溴化物、亚甲基二卤化物)却能激活其毒性。
1.2 UGT[6,7]
UGT(EC 2.4.1.17)是化学物质在生物体内进行第Ⅱ相生物转化时最重要的一种微粒体酶。UGT广泛分布于机体的各种组织,如脑、前列腺、子宫、乳房、胎盘、肾脏等,其中以肝脏中该酶的活性最高。在所有通过Ⅱ相酶代谢的药物中,有大约35%是通过UGT代谢的。该酶能催化葡糖醛酸与大量的内源性化学物质(如胆红素、短链脂肪酸、胆汁酸和脂溶性的维生素等)和外源性化学物质(如药物、致癌物、杀虫剂等)进行葡糖醛酸结合反应,以羟基、羧基、磺基、羰基、氨基酸化合物为底物,把亲脂性分子转化为亲水性物质,增加转运入排泄器官的量,并且更有效地从尿或胆汁中排除出体外,这也是机体的一个解毒的过程。它能导致代谢物失活,修饰毒物的药理活性,然而越来越多的证据表明葡糖醛酸化也可导致底物生物活性的增加。此外,UGT在代谢类固醇和甲状腺激素的过程中也表现出了重要的生理作用。同时,它也能参与大脑中糖脂的生物合成以及芳香类物质的消除。由于UGT能对许多药物进行代谢,近年来还被广泛应用于抗肿瘤药的代谢研究当中。
2 中药对GST和UGT的影响
近年来,中药对GST和UGT影响的研究不断深入,已经研究了多种中药有效成分、中药或其提取物以及中药复方对多种GST和UGT亚型的影响。
2.1 中药有效成分对GST和UGT的影响
在现有的中药对GST和UGT影响的研究中,对中药有效成分的研究还是比较多的,其中黄酮类成分[8]因多是药食兼用,所以对GST和UGT影响的研究最多,其次生物碱、醌类、苷类等对GST和UGT影响的研究也有报道。Ueng YF等[9]研究了黄芩中的主要黄酮黄芩素和汉黄芩素在C57BL/6J鼠体内对UGT和GST的影响。结果显示二者都能抑制肝肾内UGT的活性,对细胞质内GST的活性没有影响,也显示出二者均能调节药物代谢酶,且调节也具有组织特异性。Sridar C等[10]研究水飞蓟素时发现,水飞蓟素能抑制重组UGT 1A1、1A6、1A9、2B7、2B15催化的7-羟基-4-三氟胸苷的葡萄糖醛酸化,是UGT 1A1潜在的抑制剂,对1A1的抑制强度是1A9的14倍,是1A6的20倍。
肖希斌等[11]研究甲基莲心碱(Nef)时发现,Nef在清除细胞内氧自由基的同时减轻了细胞的氧化应激状态,此过程很可能下调了细胞内GSH相关酶系统的表达,使细胞合成GSH减少,下调GST-π的转录与表达,从而增强肿瘤细胞对药物的敏感性。Fujisaki H等[12]研究发现,马钱子碱和番木鳖碱能轻微增加1-氯-2,4-二硝基苯引起细胞质中GST的活性,且很明显;也能增加4-硝基苯酚引起的微粒体中UGT的活性。然而,其却没有诱导4-羟基联苯引起的UGT的活性,吗啡的3位葡糖醛酸化也没有被增强也支持了这个数据。提示马钱子碱和番木鳖碱对UGT的作用机制不同于苯巴比妥的诱导作用。
杨秀芬等[13]研究发现,丹参酮能显著增加大鼠肝脏的GST活性,但肾微粒体和肺S9部分的GST活性没变化;马世玉等[14]的研究也证实了这一点,丹参酮能诱导大鼠肝微粒体GST的活性升高,但肾微粒体的GST活性没显著影响,表明丹参酮对GST的作用具有组织特异性。但Ueng YF等[15]通过研究发现,丹参酮中有效成分丹参酮ⅡA对UGT和GST均无显著影响。袁靖等[16]研究了虎杖苷对肝脏药物代谢酶的影响,发现小鼠连续多次灌服虎杖苷后可显著提高其肝脏蛋白质含量,肝指数、肝微粒体细胞色素P450、b5含量和NADPH细胞色素c还原酶活性未见明显变化,肝GST和UDPGT活性显著下降。得出了虎杖苷对小鼠肝微粒体Ⅰ相酶没有明显作用,但抑制Ⅱ相酶UGT和GST的结论。Kang JJ等[17]的研究发现,京尼平苷能引起肝重比增加11%,增加总谷胱甘肽60%,增加细胞质中GST活性40%。Kuo WH等[18,19]的研究发现,京尼平苷对GST的诱导呈剂量和时间依赖性,能诱导增加GST M1和GST M2的蛋白水平,对GSTA1效果不明显。
2.2 中药及其提取物对GST和UGT的影响
Ueng YF等[20]对吴茱萸的水提物和醇提物对酶的影响进行了研究,发现在吴茱萸的甲醇提取物能提高肝脏中UGT和GST的活性,吴茱萸的水提物能提高UGT的活性而不影响GST的活性;2种提取物对肾脏中UGT和GST的活性均无显著影响。Chang KT等[21]研究发现,穿心莲的乙醇提取物和乙酸乙酯提取物均呈剂量依赖地诱导大鼠原代肝细胞中GST-π蛋白和mRNA的表达,穿心莲的主要有效成分穿心莲内酯也有同样的作用。认为这种诱导效应可能与PI3K/Akt途径有关,GSTP enhancer 1对诱导也是重要的。Gum SI等[22]研究发现,人参水提物能通过酶诱导的Nrf2/ARE途径显著增加GST A2、A3、M2的基因表达,由于代谢调节的结果(既有代谢酶活化的抑制也有亲电子解毒的增强)导致有效的对抗苯并芘诱导的肝毒性,认为人参是一种潜在的化学预防剂。
2.3 中药复方对GST和UGT的影响
Ueng YF等[23]用吴茱萸汤处理C57BL/6J小鼠后,发现对它的肝和肾中UGT和GST的活性均无显著影响。Yao HT等[24]用生脉散处理大鼠后,发现能增加其血浆和肝脏中的谷胱甘肽的水平,但对肝脏和心脏中GST的活性无显著影响。王胜春等[25]观察五灵胶囊对小鼠免疫功能的影响时发现,五灵胶囊能降低戊巴比妥钠诱导升高的GST。
从上面已有的研究中,我们可以看出中药对Ⅱ相药物代谢酶GST和UGT影响的研究,无论从论文数量上还是研究深度上都与中药对细胞色素P450酶影响的研究有很大的差距。中药对细胞色素P450酶影响,研究内容已从测总细胞色素P450酶含量的变化深入到了对具体酶型的影响和对调节通路的研究,而这些内容在中药对Ⅱ相药物代谢酶GST和UGT影响的研究中才刚起步。
3 结语
随着对Ⅱ相药物代谢酶GST和UGT的功能、调控及表达的进一步认识,发现有不少药物都是通过其进行代谢的,还有一些药物对Ⅱ相药物代谢酶GST和UGT有诱导或抑制作用。由于中药成分复杂,一旦抑制或诱导Ⅱ相药物代谢酶GST和UGT的一个或多个亚型,则与其同时或前后序贯使用的同一亚型代谢的其它中、西药物血药浓度就会改变,使其药效降低,甚至导致不良反应增加。在今后的研究中应该多借鉴现代医学的先进方法和技术(如现代分析化学、分子生物学等),先对一种有效成分进行GST或UGT的多种亚型研究,再对同一种药材通过多种提取方法得到的不同组分进行多个亚型的研究,最后研究中药复方对GST和UGT的影响。通过深入研究中药对Ⅱ相药物代谢酶GST和UGT的影响,中药与其它药物相互作用的机制,不但可以促进临床合理用药,还能提高中药使用的有效性和安全性,有助于推动中药研究的现代化进程。
[1]Delgoda R,Westlake AC.Herbal interactions involving cytochrome P450 enzymes:a mini review[J].Toxicol Rev,2004,23(4):239.
[2]刘高峰,郭兴蕾.中药对细胞色素P450调控作用的研究进展[J].中草药,2008,39(1):139.
[3]吴 慧,陈作忠,彭向前,等.复方丹参滴丸对人肝脏药物代谢酶CYP 1A2活性的影响[J].中国药房,2008,19(15):1 182.
[4]Hayes JD,Flanagan JU,Jowsey IR.Glutathione transferases[J].Annu Rev Pharmacol Toxicol,2005,45:51.
[5]陈丽君.谷胱甘肽S-转移酶基因家族的研究进展[J].皖南医学院学报,2003,22(2):144.
[6]郑水莲,李 新,曾 苏.尿苷二磷酸葡醛酸转移酶的代谢类型及影响因素[J].中国药理学与毒理学杂志,2005,19(1):75.
[7]彭金咏,栾连军.尿苷二磷酸葡萄糖醛酸转移酶的研究进展[J].中国现代应用药学杂志,2002,19(5):373.
[8]Moon YJ,Wang X,Morris ME.Dietary flavonoids:effects on xenobiotic and carcinogen metabolism[J].Toxicol In Vitro,2006,20(2):187.
[9]Ueng YF,Shyu CC,Lin YL,et al.Effects of baicalein and wogonin on drug metabolizing enzymes in C57BL/6J mice[J].Life Sci,2000,67(18):2 189.
[10]Sridar C,Goosen TC,Kent UM,et al.Silybin inactivates cytochromes P450 3A4 and 2C9 and inhibits major hepatic glucuronosyltransferases[J].Drug Metab Dispos,2004,32(6):587.
[11]肖希斌,谢兆霞,秦 群.甲基莲心碱抑制K562/A02细胞GST-π的表达[J].西安交通大学学报(医学版),2005,26(5):428.
[12]Fujisaki H,Mise M,Ishii Y,et al.Strychnine and brucine as the potent inducers of drug metabolizing enzymes in rat liver:different profiles from phenobarbital on the induction of cytochrome P450 and UDP-glucuronosyltrans ferase[J].J Pharmacol Exp Ther,1994,268(2):1 024.
[13]杨秀芬,王乃平,鲁文红,等.银杏叶提取物和丹参酮对细胞色素P450和谷胱甘肽转移酶的影响(英文)[J].中国药理学报,2003,24(10):1 033.
[14]马世玉,李 莉,吴基良,等.丹参酮对大鼠细胞色素P450酶系和谷胱甘肽转移酶的作用[J].咸宁学院学报(医学版),2005,19(1):14.
[15]Ueng YF,Kuo YH,Wang SY,et al.Induction of CYP1A by a diterpene quinone tanshinone IIA isolated from a medicinal herb Salvia miltiorrhiza in C57BL/6J but not in DBA/2J mice[J].Life Sci,2004,74(7):885.
[16]袁 靖,赵军宁,李祖伦.虎杖苷对小鼠肝细胞色素P450和Ⅱ相酶的影响[J].中药药理与临床,2007,23(2):12.
[17]Kang JJ,Wang HW,Liu TY,et al.Modulation of cytochrome P450-dependent monooxygenases,glutathione and glutathione S-transferase in rat liver by genposide from Gardenia jasminoldes[J].Food Chem Toxicol,1997,35(10~11):957.
[18]Kuo WH,Wang CJ,Young SC,et al.Differential induction of the expression of GST subunits by geniposide in rat hepatocytes[J].Pharmacology,2004,70(1):15.
[19]Kuo WH,Chou FP,Young SC,et al.Geniposide activates GSH S-transferase by the induction of GST M1 and GST M2 subunits involving the transcription and phosphorylation of MEK-1 signaling in rat hepatocytes[J].Toxicol Appl Pharmacol,2005,2008(2):155.
[20]Ueng YF,Ko HC,Chen CF,et al.Modulation of drug-metabolizing enzymes by extracts of a herbal medicine Evodia rutaecarpa in C57BL/6J mice[J].Life Sci,2002,71(11):1 267.
[21]Chang KT,Lii CK,Tsai CW,et al.Modulation of the expression of the pi class of glutathione S-transferase by Andrographis paniculata extracts and andrographolide[J].Food Chem Toxicol,2008,46(3):1 079.
[22]Gum SI,Jo SJ,Ahn SH,et al.The potent protective effect of wild ginseng(Panax ginseng C.A.Meyer)against benzo[alpha]pyrene-induced toxicity through metabolic regulation of CYP1A1 and GSTs[J].J Ethnopharmacol,2007,112(3):568.
[23]Ueng YF,Don MJ,Peng HC,et al.Effects of Wu-chuyu-tang and its component herbs on drug-metabolizing enzymes[J].Jpn J Pharmacol,2002,89(3):267.
[24]Yao HT,Chang YW,Chen CT,et al.Shengmai San reduces hepatic lipids and lipid peroxidation in rats fed on a high-cholesterol diet[J].J Ethnopharmacol,2008,116(1):49.
[25]王胜春,胡咏武,李剑锋,等.复方中药五灵胶囊对小鼠免疫功能的影响[J].第四军医大学学报,2002,23(16):1 518.
