2株中国红豆杉内生细菌代谢产抑菌活性物质的研究
2010-08-27赵赟鑫刘开辉邓百万陈文强耿直李娟花
赵赟鑫, 刘开辉,2, 邓百万*.2, 陈文强,2, 耿直, 李娟花
(1.陕西理工学院生物科学与工程学院,陕西汉中723001;2.陕西省食药用菌工程技术研究中心,陕西汉中 723001)
2株中国红豆杉内生细菌代谢产抑菌活性物质的研究
赵赟鑫1, 刘开辉1,2, 邓百万*1.2, 陈文强1,2, 耿直1, 李娟花1
(1.陕西理工学院生物科学与工程学院,陕西汉中723001;2.陕西省食药用菌工程技术研究中心,陕西汉中 723001)
自秦巴山区野生中国红豆杉(Taxus chinensis)中分离的25株内生细菌中筛选出2株具有较广抑菌活性的菌株TC-3和TC-2,通过生物学特征研究和16S rDNA序列分析,初步鉴定为B acillus sp.和B acillus subtilis。在排除酸性产物和过氧化氢的干扰后,TC-3和TC-2菌株发酵上清液对金黄色葡萄球菌(Staphyloccocus aureus)、枯草芽孢杆菌(B acillus subtilis)等革兰氏阳性菌和大肠杆菌(Escherichia coli)等革兰氏阴性菌具有较好的抑菌作用,而且对部分真菌也有抑菌作用;经胰蛋白酶、胃蛋白酶和蛋白酶K处理后发酵液抑菌活性略有下降,表明该活性物质为非蛋白成分,或起抑菌作用的非单一物质。该活性物质不同于一般细菌素,属于类细菌素。它具有很好的热稳定性,在酸性条件下稳定且活性高,对蛋白酶敏感性低,且具有较广的抗菌谱。
红豆杉;内生细菌;抑菌;活性物质
红豆杉为红豆杉科(Taxaceae)红豆杉属(Taxus L.)植物总称。全世界有11种,分布于北半球的温带至热带地区[1]。中国有4种和1种变种:东北红豆杉(T.cuspidataSieb.et Zucc.)、云南红豆杉(T.yunnanensisChang et L.K.Fu)、西藏红豆杉(T.wallichianaZucc.)、中国红豆杉(T.chinensisRehd.)、南方红豆杉(T.chinen sis var.maireiChang et L.K.Fu)[2]。
自从美国化学家Wall和Wani MC首先从太平洋紫杉(短叶红豆杉T.brevif oliaNutt.)中分离出紫杉醇(Taxol)并于1971年发表其化学结构[3],Schiff等证实紫杉醇具有独特的抗癌机制[4], 80年代美国和欧洲的科学家相继揭示出紫杉醇的抗癌疗效[5]。1993年,美国Montana州大学植物病理系的Stierle博士等[6]从短叶红豆杉(T.brevif oliaNutt.)的韧皮部中分离得到一种能产生紫杉醇的内生真菌安德鲁紫杉菌(Taxomyces andreanae),目前有关红豆杉内生菌的研究主要集中在内生真菌方面[7],有关红豆杉内生细菌方面的研究报道尚少。
植物内生细菌是指能定殖在健康植物组织内,并与植物建立了和谐关系的一类微生物。内生细菌可以很容易地穿过植物皮层进入木质部导管中,随着植物的生长可以将内生细菌运送到植物上部营养器官或繁殖器官中。植物内生细菌资源丰富,应用前景广阔,是抗菌药物研究和开发的宝贵资源。目前,从植物内生细菌中分离得到的抗菌活性物质结构类型多样,主要有萜类及其皂苷、生物碱类、芳香类、甾体类、肽类等,产生的活性物质可用于抗癌、生防、抗菌等领域[8]。
随着细菌素研究的不断深入,一些不符合或不完全符合细菌素定义的拮抗物质被陆续报道[9-12]。人们把这类物质称为类细菌素(bacteriocin-like substance)[10]。类细菌素通常具有一些特性,如较宽p H稳定范围,可抑制G-菌和真菌等[9]。这些特性决定了类细菌素具有比细菌素更为广泛的应用前景。近年来,对类细菌素的研究越来越多地受到人们的重视。关于类细菌素国外已有研究[9~12],而国内尚未见报道。作者从自行分离的多株细菌中筛选出2株具有较广抑菌活性的菌株TC-2和TC-3,经鉴定为芽孢杆菌并对其产生的类细菌素的生物学特性和抑菌活性进行了研究,旨在为生物机体调节肠道微生态,食物防腐和医药领域等研究提供一定理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 内生细菌TC-2和TC-3:分离自秦巴山区野生中国红豆杉(Taxus chinensisRehd.);抑菌谱所用菌:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(B acillus subtilis)、棉花黄萎病菌(Verticillium dahliae)、油菜核病菌(Sclerotinia sclerotiorum)、黑曲霉(Aspergillus niger)、灰绿青霉(Penicillium glaucum)等,均由作者所在实验室保藏。
1.1.2 培养基 PDA培养基:马铃薯200.0 g,葡萄糖20.0 g,KH2PO45.0 g,MgSO4·7H2O 3.0 g,VB110.0 mg,琼脂18.0 g,H2O加至1 000 mL。用于菌种保藏斜面、形态观察平板、菌种鉴定培养基;发酵培养液:马铃薯200.0 g,葡萄糖20.0 g, KH2PO45.0 g,MgSO4·7H2O 3.0 g,VB110.0 mg,(N H4)2SO43.0 g,蛋白胨3.0 g,酵母粉0.8 g,加H2O至1 000 mL。用于菌种发酵液培养;LB (Lusia-Bertani)液体培养基:细菌培养用的酵母提取物(yeast extract)5.0 g,细菌培养用的胰蛋白胨(bacto peptone)10.0 g,NaCl 10.0 g,H2O至1 000 mL。
1.1.3 试剂 TE缓冲液:Tris-HCl(p H 8.0)10.0 mmol/L,EDTA 1.0 mmol/L;RNase A溶液: RNase A 10.0 mg/mL,Tris-HCl(p H 7.5)10.0 mmol/L;5×TBE缓冲液:Tris 54.0 g,硼酸27.5 g,EDTA 0.01 mmol/L,p H 8.0;6×DNA上样缓冲液:溴酚蓝0.25%,甘油30.0%;蛋白酶K缓冲液:Tris-HCl(p H 7.5)50.0 mmol/L,CaCl210.0 mmol/L,内含50.0μg/mL蛋白酶K;胰蛋白酶缓冲液:Tris-HCl(p H 8.0)50.0 mmol/L,CaCl210.0 mmol/L,内含50.0μg/mL胰蛋白酶;胃蛋白酶缓冲液:NaCl 0.2%,HCl(p H 3.0),内含50.0μg/mL胃蛋白酶,等。
1.1.4 主要仪器与设备 旋转蒸发仪:RV-10, IKA),双层恒温干燥培养振荡器(ZHWY-2102C),低速冷冻离心机(KDC-2046),超低温冰箱(MDFU5410,SAN YO),超级恒温水浴锅(HH-6),p H计(PHS-3E),PCR仪:Model 680型,BIO-RAD,电泳仪(EPS300),高级研究显微镜:E600型,Nikon公司产品,凝胶成像系统:UVIDB T208,BIO-RAD),等。
1.2 方法
1.2.1 内生细菌的分离筛选 将刚采集到的新鲜野生中国红豆杉树枝用刀切去损伤及污染严重部位,采用软毛刷刷洗,在自来水上冲洗1 d,吸水纸吸干后,消毒时用体积分数75%乙醇漂洗,采用体积分数0.1%~0.2%HgCl2浸5~10 min,或体积分数2%NaClO溶液浸10~15 min,然后以无菌水冲洗2~3次,用无菌滤纸吸干水后,在无菌条件下剥下树皮并切成小块,接种于PDA平板上,培养5~7 d,待树皮周围产生细菌菌落时,及时将其挑取于PDA斜面培养并保藏。用CaCO3中和酸法初筛,牛津杯琼脂扩散法[13]检测被测菌斑周围是否形成抑菌圈,来判断被检菌能否产生抑菌物质。
1.2.2 内生细菌的分类鉴定 进行形态结构和培养特性观察,在显微镜下对其形状、大小、排列方式、细胞结构(包括鞭毛、芽孢)及染色特性进行观察,在固体培养基上,观察菌落大小、形态、颜色、光泽度、透明度、质地、隆起形状、边缘特征及迁移性等,在液体培养中的表面生长情况(菌膜、环)混浊度及沉淀等。同时进行糖酵解试验、淀粉水解试验、硝酸盐还原试验、接触酶反应等生理生化试验进一步鉴定。
采用盐析法提取细菌总DNA,接种菌落于5.0 mL LB中,30℃培养过夜;取1.0 mL种子培养液接入100 mL 2%LB中,37℃、220 r/min培养16 h;5 000 r/min离心10 min,弃去上清液;加入10 mL TE离心洗涤后,用10.0 mL TE溶解菌体,混匀, -20℃保存备用;取3.5 mL菌悬液,加入184.0μL 10%SDS,混匀,加入37.0μL10.0 mg/mL蛋白酶K,混匀,37℃温育1h;加入终浓度2.0 mg/mL的溶菌酶,37℃温育1 h;加入66.0μL 5.0 mol/L NaCl,混匀充分,12 000 r/min 10 min,上清液用粗枪头取至新管;等体积酚充分混匀,12 000 r/min 3 min,反复抽提至无蛋白层;取水层,等体积CHCl3混匀,12 000 r/min 3 min;上清液移至新管,2倍体积预冷无水乙醇,-20℃,20 min,14 000 r/min,15 min;400.0μL 70%冷乙醇洗涤,干燥,100.0μL 20.0μg/mL RNaseA,37℃,30 min;2倍体积无水乙醇沉淀,体积分数70%冷乙醇洗涤,干燥,溶于100.0μL TE。
以细菌通用引物8F(5′-3′):A GAGTTTGA TCCTGGCTCAG和1492R(5′-3′):GGTTACCTTGTTACGACTT扩增TC-2和TC-3的16S rDNA序列。PCR反应体系:DNA模板约30.0 ng,10×PCR缓冲液2.0μL,25.0 mmol/L MgCl22.0μL,10.0 mmol/L的8F和1492R各1.0μL, dNTPs(10.0 mmol/L)0.5μL,Taq DNA聚合酶(5.0 U/μL)0.5μL,加灭菌双蒸水至20.0μL。PCR反应条件:94℃5 min;94℃60 s,50℃80 s, 72℃100 s,35个循环;72℃15 min。用1.5 g/dL的琼脂糖凝胶于电压100V水平电泳1h检测分析PCR产物,纯化的PCR产物由上海生工生物技术服务有限公司进行双向测序。
将所测序列提交到GenBank数据库中并进行Blast检索,下载同源性较高的数据,生成Fasta格式的文件。用Clusta-X软件对所得序列进行人工校正及比对分析[14]。利用Mega3.1[15]软件构建系统发育树[16],将所测序列提交到GenBank数据库中并进行Blast检索,下载同源性较高的数据,生成Fasta格式的文件。用Clusta-X软件对所得序列进行人工校正及比对分析。利用Mega3.1软件构建系统发育树。
1.2.3 抑菌活性的研究 取培养过夜的细菌TC-2和TC-3菌液,以体积分数1%的接种量接入500.0 mL的发酵培养液,在28℃、180 r/min的摇床培养6 d,然后在低速冷冻离心机以10 000 r/min离心10 min,得发酵液上清液。将500.0 mL上清液通过旋转蒸发仪浓缩定容至100.0 mL。
采用牛津杯琼脂扩散法[13],首先排除酸性干扰和过氧化氢干扰,其次以E.coli为指示菌,对其热稳定性、p H稳定性、蛋白酶敏感性进行研究,最后选用革兰氏阳性细菌、革兰氏阴性细菌、部分真菌作为检测的指示菌,以确定其抑菌谱。
在抑菌圈平均直径测定中,每个实验数据平行重复3次。在热稳定性研究、p H稳定性研究中,以未经处理的发酵液为对照,活性下降百分率=(对照抑菌圈平均直径-处理后抑菌圈平均直径)/对照抑菌圈平均直径×100%。
2 结果与分析
2.1 内生细菌的分离筛选
采用平板稀释法,从秦巴山区野生红豆杉中分离纯化得到25株内生细菌。通过牛津杯琼脂扩散法,筛选到两株抑菌活性较好的菌株,编号为TC-2和TC-3。
2.2 内生细菌的分类鉴定
2.2.1 生物学特性 对其形态结构、培养特征及生理生化性质测定表明:TC-2菌体细胞呈杆型,单个排列,革兰氏阳性,运动,鞭毛侧生,有芽孢,孢子椭圆,中生;菌落圆形,表面色暗,不透明,起皱,褐色;在培养液中色较暗、皱褶,轻度混浊;发酵葡萄糖、麦芽糖和葡萄糖酸钠产酸,发酵葡萄糖、葡萄糖酸钠不产气,接触酶阳性,淀粉水解阳性,硝酸盐还原阳性,生长温度15~45℃。根据TC-2的形态生长特征和生理生化特性,参照《伯杰氏细菌鉴定手册》(第九版)[17],初步鉴定为芽孢杆菌属。
TC-3菌体细胞呈杆型,链状排列,革兰氏阳性,运动,鞭毛侧生,有芽孢,形成内生孢子,孢子椭圆,中生;菌落圆形,表面色淡,不透明,光滑,淡黄色;在培养液中色较暗,轻度混浊;发酵葡萄糖、麦芽糖和葡萄糖酸钠产酸,发酵葡萄糖、葡萄糖酸钠不产气,接触酶阳性,淀粉水解阴性,硝酸盐还原阴性,生长温度10~45℃。根据TC-3的形态生长特征和生理生化特性,参照《伯杰氏细菌鉴定手册》(第九版)[17],初步鉴定为芽孢杆菌属。
2.2.2 系统发育分析 对内生细菌菌株TC-2和TC-3的部分16S rDNA基因进行测序,所得序列同GenBank数据库进行比对分析,构建N-J系统发育树(见图1)。菌株TC-2(登录号:GQ461727)同数据库中B acillus subtilis的已知菌株序列同源性均≥99%。在进化树中,该菌株同B.subtilis类聚于同一分支,步长为87,结合形态特征菌株TC-2为B.subtilis,TC-2。菌株TC-3(录号:GQ461728)分别和B acillus属的不同种的序列同源性≥99%,步长为99,该菌株TC-3初步确定为B acillussp., TC-3。
2.3 抑菌活性的研究
2.3.1 抑菌谱 选用革兰氏阳性细菌,革兰氏阴性细菌,真菌作为检测的指示菌,牛津杯法测定各指示菌的抑菌作用,以确定其抑菌谱,见表1。
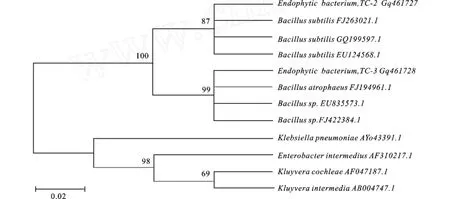
图1 内生细菌的16S rDNA系统发育树Fig.1 The phylogenetic tree of the endophytic bacteria,based on 16S rDNA sequences analysis
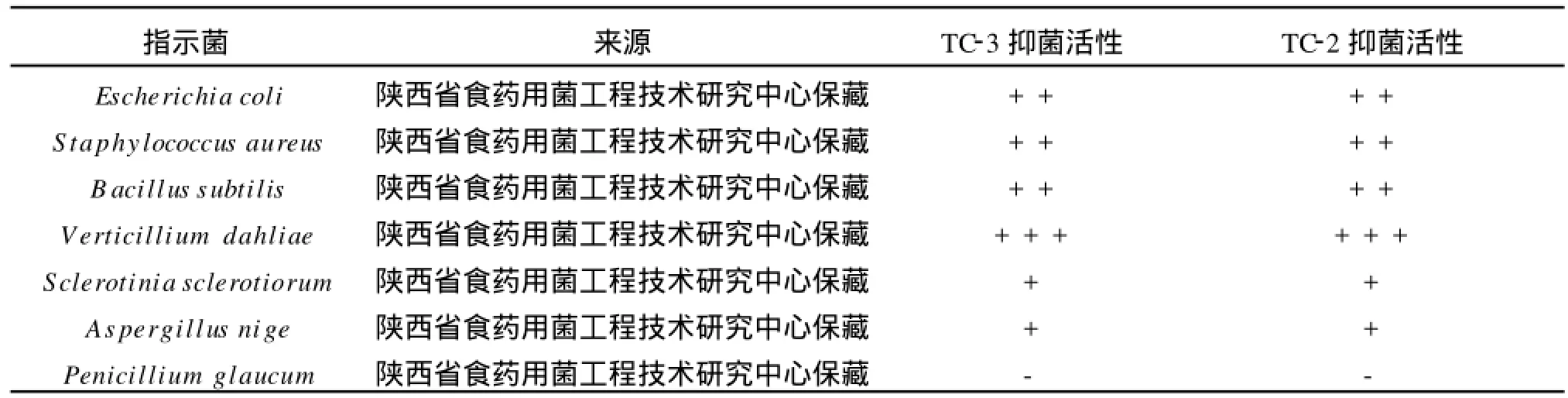
表1 抑菌谱Tab.1 Antibacterial spectrum
表1表明,TC-3和TC-2产生的活性物质对棉花黄萎病菌(Verticillium dahliae)的抑菌效果最好,对油菜核病菌(Sclerotinia sclerotiorum)、黑曲霉(Aspergillus niger)也有一定的抑菌效果,其次对大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)在内的常见食源性和人畜共患病的病原菌表现出良好的抑菌活性。由此, TC-3和TC-2产生的活性物质不仅对革兰氏阳性菌有抑制作用,更重要的是能够抑制革兰氏阴性菌,而且对部分真菌也有抑菌作用。
1)酸性末端产物干扰的排除 细菌TC-3和TC-2发酵液对指示菌的抑制作用,可能是酸性末端产物如乙酸、乳酸及其他有机酸作用的结果。为了排除酸性末端产物的干扰,将培养48 h的发酵液离心,取上清液,中和至p H 5.0,以大肠杆菌为指示菌进行抑菌试验,以p H 5.0的乳酸和乙酸为对照,重复3次(见表2)。

表2 排除酸作用的抑菌试验结果Tab.2 Results of inhibition test without the effect of organic acid
表2表明,p H值为5.0的乳酸和乙酸均不能抑制指示菌的生长,而p H值为5.0的TC-3和TC-2发酵上清液对指示菌仍然具有强烈的抑制作用。由此,TC-3和TC-2发酵液中存在除酸以外的其他抑菌物质。
2)发酵液中过氧化氢的检测 细菌代谢产生的过氧化氢也可能抑制细菌的生长,尤其是抑制革兰氏阴性菌的生长,因此必须排除过氧化氢的干扰。取1.0 mL发酵上清液,加入10.0 mg/mL的过氧化氢酶液1.0 mL,在30℃水浴反应60 min,之后,用处理过的发酵液进行抑菌试验。以大肠杆菌为指示菌,以未经过氧化氢酶处理的发酵上清液为对照,重复3次。

表3 排除过氧化氢作用的抑菌试验结果Tab.3 Results of inhibition test without the effect of hydrogen peroxide
表3表明,经过氧化氢酶处理的TC-3和TC-2发酵液的抑菌作用几乎没有变化。由此,TC-3和TC-2发酵上清液的抑菌作用不是过氧化氢作用的结果。
2.3.2 代谢产物稳定性分析
1)热稳定性 将TC-3和TC-2发酵液在不同温度下保持20 min,以大肠杆菌为指示菌,以未经处理的发酵液为对照,做抑菌试验。
表4表明,随着处理温度的不断升高,TC-3和TC-2发酵液的抑菌活性不断下降,但是发酵液经105℃处理20 min后,仍保留有抑菌活性。说明TC-3和TC-2具有较好的热稳定性。
2.3.3.2 p H稳定性 将TC-3和TC-2发酵液用1.0 mol/L的HCl和2.0 mol/L的NaOH调至不同的p H(3.5、4.0、4.5、5.0、5.5、6.0、6.5),然后用牛津杯法,以E.coli为指示菌做抑菌试验,重复3次(见表5)。
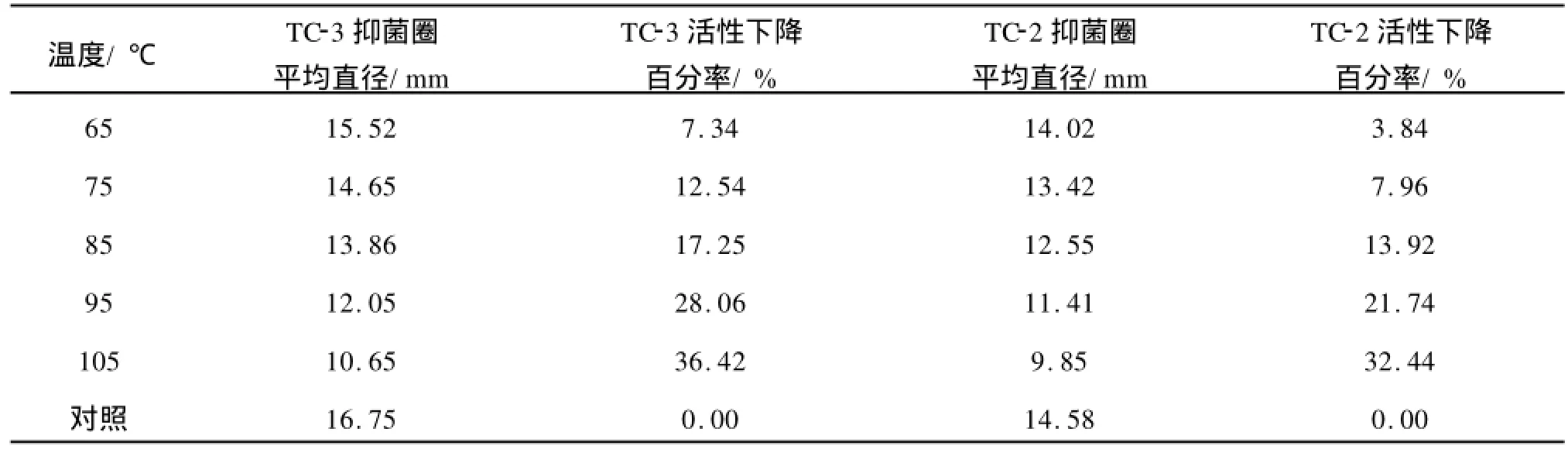
表4 抑菌活性物质的热稳定性Tab.4 Heating stability of the inhibitory substance

表5 抑菌活性物质的pH稳定性Tab.5 The pHstability of the inhibitory substance
表5表明,TC-3和TC-2的抑菌活性随着p H的升高而下降,当p H为6.0以上时抑菌活性消失。说明TC-3和TC-2在酸性条件下稳定,显示抑菌活性的p H为3.5~5.5。
3)蛋白酶敏感性 各取TC-3和TC-2的3份等量(1.0 mL)的发酵上清液,用1.0 mol/L的HCl和2.0 mol/L的NaOH调节p H为胰蛋白酶、蛋白酶K和胃蛋白酶作用的最适p H值(分别为7.6, 7.6,2.0),按1.0 mg/mL加入各酶解液,在37℃下预温1 h,再将p H调回类细菌素的最适p H,以E-.coli为指示菌做抑菌试验,重复3次,并设对照(见表6)。

表6 抑菌活性物质的蛋白酶敏感性Tab.6 Sensitivity to proteinases of the inhibitory substance
表6表明,经胰蛋白酶、蛋白酶K和胃蛋白酶处理后,TC-3和TC-2抑菌圈直径略有减少,但仍具有很明显的抑菌作用,从而表明了该活性物质为非蛋白组分,或者起抑菌作用的不是单一的物质,关于其具体成分还有待进一步研究。
3 结 语
自Strobel等[6]从短叶红豆杉中分离得到1株产紫杉醇的内生真菌以来,红豆杉内生菌的研究已成为国内外学者研究的一个热点,许多内生真菌相继被分离得到。目前,国内有关红豆杉内生细菌的研究报道较少。本研究从中国红豆杉茎中分离得到内生细菌TC-3、TC-2,生物学特性和16S rDNA序列分析表明分别属于芽孢杆菌属细菌。
细菌在代谢过程中产生的有机酸、过氧化氢以及细菌素或者抗生素类物质都具有抑菌活性。为了排除这些非类细菌素的抑菌作用,通过对照试验证明了发酵液中存在有除有机酸和过氧化氢以外的其他活性物质。该活性物质具有耐高温,在酸性条件下稳定且活性高,对蛋白酶敏感性低,且对G-菌有明显的抑制作用,这些特征与一般细菌素的特性明显不同,而与已报道的类细菌素相近。Talarico等[18]报道1株乳酸菌能够产生一种非细菌素的广谱抑菌物质,该物质对G+菌及G-菌、真菌都具有明显的抑制作用。Coconnier等[19]发现一种对热稳定、对蛋白酶敏感性低、低相对分子质量、对G+菌及G-菌都具有抑菌活性的抑菌活性物质,且在酸性条件下活性更高。类细菌素物质性质各异,结构组成复杂。根据此研究活性物质的性质,初步判断为非蛋白组分,或起抑菌作用的不是单一物质,有关分离纯化发酵液中的主要成分及其性质的进一步研究、该代谢产物抑菌活性与红豆杉中紫杉醇的抗癌疗效的关系正在进行之中。
植物内生细菌与宿主植物在长期协同进化过程中,对宿主植物具有许多生物学作用,如促进植物对恶劣环境的适应,拮抗环境中病原微生物的侵袭等[7]。本研究的类细菌素具有较宽的抑菌谱,能够一直包括大肠杆菌、金黄色葡萄球菌在内的常见食源性和人畜共患病的病原菌。因此,在生物机体调节肠道微生态、食物防腐和医药领域等具有一定的应用潜力。
[1]侯宽昭.中国种子植物科属词典(修订版)[M].北京:科学出版社,1982.481.
[2]中国科学院植物研究所编辑委员会.中国植物志第七卷[M].北京:科学出版社,1978.438-443.
[3]Wani M C,Taylor H I,Wall M E,et al.Plant antitumor agents VI:the isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus brevifolia[J].Am Chem Soc,1971,93(9):23-25.
[4]Schiff P B,Fant J,Horwitz SB.Promotion of microtubule assembly in vitro by taxol[J].Nature,1979,277:665-667.
[5]梅兴国,鲁明波.紫杉醇的抗癌作用及治疗其它疾病的潜力[J].国外医学药学分册,1996,23(3):136-140.
MEI Xing-guo,LU Ming-bo.Anti-cancer effect of taxol and the potential for treatment of other diseases[J].Foreign Medical Sciences Section On Pharmacy,1996,23(3):136-140.(in Chinese)
[6]Strobel G A,Stierle A,Stierle D,et al.Taxomyces andreanae,a proposed new taxon for a bulbilliferous hyphomycete assotiated with Pacific yew[J].Mycotaxon,1993,XL(VII):71-78.
[7]李强,刘军,周东坡,等.植物内生菌的开发与研究进展[J].生物技术通报,2006,3:33-37.
LI Qiang,LIU Jun,ZHOU Dong-po,et al.Advance on exploitation and research of endophyte[J].Biotechnology Bulletin,2006,3:33-37.(in Chinese)
[8]周东坡,平文祥,孙剑秋,等.紫杉醇产生菌分离的研究[J].微生物学杂志,2001,21(1):18-20. ZHOU Dong-po,PING Wen-xiang,SUN Jian-qiu,et al.Separation of Taxol-producing bacteria[J].Journal of Microbiology,2001,21(1):18-20.(in Chinese)
[9]Virginia S O,Aida A P,Maria E N.Characterization of a bacterioncin-like substance produced by a vaginal Lactobacillus salivarius strain[J].Appl Environ Microbiol,1999,65(5):5631-5635.
[10]Whitford M F,Mc Pherson M A,Forster R J.Idengtification of bacteriocin-like inhibitors from rumen Streptococcus spp.And isolation and characterization of bovicin 255[J].Appl Environ Microbiol,2001,67(2):569-574.
[11]Renate P Schobitz,Pamela A Borquez.Bacteriocin-like substance production by Carnobacterium piscicola in a continuous system with three culture broths study of antagonism against Listeria monocytogenes on vacuum packaged salmon[J]. Brazilian Journal of Microbiology,2006,37(1):52-57.
[12]Konisky J.Colicins and other bacteriocins with established modes of action[J].Annu Rev Microbiol,1982,36:125-144.
[13]Thompson JD,Gibson TJ,Plewniak F.The Clustal X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Res,1997,24:4876-4882.
[14]Kumar S,Tamura K,Nei M.MEGA3:integrated software for molecular evolutionary genetics analysis and sequence alignment[J].Brief Bioinform,2004,5:150-163.
[15]Saitou N,Nei M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].Mol Biol Evol, 1987,4:406-425.
[16]Casla D,Requena T,Gomez R.Antimicrobial activity of lactic acid bacteria isolated from goats,milk and artisanal cheeses:characteristics of a bacteriocin produced by Lactobacillus curvatus IFPL105[J].Appl Bacteriology,1996,81(1):35 -41.
[17]Sicanan RE,Gibbs N E.Berger Manual Determinative Bacteriology(9th edition)[M].Beijing:Science Press,1997.741 -770.
[18]Talarico T L,Dobrogosz W J.Chemical characterization of an antimicrobial substance produced by Lactobacillus reuteri [J].Antimicrob Agents Chemother,1989,33(5):647-679.
[19]Coconnier M H,Lievin V,Bernet Camard M F,et al.Antibacterial effect of the adhering human Lactobacillus acidophilus strain LB[J].Antimicrob Agents Chemother,1997,41(5):1046-1052.
(责任编辑:杨萌)
Antibacterial Activities of Metabolites Produced by Two Endophytic Bacteria Isolates in Taxus Chinensis
ZHAO Yun-xin1, LIU Kai-hui1,2, DENG Bai-wan*1,2, CHEN Wen-qiang1,2,
GENG Zhi1, LI Juan-hua1
(1.School of Biological Science and Engineering,Shaanxi University of Technology,Hanzhong 723001,China;
2.Shaanxi Engineering Research Center of Edible and Medicated Fungi,Hanzhong 723001,China)
In this study,two strains,TC-3 and TC-2,identified asB acillus sp.andB acillus subtilisbased on the biological characteristics and 16S rDNA sequence analysis,was screened from 25 isolates of endophytic bacteria from wildTaxus chinensisin Qinba Mountain.Those strain exhibited the ability in producing inhibitory activity substance,Without the effect of organic acid and hydrogen peroxide,supernatant of the liquid culture of TC-3 and TC-2 showed significant inhibitory activity against gram-positive bacteria,including Staphylococcus aureus,B acillus subtilisand gram-negative bacteria such asEscherichia coli.Inhibition of some kind of epiphyte was also found.After treatment with trypsin,pepsin and proteinase K,the culture’s inhibitory activitydecreasedslightly,thisshowedthatitisnon-protein ingredients orantibacterial effect of the non-single material.This indicated it belongs to a kind of bacteriocinlike substance.The inhibitory substance,showed good heating stability,high activity at low p H,low sensitivity to proteinases and a broad antibacterial spectrum.
taxus chinensis,endophytic bacteria,antibacterial,active substance
Q 939.92
:A
1673-1689(2010)04-0617-07
2009-04-25
陕西省重点实验室资助项目(No.08JZ21);陕西省教育厅科研基金项目(No.08J K248,No.08J K244);陕西理工学院科研基金项目(No.SLJQD0712,No.SLJQD0713)。
*通信作者:邓百万(1963-),男,陕西汉中人,教授,主要从事微生物学研究。Email:Dengbw2008@yahoo.com.cn
