PSI诱导 PC12细胞的 PD模型中分子伴侣家族的氧化修饰
2010-08-25杨艺敏胡林森
张 颖, 杨艺敏, 白 晶, 常 明, 胡林森
帕金森病(Parkinson's disease,PD)是一种常见的神经系统变性病。目前,PD的病因和发病机制尚不完全清楚。新近泛素-蛋白酶体系统(ubiquitinproteasome system,UPS)功能障碍及其引起的蛋白水解应激机制备受关注。
UPS是细胞内重要的非溶酶体蛋白降解途径,在许多与增殖和凋亡相关的蛋白质的降解中起重要作用[1]。遗传及散发 PD研究均提示 UPS功能受损可能是不同病因作用的共同途径[2]。文献表明[3],蛋白酶体抑制剂(PSI)处理的细胞模型能较全面地模拟 PD的病理特征,并且与现有的其它模型比较具有诸多优点。故本实验选用 PSI处理的 PC12细胞作为 PD实验模型,在此基础上探讨 PD的发病机制。目前多数学者认为氧化应激在 PD黑质多巴胺能神经元死亡过程中起重要作用。近年来亦有文献表明 UPS功能的损害也可导致自由基的生成及氧化应激[4],这提示有必要在 PSI处理的 PD细胞模型中研究氧化应激的机制。
近年来国外研究者们开始采用蛋白质组学的方法研究氧化修饰蛋白质在神经系统变性病中的作用,但多集中在阿尔茨海默病,在 PD中的研究较少。迄今为止采用蛋白质组学方法在 PD中已鉴定出 3种氧化修饰的蛋白质:UCH-L1、NF-200和GFAP[5]。本实验首先通过 2,4-二硝基苯肼(DNP)的衍生步骤标记含有羰基的氧化蛋白质,而后采用2D凝胶电泳、质谱鉴定与 Western印迹技术相结合的方法在 PD模型中鉴定氧化修饰的蛋白质,期望为进一步研究 PD的发病机制提供新的证据,为 PD治疗药物的研发提供新的候选靶点。
1 材料与方法
1.1 材料与仪器 PC12细胞购自中国科学院上海细胞库。DMEM培养基购自 GiBco公司。吖啶橙购自 Sigma公司。溴化乙啶为 Amresco产品。DNP购自东京化成工业株式会社。抗 DNP一抗购自 Molecular Probe公司。二抗、显色液等购自 Sigma公司。硝纤膜、IPG胶条等均购自 Amersham公司。电泳系统、扫描仪、分析软件和质谱仪均为 Amersham公司产品。ST-Ⅱ型半干转移槽购自大连医科大学分生实验室。
1.2 细胞模型的建立 PC12细胞复苏后,以2×105/ml的密度接种于底面积 25cm2的塑料培养瓶,于 37℃、5%CO2、饱和湿度的培养箱中培养。每2~3d更换一次培养液。选取对数生长期细胞,以 1∶3~1∶4比例传代。24h后更换培养液,实验组加入终浓度 10μmol/L的 PSI(以 DMSO溶解);对照组加入 DMSO,实验组与对照组 DMSO终浓度均为0.1%,继续孵育 24h后收集两组细胞用于进一步实验。MTT法检测细胞存活率;AO和 EB染色观察细胞凋亡的存在;HE染色观察细胞内包含体的形成。
1.3 蛋白样品的制备、一向等电聚焦电泳及IPG胶条的 DNP衍生 提取细胞总蛋白。240μg样品与缓冲液混合后加入胶条槽,13cm、pH3~10的IPG胶条在电泳仪上进行水化及等电聚焦电泳。然后将 IPG胶条在含 20mmol/L DNP的 2mol/L的盐酸溶液中室温孵育 20min,而后在含 30%甘油的2mol/L Tris-Base溶液中洗 15min。
1.4 二向凝胶电泳 将平衡后的 IPG胶条转移至 12.5%SDS-PAGE凝胶(16cm×15cm×1.0 mm)上端,在垂直电泳仪上进行二向电泳。待溴酚蓝距底边约 4cm时停止电泳。
1.5 分析胶进行二维 Western blot染色 将用作分析胶的二向胶电转移至硝酸纤维素膜。以 1∶200的兔抗鼠 DNP抗体作为一抗,4℃过夜孵育。以 1∶10000的羊抗兔碱性磷酸酶偶联抗体作为二抗,室温孵育 1h。以 BCIP/NBT溶液作为显色液,至蓝紫色蛋白点清晰呈现后,以双蒸水终止反应。
1.6 制备胶进行热考马斯亮蓝染色 制备胶于 20%TCA中固定 2h以上。蒸馏水漂洗凝胶20min,加入热考染液,50℃摇床振荡 30min。加入脱色液,50℃摇床振荡脱色,每次 1h,以背景蓝色脱净为止。
1.7 图像分析、统计学处理及质谱鉴定 扫描Western blot及考染的制备胶图像,应用 2D Evolution软件进行分析,以单个蛋白抗-DNP免疫染色强度/制备胶蛋白考染强度来标准化蛋白的氧化水平,对来自 4次重复实验的结果以均数 ±标准差±s)表示,采用 t检验。在制备胶上找到与 Western blot结果相匹配的、有统计学意义的蛋白点,切胶、酶切、点靶及质谱鉴定。
2 结果
2.1 MTT检测结果 10μmol/L PSI作用 24h可显著降低 PC12细胞的存活率,存活率降至85.46%±1.75%(对照组设为 100%),与对照组比较差异有统计学意义(P<0.05)。
2.2 吖啶橙和溴化乙啶染色结果 在显微镜下观察可见,对照组(见图 1A)PC12细胞大小、形态均匀一致,胞膜完整,核染色质着绿色并呈正常结构,偶见早期凋亡细胞,凋亡百分率为 2.13% ±0.86%。实验组(见图 1B)PC12细胞大小、形态不等,胞体变大,胞浆疏松,胞膜发泡,可见早期凋亡细胞,凋亡细胞的核染色质着明亮绿色呈斑块状或圆珠状,凋亡百分率为 12.41%±3.61%,与对照组比较差异显著(P<0.05)。
2.3 HE染色结果 HE染色结果显示,对照组(见图 2A)PC12细胞胞浆嗜酸性染色,胞核嗜碱性染色。实验组(见图 2B)PC12细胞胞体及胞核增大,胞浆内空泡增多,并出现嗜酸性包含体(实心箭头所示),胞核嗜碱性染色(空心箭头所示)。
2.4 蛋白质鉴定结果 制备胶上的蛋白点与Western blot图像匹配较好(见图3)。应用 2D Evolution软件进行分析,两组比较氧化水平有统计学差异的蛋白点共有 40个,而后对这 40个蛋白点进行质谱鉴定。经质谱鉴定,有 13个蛋白点被鉴定出来,其中 3个为分子伴侣家族成员:蛋白点 58被鉴定为含 TCP1的伴侣素亚单位 3(chaperonin contai-ning TCP1,subunit 3,也称为 CCT);蛋白点 73被鉴定为葡萄糖调节蛋白 58(glucose regulated protein 58,GRP58);蛋白点 46被鉴定为热休克蛋白 70(HSC70,亦称为 HSP70)。从考染的制备胶(见图3A和图 3C)可见这 3个蛋白点大致分布在分子量50~70kDa,等电点 5~6之间,蛋白点丰度较高。这3个蛋白点的氧化水平,可见 P值均 <0.05(见表1)。NCBI蛋白质数据库提供的蛋白质的详细信息(见表2)。可见其序列覆盖率均在 10%以上,期望值(错误鉴定的几率)均为 0.000,提示结果可信度较高。葡萄糖调节蛋白 58的肽指纹图谱(见图4)。
表1 对照组与实验组单个蛋白氧化水平比较±s)

表1 对照组与实验组单个蛋白氧化水平比较±s)
*氧化水平:单个蛋白抗-DNP免疫染色强度/蛋白考染强度(n=4)
46 58731.9621±0.31951.3432±0.09102.3496±0.13762.9349±0.50221.8341±0.28113.0054±0.3206-2.8308-2.8777-3.2558<0.05<0.05<0.02

表2 MALDI-TOF质谱鉴定结果
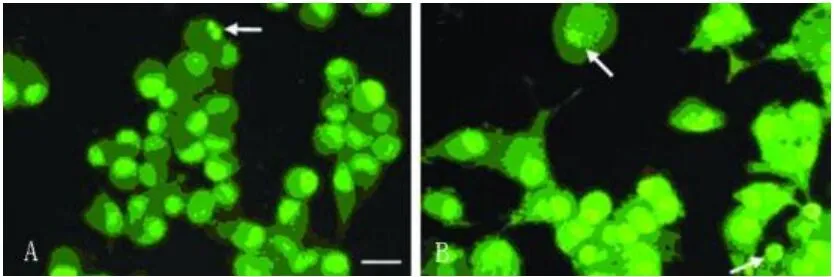
图1 吖啶橙和溴化乙啶染色 ×200标尺:10μm

图2 HE染色 ×200标尺:10μm
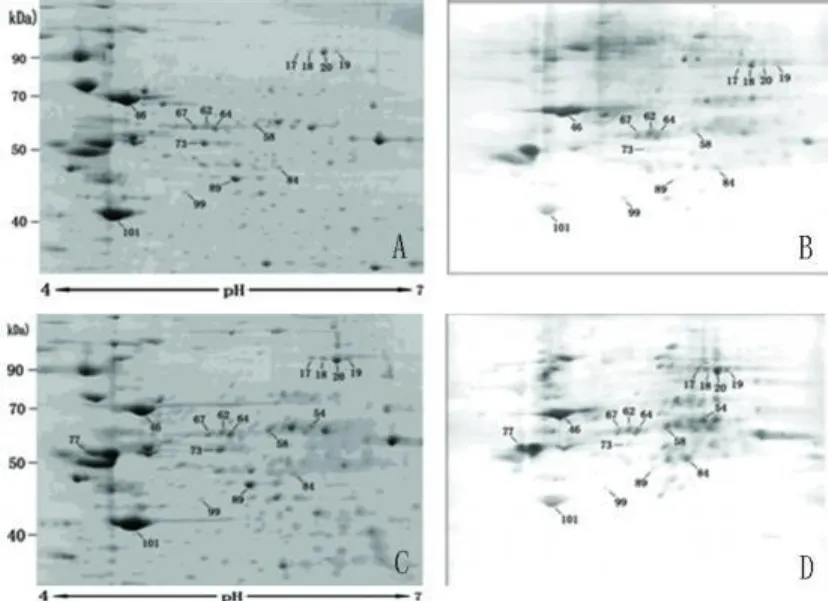
图3 对照组和实验组考染显示的总蛋白及 Western blot显示的氧化蛋白点比对

图4 蛋白点 73(GRP58)的肽指纹图谱
3 讨 论
本实验显示,10μmol/L PSI作用 PC12细胞 24h可很好地模拟 PD的两大基本病理特征,即神经元丧失(凋亡)和神经元内嗜酸性包含体的形成。这为进一步研究 PD发病机制建立了可靠的模型。
本实验前期研究结果发现[6],基础状态下的PC12细胞有 5大类、共 19个蛋白点发生氧化修饰,其中即包括分子伴侣家族成员。此次实验质谱鉴定结果显示,与对照组比较,实验组差异表达的氧化蛋白点中有 3个均被鉴定为分子伴侣家族成员:CCT、GRP58和 HSP70。在细胞内,约 10% ~20%新合成的多肽链需要分子伴侣的帮助才能正确折叠。迄今为止已发现多种神经变性病与错误折叠蛋白质的聚集及沉积有关,如 PD与 AD等。这提示,分子伴侣可能在神经变性病中发挥重要作用。
CCT是迄今为止真核细胞胞浆中发现的唯一一个伴侣素。CCT的主要功能是以 ATP依赖的过程促进新合成的 α-、β-微管蛋白及肌动蛋白的正确折叠[7]。有人认为 CCT参与大约 9%~15%的哺乳动物蛋白的折叠,如细胞周期相关蛋白质 cyclin E等[8]。本研究首次发现 CCT的氧化修饰,也是首次在 PSI处理的 PD细胞模型中发现 CCT的氧化修饰,推测这可能由蛋白酶体功能抑制导致的氧化应激所致。推测 CCT的氧化可能影响其行使正常生物学功能,影响细胞骨架及细胞周期相关蛋白质的正确折叠,这可能有助于解释实验组细胞形态学的改变及凋亡的出现。
GRP58是分子量约 60kDa的应激蛋白。定位于内质网内腔的 GRP58对于蛋白质二硫键的形成是必要的,而二硫键对蛋白质的正确折叠则是必须的。Dennis等[9]的实验表明,过氧化氢可诱导包括GRP58在内的内质网蛋白的氧化修饰。本实验在PSI处理 PC12细胞的 PD细胞模型中发现GRP58被显著地氧化修饰(P<0.05)。推测 GRP58的氧化修饰可能与 PSI抑制蛋白酶体功能导致的氧化应激有关。另外,本实验室李兴安等[10]在同一模型细胞包含体内首次检测到了 GRP58的存在。结合本实验发现 GRP58的氧化修饰,推测发生氧化修饰的GRP58可能引起其功能紊乱,导致自身及其它错误折叠的蛋白质在细胞内聚集,进而对细胞产生毒性作用,这可能有助于解释细胞内包含体的形成及细胞凋亡的出现。
HSP70在正常情况下以较低水平表达,在炎症等应激情况下合成增加,从而减轻不利条件的损害。Castegna等[11]在 AD脑组织中检测到 HSP70的氧化修饰,但在 PD中尚未见 HSP70发生氧化修饰的报道。本实验首次在 PSI处理的 PC12细胞 PD模型中发现 HSP70被显著地氧化修饰(P<0.05)。推测实验组 HSP70自身水平的升高是细胞对蛋白酶体功能抑制的一种防御反应,而升高的起保护作用的HSP70的氧化修饰则可能阻碍其分子伴侣功能的发挥,从而丧失对应激反应的防护作用。
总之,本实验通过蛋白酶体功能的抑制成功地再现了 PD典型的病理特征;采用氧化修饰亚蛋白质组学方法筛查发现分子伴侣家族的氧化修饰。这提示我们在后续的研究中从这些蛋白质入手,进一步深入研究蛋白质的定位、定量、功能等变化,及其与PD包含体形成和细胞凋亡的关系,以期为 PD发病机制的探讨及治疗药物的研发提供新线索。
[1] Pickart CM.Mechanisms underlying ubiquitination[J].Annu Rev Biochem,2001,70:503-533.
[2] McNauqht KS,Olanow CW.Proteolytic stress:A Unifying Concept for the Etiopathogenesis of Parkinson's disease[J].Ann Neurol,2003,53(suppl 3):73-84.
[3] Rideout HJ,Larsen KE,Sulzer D,et al.Proteasomal inhibition leads to formation of ubiquitin/alpha-synuclein-immunoreactive inclusions in PC12 cells[J].J Neurochem,2001,78(4):899-908.
[4] Lee MH,Hyun DH,Jenner P,et al.Effect of proteasome inhibition on cellular oxidative damage,antioxidant defences and nitric oxide production[J].J Neurochem,2001,78(1):32-41.
[5] Choi J,Levey AI,Weintraub ST,et al.Oxidative modifications and down-regulation of ubiquitin carboxyl-terminal hydrolase L1 associated with idiopathic Parkinson's and Alzheimer's diseases[J].J Biol Chem,2004,279(13):13256-13264.
[6] 张 颖,冯加纯,常 明,等.PC12细胞基础状态氧化蛋白质表达谱[J].中风与神经疾病杂志,2006,23(6):687-689.
[7] Gao Y,Thomas JO,Chow RL,et al.A cytoplasmic chaperonin that catalyses beta-actin folding[J].Cell,1992,69(6):1043-1050.
[8] Valpuesta JM,Martin-Benito J,Gomez-Puertas P,et al.Structure and function of a protein folding machine:the eukaryotic cytosolic chaperonin CCT[J].FEBS Lett,2002,529(1):11-16.
[9] Van der Vlies D,Pap EH,Post JA,et al.Endoplasmic reticulum resident proteins of normal human dermal fibroblastsare the major targets for oxidative stress induced by hydrogen peroxide[J].Biochem J,2002,366(Pt3):825-830.
[10] Li X,Zhang Y,Hu Y,et al.Chaperone proteins identified from synthetic proteasome inhibitor-induced inclusions in PC12 cells by proteomic analysis[J].Acta Biochim Biophys Sin(Shanghai),2008,40(5):406-418.
[11] Castegna A,Aksenov M,Thongboonkerd V,et al.Proteomic identification of oxidatively modified proteins in Alzheimer's disease brain.Part II:dihydropyrimidinase-related protein 2,alpha-enolase and heat shock cognate 71[J].JNeurochem,2002,82(6):1524-1532.
