米诺环素对实验性自身免疫性脑脊髓炎大鼠凋亡相关蛋白表达的影响
2010-08-25周建波
周建波, 曾 丽, 梁 活
多发性硬化(Multiple sclerosis,MS)是一种累及中枢神经系统白质,以炎性脱髓鞘为主要特征的神经系统疾病。本疾病因至今尚未完全清楚,一般认为是遗传易感性与环境因素共同作用发生的自身免疫性疾病,近年来发现凋亡也可能参与其发病过程之中[1]。米诺环素是一种脂溶性较高的长效四环素,其组织穿透力强,口服吸收率高。众多研究[2]指出,米诺环素具有广泛神经保护作用,干预凋亡可能是其机制之一。
本研究通过对 MS经典动物模型实验性自身免疫性脑脊髓炎大鼠给予米诺环素进行预防性干预治疗,并对疾病的发病率、发病后神经功能受损的严重程度、中枢神经组织病理变化情况、以及凋亡相关蛋白 Fas和 Bcl-2的表达等指标进行研究分析,探讨米诺环素对 MS的作用和机制,为临床实践提供理论参考。
1 材料和方法
1.1 实验动物及分组 选取健康豚鼠 20只,雌雄不限,体重 300~400克,用于制备抗原。健康纯种远交雌性 Wistar大鼠 50只,8~10周龄,体重180~220克。利用电脑产生随机数字将大鼠分为 3组,分别为正常对照组 10只、EAE模型组 20只、米诺环素治疗组 20只。以上动物均由广西医科大学动物中心提供。
1.2 EAE模型制备 将豚鼠用 10%水合氯醛按 0.5ml/100g麻醉后断头处死,在冰上剪开枕骨及椎管,剥离脊髓迅速取出,并将表面的脊髓膜和马尾去掉,称重,加入等重量 4℃的 0.9%生理盐水,用匀浆机制成 50%的 GPSCH,再加入等量的完全弗式佐剂(CFA,Sigma公司),然后加入卡介苗(北京生物制品研究所)使每毫升含 5mg,混匀后制成油包水型乳剂,放入 4℃冰箱备用。
1.3 动物免疫及干预 将大鼠用 10%水合氯醛按 0.3ml/100g麻醉,模型组及米诺环素治疗组每只大鼠双后足垫和颈部皮下 3点共注射 0.5ml GPSCH-CFA;正常对照组在相同部位共注射 0.5ml的0.9%生理盐水与 CFA混合剂(每毫升含卡介苗5mg)。免疫当天为 0d,待动物清醒后治疗组按90mg/kg给予米诺环素(惠氏制药有限公司)灌胃,从第 1天起按 45mg/kg进行灌胃;同时模型组和对照组给予相同剂量的 0.9%生理盐水。
1.4 EAE模型成功标准 从免疫后当天起每日上下午两次观察大鼠行为学方面的变化,同时每天上午测一次体重并详细记录。评分标准[3]:0分:正常;1分:皮毛不光整,尾部无力;2分:尾部瘫痪;3分:尾部瘫痪加后肢无力;4分:尾部瘫痪加部分后肢瘫痪;5分:后肢完全瘫痪;6分:四肢瘫痪;7分:濒死或死亡。
1.5 组织病理学观察 正常对照组在免疫后第 21天统一处死,模型组和米诺环素治疗组评分 1分以上的发病大鼠在发病后病情高峰时用 10%水合氯醛按 0.3ml/100g进行腹腔注射麻醉,先后用0.9%生理盐水及 4%多聚甲醛常规灌注固定,取大脑、脑干、脊髓放在 4%多聚甲醛中固定 24h,然后逐级酒精脱水、包埋、切片,常规 HE染色,光镜下观察病理变化。
1.6 免疫组化 SP法检测 Fas和 Bcl-2的表达。兔抗大鼠 Fas及 Bcl-2多克隆抗体为北京中衫金桥试剂,二抗山羊抗鼠兔 HRP(辣根过氧化物酶)广谱检测系统及 DAB显色剂购自上海长岛生物技术有限公司,其余试剂由广西医科大学实验中心提供。将各部位标本经石蜡包埋后作 5μm连续切片,按免疫组化试剂盒说明进行操作,阴性对照用0.1 mmol/L的 PBS代替一抗。以细胞膜或胞浆黄色或棕黄色为阳性。所有大鼠大脑、脑干、脊髓各取 3张切片,每张切片取互不重叠的 5个视野。采用 Image-Pro Plus 6.0软件对图像进行分析,分别计算各部位阳性细胞数(个/视野)及平均光密度(积分光密度 /面积,IOD/Area)。
2 结 果
2.1 一般情况观察 3组大鼠免疫后前 3d体重均下降。随后对照组体重回升并持续增加,无大鼠发病;模型组免疫后第 13天开始发病,体重持续下降,发病后较发病前体重下降加快;米诺环素治疗组免疫后第 14天开始发病,体重持续下降但较缓慢。各发病大鼠毛色晦暗,大小便失禁,四肢无力,部分行走困难。其中模型组大鼠发病 13只,米诺环素治疗组发病 9只,两组发病率相比(χ2=1.616,P=0.204),没有统计学差异。两组大鼠潜伏期治疗组略长,但差异无统计学意义(t=1.617,P=0.122)。将各组动物的发病症状高峰时的评分值相加除以每组发病动物只数,得出平均值,比较各组动物发病的严重程度,结果模型组评分高于治疗组(t=-2.58,P=0.018)(见表1)。
2.2 组织病理学改变 HE染色可见模型组和米诺环素治疗组发病大鼠大脑、脑干、脊髓内小血管周围有大量淋巴细胞浸润,呈袖套样改变。但米诺环素治疗组明显轻于模型组,炎性细胞浸润以脊髓和脑干明显,大脑较少(见图1)。
2.3 Fas的表达 各部位细胞数比较,大脑和脑干模型组高于治疗组,对照组最低(P<0.05),脊髓模型组高于治疗和对照组(P<0.05)。各部位平均光密度值相比,脑干和脊髓模型组高于对照和治疗组(P<0.05),大脑模型组高于治疗组,而对照组低于治疗组(P<0.05)(见表2、图2)。
2.4 Bcl-2的表达 各部位细胞数比较,大脑和脊髓治疗组高于模型组,而对照组低于模型组(P<0.05),脑干模型组和治疗组高于对照组(P<0.05)。平均光密度值相比,各部位治疗组高于模型组,而模型组高于对照组(P<0.05)(见表3、图3)。
表1 行为学观察±s)

表1 行为学观察±s)
与模型组相比较*P>0.05,#P<0.05
模型组治疗组65%45%*15.62±1.8516.89±1.76*4.62±1.333.11±1.36#
表2 Fas蛋白的表达±s)

表2 Fas蛋白的表达±s)
与对照组相比较*P<0.05;与模型组相比较#P<0.05
对照组模型组治疗组18.8±1.929.4±4.4﹡24.7±2.9*#20.8±2.332.1±4.3*26.3±3.9*#21.6±3.331.1±3.5*25.6±4.6#0.1268±0.01590.1851±0.0215*0.1581±0.0197*#0.1339±0.02750.1793±0.0128*0.1519±0.0243#0.1244±0.01420.1866±0.0259*0.1510±0.0282#
表3 Bcl-2蛋白的表达±s)
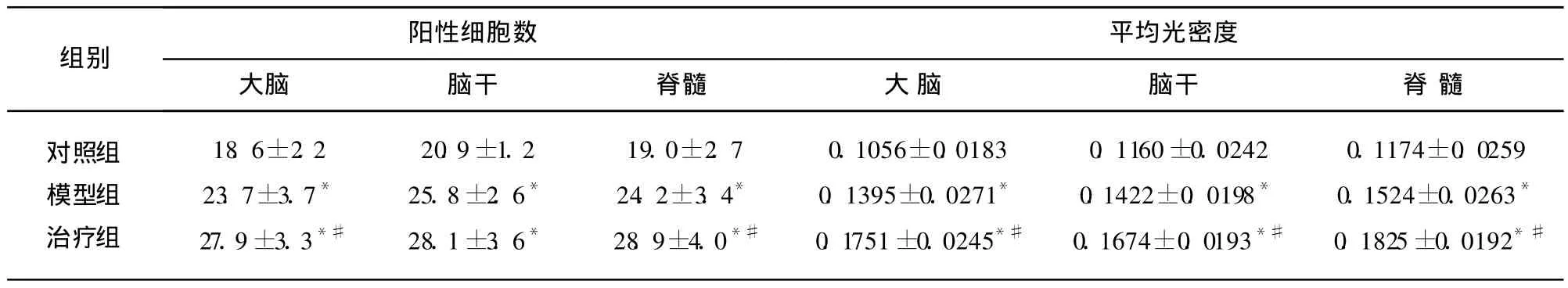
表3 Bcl-2蛋白的表达±s)
与对照组相比较 P<0.05;与模型组相比较#P<0.05
对照组模型组治疗组18.6±2.223.7±3.7*27.9±3.3*#20.9±1.225.8±2.6*28.1±3.6*19.0±2.724.2±3.4*28.9±4.0*#0.1056±0.01830.1395±0.0271*0.1751±0.0245*#0.1160±0.02420.1422±0.0198*0.1674±0.0193*#0.1174±0.02590.1524±0.0263*0.1825±0.0192*#
3 讨 论
本实验研究结果表明模型组和对照组的各项指标相比均有显著差异,说明 EAE大鼠凋亡相关蛋白的表达的确发生了变化;此外治疗组和模型组间脑干和脊髓的细胞数及平均光密度也有显著的差异,这也提示米诺环素对 Fas和 Bcl-2的表达起到了一定的干预作用。模型组大鼠发病高峰评分高于治疗组,说明米诺环素治疗可以适当缓解 EAE的病情;虽然两组发病率相差 20%,但分析显示差异无统计学意义,这有待增大样本进一步验证。
跨膜蛋白 Fas与其配体 FasL结合后激活靶细胞的固有死亡程序,而具有促凋亡作用。Gomes等[4]在复发缓解型 MS患者外周血单核细胞中发现 Fas表达增加,结果与本实验相近;谭清华等[5]研究也证实 Fas的升高与 MS复发次数和病损程度正相关,是一个检测复发的指标。致病性 T细胞凋亡消除被认为是 MS的管理机制之一,Okuda等[6]认为 T细胞对Fas介导细胞凋亡的抵抗导致 MS病情加剧。本实验模型组中 Fas表达增加可能是大鼠机体的一种自我保护机制,以此促进致病性 T淋巴细胞的凋亡来缓和病情;和模型组相比治疗组 Fas表达下降,可能是给予米诺环素后自身反应性淋巴细胞减少,从而使抗凋亡蛋白的表达也相应减少。
Bcl-2蛋白是重要的抗凋亡因子,它具有调控线粒体细胞色素 C释放的功能,通过保护线粒体膜的完整性而发挥抗凋亡作用。本研究显示模型组 Bcl-2上调,说明 EAE本身可以使抗凋亡蛋白增加而抑制凋亡,这也可能是大鼠机体的一种自我保护机制。而治疗组的 Bcl-2蛋白高于模型组,这说明米诺环素治疗使大鼠抗凋亡能力进一步增强。Sharief等[7]观察到活动性 MS患者与稳定性 MS或其它对照比较,外周淋巴细胞中促和抗凋亡 Bcl-2成员的比率明显降低,表明抗凋亡蛋白 Bcl-2的表达增加或相对增加,此外国内有学者[8]发现米诺环素可以使癫痫大鼠海马区的 Bcl-2蛋白表达增加,结果与本实验数据相似。这种促和抗凋亡蛋白表达率的不平衡,减少了活动性MS对细胞凋亡的易感性,表明外周淋巴细胞 Bcl-2家族蛋白的表达失调是临床活动性 MS的特征。此外有文献报道[9]发现复发缓解型 MS患者B细胞内 Bcl-2蛋白明显上调,认为复发型 MS患者中凋亡抑制蛋白的过表达,可能促进自身反应性 B淋巴细胞凋亡抵抗而潜在致病,因此导致持续自身免疫组织破坏。
Oren[10]等研究发现细胞凋亡与疾病严重程度相关,认为 MS患者体内凋亡和抗凋亡机制出现失衡,失衡的程度与疾病的进展密切相关。本实验中模型组 Fas和 Bcl-2蛋白的表达均相对治疗组升高,这可能都是大鼠机体的自我保护机制,但正是这种保护机制导致促与抗凋亡失衡,使病情进一步加剧。而治疗组 Fas表达下调,Bcl-2的表达上调,表明米诺环素通过介导凋亡蛋白的表达以及抗炎作用致炎症细胞减少,使细胞凋亡重新趋向平衡,也使免疫反应重新恢复正常,组织细胞损伤减轻,从而起到对疾病的治疗作用。Das等[11]研究认为神经元死亡是诱导EAE后 8~10d细胞凋亡的结果,这发生在出现明显的临床症状前。由于临床上MS的表现复杂多变,各种指标在每个病程中的表达可能不尽相同,而本研究的模型只是短期的急性病程,今后需要在其它病程模型中对凋亡相关蛋白的表达行进一步研究,并与自身反应性淋巴细胞的变化结合起来探索其具体的作用机制和变化规律。本研究提示米诺环素可以介导EAE中凋亡相关蛋白 Fas和 Bcl-2的表达,可能通过干预凋亡及减轻炎症反应而间接调节免疫,对EAE起到了治疗作用,这对于探讨 MS发病机制和临床治疗提供了新的途径和希望。

图1 A:对照组;B:模型组;C:治疗组(HE染色 ×400)

图2 D:对照组;E:模型组:F治疗组(Fas免疫组化染色 ×400)

图3 G:对照组;H:模型组;I:治疗组(Bcl-2免疫组化染色 ×400)
[1] Zipp F.Apoptosis in multiplesclerosis[J].Cell Tissue Res,2000,301(1):163-171.
[2] Yong VW,Wells J,Giuliani F,et al.The promise of minocycline in neurology[J].Lancet Neurology,2004,3(12):744-751.
[3] Hooper DC,Spitsin S,Kean RB,et al.Uric acid,a natural scavenger of peroxynitrite,in experimental allergic encephalomyelitis and multiple sclerosis[J].Proc Natl Acad Sci USA,1998,95(2):675-680.
[4] Gomes AC,Jnsson G,Mrnheim S,et al.Upregulation of the apoptosis regulators cFLIP,CD95 and CD95ligand in peripheral blood mononuclear cells in relapsing-remitting multiple sclerosis[J].J Neuroimmunol,2003,135(1):126-134.
[5] 谭清华,赵忠新,张玲珍.Fas和 FasL在多发性硬化患者表达的意义[J].中华神经科杂志,2003,36(1):14-16.
[6] Okuda Y,Apatoff BR,Posnett DN.Apoptosis of T cells in peripheral blood and cerebrospinal fluid is associated with disease activity of multiple sclerosis[J].J Neuroimmunol,2006,171(1):163-170.
[7] Sharief MK,Matthews H,Noori MA.Expression ratios of the Bcl-2 family proteins and disease activity in multiple sclerosis[J].J Neuroimmunol,2003,134(1):158-165.
[8] 于 欢,任惠民,罗玉敏,等.米诺环素对红藻氨酸诱导的癫痈大鼠海马组织凋亡相关蛋白表达的影响[J].中国临床神经科学,2006,14(4):362-367.
[9] Seidi OA,Sharief MK.The expression of apoptosis-regulatory proteins in B lymphocytes from patients with multiple sclerosis[J].JNeuroimmunol,2002,130(1):202-210.
[10] Oren A,White LR,Aasly J.Apoptosis in neurones exposed to cerebrospinal fluid from patients with multiple sclerosis or acute polyradiculoneuropathy[J].J Neurological Sci,2001,186(1):31-36.
[11] Das A,Guyton MK,Matzelle DD,et al.Time-dependent increases in protease activitiesfor neuronal apoptosis in spinal cords of Lewisrats during development of acute experimental autoimmune encephalomyelitis[J].J Neurosci Res,2008,86(13):2992-3001.
