早期帕金森病大鼠线粒体损伤的研究
2010-08-25于德钦殷盛明王冬梅王彦霞董方圆孙艺平张万琴
于德钦, 殷盛明, 彭 岩, 王冬梅, 王彦霞, 董方圆, 孙艺平,, 张万琴
帕金森病(Parkinson's Disease,PD)是一种与年龄相关的中老年慢性神经系统变性疾病。PD早期发病时间长,有文献报道可长达 10年之久[1]。其早期发病时间包括各种致病因素作用于机体并引起中脑黑质致密部多巴胺能神经元出现变性所需时间和中脑黑质致密部多巴胺能神经元进行性变性至 PD临床症状出现所需时间。临床尸检资料发现只有当中脑黑质致密部多巴胺能神经元变性死亡达 50%,纹状体内多巴胺水平降低至 70%~80%,患者才开始出现临床症状[2]。
目前有关 PD发病机制的研究,多集中在 PD临床期,PD早期发病机制尚不清楚,且相关的研究很少。这主要是由于临床上很难收集到未出现临床症状的又处于 PD无病期和临床前期的病例,因此只能借助于采用早期 PD动物模型。将 6-OHDA注入脑内黑质纹体系统损毁大鼠多巴胺能神经元所制成的模型可以模拟早、中、晚各个时期 PD患者的病理改变[3,4]。有研究表明 6-OHDA注射入大鼠纹状体将引起为期数周的黑质纹状体系统缓慢的逆行性退行性变,使用小剂量单侧纹状体内注射法可建立 PD临床前期动物模型[5,6]。本研究采用 6-OHDA制备早期 PD大鼠模型,观察 PD发病早期大鼠中脑内神经元线粒体的超微结构改变及其抗氧化能力的改变。这将为 PD早期发病机制及 PD的早期防治提供线索。
1 对象与方法
1.1 研究对象 制备早期 PD动物模型,选用健康雄性 SD大鼠,体重 180~220克,用 4%水合氯醛(400mg/kg)腹腔注射麻醉后,固定于脑立体定位仪上,门齿杆 3.4mm。根据 George Paxinos&Charles Watson大鼠脑定位图谱选取靶点,PD临床前组注射靶点为纹状体,坐标定位为 AP=+1.0,R=3.0mm(向右旁开),H=-4.5mm(硬膜下)。实验动物脑内注射溶解于 Vehicle(0.1%抗坏血酸,0.9%NaCl)的 6-OHDA,20μg/3μl。 注射时 间约3min,留针 3min后慢慢退出。对照组动物在相同条件下,靶点内分别给以同等容积的 Vehicle。
1.2 电镜技术 取上述各组 SD大鼠的 60μm厚冠状脑片,用含有 2%多聚甲醛和 1.25%戊二醛的 0.1mol/L的盐酸缓冲液固定。2%锇酸后固定1h,常规 Epon812平板定位包埋。光镜下选取特定组织,将其贴在预制的空白包埋块上,超薄切片,铀铅双染,透射电镜观察并摄片。每只动物随机选取2个包埋块制备超薄切片,每个包埋块捞取 2张铜网,选用反差良好的一个铜网在电镜下观察,在放大100,000倍条件下,每张铜网选取 1个网眼,随机在其上下左右 4个角度各摄片 1张,放大 20,000以进行形态学分析。观察并比较中脑右侧神经元内线粒体超微结构特点。
1.3 线粒体的分离 动物分别被断头取脑置于冰袋上,迅速取出腹侧中脑黑质区脑组织块,浸在缓冲液 A[250mmol/L甘露糖醇,0.5mmol/L EDTA,5mmol/L Hepes,0.1%(W/V)BSA pH7.4]中,剪碎。600×g,离心 5min,2次,去除细胞核及碎片。上清液在 10300×g,离心 10min。沉淀部分为线粒体粗制品。将沉淀部分悬浮于 5ml缓冲液 A中。分装 4个含有 20ml 30%(v/v)Percoll[用 225mol/L甘露糖醇,1mmol/L EDTA,25mmol/L Hepes,0.1%(w/v)BSA(pH7.4)]配制离心管中,95000×g,离心 30min。收集底层褐黄色部分(线粒体)。
1.4 MAO-B活性测定 神经元内的 MAO-B主要位于线粒体(线粒体外膜),是线粒体的标志酶之一。制备线粒体,加入 40倍体积 50mol/L磷酸钠缓冲液后于冰浴中浆化,用 Lowry法测定其蛋白量,进一步采用分光光度计法测定 MAO-B活性(按南京建成生物工程研究所试剂盒说明)。
1.5 SOD活性测定 用生理盐水制备中脑匀浆,12500×g离心,取上清液,按南京建成生物公司试剂盒说明用黄嘌呤氧化酶法测 SOD活性,用 DTNB显色法测 GSH-Px活性。
1.6 MDA含量测定 取脑匀浆上清液0.15 ml,用硫代巴比妥酸(TBA)法测脂质过氧化产物(MDA)含量。
2 结 果
2.1 线粒体电镜结果 早期 PD动物中脑神经元内,大多数线粒体发生形态学改变,可见线粒体局部水肿,部分线粒体嵴排列紊乱、部分嵴消失及发生髓样变性,另一部分线粒体膜融合破损(见图1)(见图中箭头所示)。
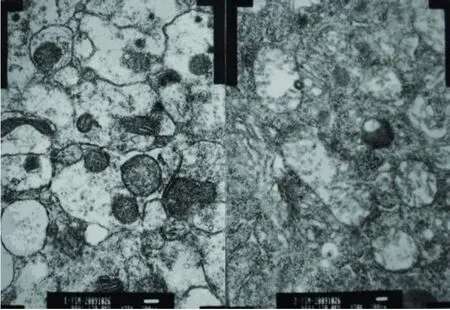
图1 给药侧黑质神经元超微结构的改变
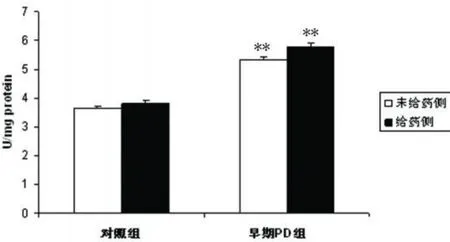
图2 中脑 MAO-B活性与同侧对照组相比**P<0.01

图3 中脑 MDA活性与同侧对照组相比**P<0.01
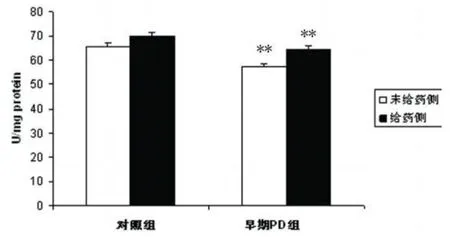
图4 中脑 SOD活性与同侧对照组相比**P<0.01
2.2 线粒体抗氧化活性
2.2.1 MAO-B与对照组相比,PD早期动物中脑神经元线粒体 MAO-B的酶活性明显增高(见图2)。
2.2.2 MDA与对照组相比,PD早期动物中脑神经元线粒体 MDA活性明显增高(见图3)。
2.2.3 SOD与对照组相比,PD早期动物中脑神经元线粒体 SOD活性明显降低(见图4)。
3 讨 论
在 PD的发病过程中,有以下几个阶段:(1)无病期,此期仅有危险的致病因素存在。(2)临床前期,此期 PD的病理过程开始,但无临床症状,有临床尸检资料发现只有当中脑黑质致密部多巴胺能神经元变性脱失达 50%,纹状体内多巴胺水平降低至70%~80%,患者才开始出现临床症状[2]。因此 PD的早期发病可达几十年之久[1]。(3)临床期,此期PD的特征性的临床症状己出现,从治疗的角度出发,这已为时过晚。关于 PD治疗,目前多采用 LDopa,但其不能阻止黑质内多巴胺能神经元的进行性变性,且使用后具有远期不良效应。因此,对 PD早期发病机制的研究具有重要的社会意义。
PD的病因和发病机制至今不完全清楚,很可能是多种因素长期作用的结果,包括基因突变、接触环境毒物(如鱼藤酮、MPTP、6-OHDA等)、脑内炎症反应和免疫功能失调等[7]。线粒体功能障碍参与 PD的发病已有很多研究,PD患者普遍存在着线粒体复合物 I活性下降和活性氧生成增加,这导致氧化应激和增加神经元对兴奋性毒性死亡的易感性[8]。氧化应激与线粒体功能障碍还互为因果,恶性循环。SOD、MDA和 MAO-B均为线粒体内的常见酶。SOD为抗氧化酶,SOD可将 O2-·转化为 H2O2,有效清除自由基。自由基的产生与清除失衡产生氧化应激作用,使线粒体 DNA发生氧化损伤。MDA为过氧化脂质的降解产物,生成过多的 MDA可诱导 Ca2+从线粒体、内质网释放,导致胞内 Ca2+升高,诱发细胞凋亡。MAO-B可降解单胺类神经递质,脑中的MAO-B活性随年龄增加而升高,能使神经递质高度氧化,导致脑组织中单胺类神经递质的异常改变[9]。但是,线粒体氧化损伤是否参与早期 PD的发病机制尚未见报道。
本研究采用小剂量单侧纹状体内注射法建立PD临床前期动物模型,经旋转行为及迈步实验检测与对照组无明显改变,证实为可靠的 PD临床前动物模型。进一步研究发现,在 6-OHDA损毁侧,PD临床前期动物与对照组相比,PD早期脑内神经元的线粒体已出现超微结构的病理损伤,中脑的 SOD活性明显降低,MDA及 MAO-B的酶活性明显增高。提示线粒体的抗氧化能力降低可能参与早期 PD大鼠中脑神经元的损伤机制。这将为 PD的防治及抗PD药物的研制开发提供重要的理论依据和线索。
[1] Brooks DJ.The early diagnosis of Parkinson's disease[J].Ann Neurol,1998,44(3):10-18.
[2] 陈生弟.老年帕金森病的病因及发病机制[J].实用老年医学,2000,15(6):284-287.
[3] Jenner P.Functional models of Parkinson's disease:a valuable tool in the development of novel therapies[J].Ann Neurol,2008,64(2):16-29.
[4] 陈生弟,陈先文.帕金森病动物模型的研制[J].中国神经免疫学和神经病学杂志,2003,10(1):82-86.
[5] Deniz K,Carl R,Anders B.Characterization of behavioral and neurodegenerative changes following partial lesions of the nigrostriatal dopamine system induced by intrastriatal 6-hydroxydopamine in the rat[J].Exper Neurol,1998,152(2):259-277.
[6] Schober A.Classic toxin-induced animal models of Parkinson's disease:6-OHDA and MPTP[J].Cell Tissue Res,2004,318(1):215-224.
[7] Tansey MG,Frank-Cannon TC,McCoy MK,et al.Neuroinflammation in Parkinson's disease:is there sufficient evidence for mechanismbased interventional therapy[J].Front Biosci,2008,13:709-717.
[8] Schapira AH,Cooper JM,Dexter D,et al.Mitochondrial complex I deficiency in Parkinson's disease[J].JNeurochem,1990,54:823-827.
[9] Cardellach F,Mart MJ,Fernandez Sola J,et al.Mitochondrial respiratory chain activity in skeletal muscle from patients with Parkinson's disease[J].Neurology,1993,43(11):2258-2262.
