乙酰谷酰胺对戊四氮致痫大鼠大脑病理改变以及GABABR和 NMDAR1的影响
2010-08-25朱雨岚张春媛王丽平
孟 佳, 朱雨岚, 张春媛, 王丽平
癫痫是多种病因引起的具有反复发作性质的慢性脑病。其发病机制复杂,人们从多个角度探索,并取得了一定的证实,包括:遗传方面的研究、离子通道方面的研究、脑内氨基酸系统方面的研究等[1]。其中,氨基酸失衡学说是癫痫机制研究的热点,人们对它的研究已进入了分子水平。
在我院儿科多宗病历中,给脑瘫患儿应用乙酰谷酰胺目的是保护脑组织,却意外发现应用该药的患儿癫痫发作频率明显减少,预后较好,这引起了我们的关注。乙酰谷酰胺在临床上用于肝昏迷、偏瘫、神经外科手术等引起的昏迷、瘫痪、及智力减退、记忆力障碍等,但是用于癫痫治疗未见报道。为此我们做了以下探试性的实验研究。
1 材料与方法
1.1 实验动物 健康雄性 Wistar大鼠 50只,体重 180~220g,由哈尔滨医科大学实验动物中心提供。
1.2 方法
1.2.1 动物分组 随机分为 4组,单笼饲养,第 1组为空白对照组(n=5);第 2组为模型组(n=15);第 3组为小剂量治疗组(n=15);第 4组为大剂量治疗组(n=15),后 3组设 3d、7d、14d组 3个时间点,每个时间点 5只。
1.2.2 模型与标本制作
1.2..1 模型制作 采用戊四氮(PTZ)点燃的惊厥模型,PTZ溶于生理盐水中配成 1%的溶液,给予 1%PTZ75mg/kg腹腔注射,观察大鼠行为变化。对照组给予同剂量生理盐水腹腔注射。参考Racine分级法,点燃标准:所有大鼠均出现Ⅳ级或Ⅳ级以上的发作。
1.2.2.2 药物治疗 癫痫发作后立即给予乙酰谷酰胺腹腔注射,根据该药的半数有效量(LD50)和半数致死量(ED50)以及人类和动物剂量换算关系得出,大剂量为 12μg/g;小剂量为 2μg/g;模型组和对照组给予生理盐水。3d、7d、14d组分别给予治疗 3d、7d、14d后经主动脉灌注,固定取材。
1.2.2.3 灌注与取材 最后一次药物治疗后4h后,用 10%水合氯醛麻醉动物,开胸暴露心脏,直视下将穿刺针经左心室刺入升主动脉,剪开右心耳将血放出,同时先用冷生理盐水 200ml迅速灌注,再灌注 4%多聚甲醛直至看到由右心耳流出无色透明的液体。然后断头开颅取脑,将脑组织浸入 4%多聚甲醛于 4℃冰箱保存 48h。常规脱水、浸蜡、包埋,于海马部位连续冠状切片,行 HE染色(观察大鼠海马的神经元病理改变),及 GABABR和 NMDAR1免疫组织化学染色。
1.2.2.4 免疫组织化学方法 每只动物取 4张脑片,2张用于 GABABR;2张用于 NMDAR1,步骤如下:(1)烘烤;(2)脱蜡;(3)脱水;(4)冲洗;(5)修复;(6)冷却;(7)冲洗;(8)阻断;(9)冲洗;(10)次日分别加兔抗 GABABR多克隆抗体和 NMDAR1多克隆抗体,4℃冰箱过夜;(11)冲洗;(12)滴加山羊抗兔 IgG抗体;(13)冲洗;(14)滴加 DAB剂覆盖组织室温避光显色 3~5min或更长时间,至显色水终止反应;(15)冲洗;(16)复染;(17)脱水、脱二甲苯、封片。阳性着色为细胞浆棕黄色颗粒。
2 结 果
2.1 病理组织学改变
2.1.1 HE染色 空白对照组未见明显改变。模型组:3d组镜下可见大脑皮质轻度红色神经元及神经元固缩,海马锥体神经元固缩;7d组大脑及海马锥体细胞弥漫性红色神经元及神经元固缩,小脑蒲肯野细胞红色神经元并进入颗粒层。14d组大脑皮质及海马神经细胞减少,重度红色神经元及神经元固缩,小脑蒲肯野细胞肿胀,红色病变,进入颗粒层,基底节锥体神经元固缩,小血管血管壁增厚,血管周围水肿及脱髓鞘病变(见图1)。
治疗组:病变严重程度,14d组 >7d组 >3d组。模型组、小剂量治疗组、大剂量治疗组 HE镜下观察,病变程度综合比较,呈模型组 >小剂量治疗组 >大剂量治疗组趋势,且大剂量治疗组≈空白对照组。小剂量治疗组:3d组镜下可见大脑皮质及海马红色神经元及神经元固缩,病变程度与模型 3d组相似;小剂量治疗 7d组,大脑皮质及海马锥体细胞红染,神经元固缩,其病变情况略轻于模型 3d组;小剂量治疗 14d组大脑皮质及海马神经元轻度红染、固缩,细胞数量无减少。总体上,病变严重程度,14d组 >7d组 >3d组。大剂量治疗组:3d组镜下可见,大脑皮质及海马神经元轻度红染,固缩不明显;大剂量治疗 7d组,大脑皮质及海马少量锥体细胞轻度红染及固缩;大剂量治疗 14d组,仅海马少量锥体细胞轻度红染、固缩,大部分基本正常(见图2)。总体上,病变严重程度,14d组 >7d组 >3d组。
2.1.2 平均神经元坏死率 各组平均神经元坏死率的统计,即镜下随机选取 6个视野的神经元坏死率,计算平均值,采用两因素析因方差分析,每组均 P<0.05,得出结论:模型组、小剂量治疗组、大剂量治疗组 3组神经元坏死程度不同,3d组、7d组、14d组 3组神经元坏死程度不同,其中大剂量治疗14d组神经元坏死率最低(见表1)。
2.2 免疫组化结果 海马 CA1区 GABABR和NMDAR1表达显微镜下观察各组 GABABR和NMDAR1的免疫组织化学表达结果,发现模型组、大剂量治疗组、小剂量治疗组的阳性细胞数分别明显少于和多于空白对照组,而模型组、大剂量治疗组、小剂量治疗组之间相差不多。各组中的 3d组、7d组、14d组之间表达的阳性细胞数亦无明显差异。以 GABABR和 NMDAR1阳性细胞数为指标,忽略3d组、7d组、14d组的分组,将所有指标分为模型组、大剂量治疗组、小剂量治疗组 3组,应用方差分析,得出 P﹥ 0.05,即模型组、大剂量治疗组、小剂量治疗组 3组间表达的阳性细胞数无显著差异。

表1 平均神经元坏死率
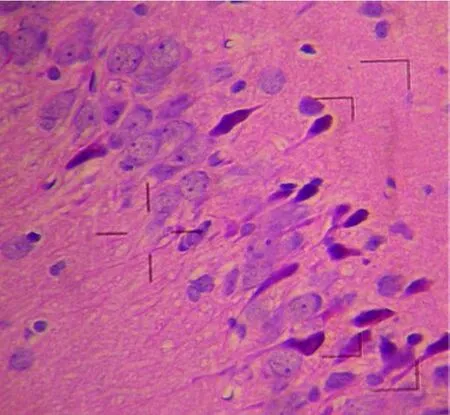
图1 模型 14d组海马病理改变 HE染色 ×40
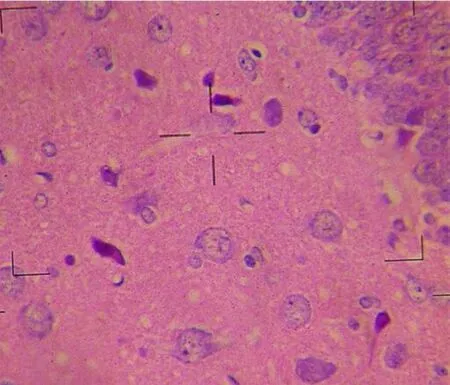
图2 大剂量治疗组 14d病理改变 染色 ×40
3 讨 论
PTZ慢性点燃模型的动物一旦被点燃,其脑兴奋性、易感性终身保持而且伴有自发性的惊厥发作。王艺等人在实验中发现该模型能够产生具有 EP特征的长期效应[2]。本实验采用 PTZ诱导大鼠惊厥发作,出现急性癫痫的临床表现,镜下观察脑组织呈现癫痫导致的神经原坏死等病理改变,因此用此模型模拟人类的癫痫、制造人类癫痫所致的脑损害模型,对临床应用有指导意义。
既往研究发现,癫痫的发病机制之一是脑内兴奋性氨基酸和抑制性氨基酸失衡学说,即中枢神经系统内抑制性神经递质减少和兴奋性神经递质增多是癫痫发生的主要机制之一[3]。
由于乙酰谷酰胺通过血脑屏障后分解为谷氨酸和 γ-氨基丁酸,这让我们大胆的设想乙酰谷酰胺的作用机制是通过促使脑内紊乱的氨基酸达到平衡,基于前期实验的基础[4],我们选取了 GABABR和NMDAR1,用免疫组化方法观察、对比治疗组与非治疗组之间表达的变化,以平均阳性细胞数为统计指标,采用方差分析方法。本实验主要目的在于:一方面,证实乙酰谷酰胺对惊厥导致大脑病变的治疗作用;另一方面,寻找该药的作用机制。
从大鼠 HE脑片的神经元坏死率指标看,治疗组坏死率低于模型组,经两因素析因方差分析得出结论模型组、小剂量治疗组、大剂量治疗组 3组大脑坏死程度不同,3d组、7d组、14d组 3组大脑坏死程度不同,其中大剂量治疗 14d组神经元坏死率最低,由此可以证实该药对惊厥导致的大脑病变具有治疗作用,而且将各组神经元坏死率均数做对比,可以推断在安全用药前提下,乙酰谷酰胺的治疗效果呈现一定的剂量和治疗时间依赖性。
γ-氨基丁酸(GABA)作为中枢神经系统最主要的抑制性神经递质,各类癫痫的发生几乎都与脑内GABA的功能变化有关,通过抑制作用,其维持着神经元兴奋与抑制的平衡,当该平衡被打断,则 EP发作随之发生[5~7]。孟红梅等的实验证明了下丘脑内转染 GABA受体可以抑制癫痫的发作程度[8]。
GABA受体包括 GABAAR、GABABR、GABACR 3种类型。GABABR在突触后膜,通过增加钾离子传导而产生的迟发性细胞膜超极化而抑制(IPSPs),对于抑制性神经信息传递的细胞调节具有重要作用;在突触前膜,GABABR通过抑制电压敏感性钙离子通道而抑制 GABA或谷氨酸神经递质的释放,调节 GABA功能,促进或抑制癫痫发生发展[9~11]。
本实验的研究结果显示,模型组、大剂量治疗组、小剂量治疗组的 GABABR表达低于正常对照组,也可证实以上的结论,即癫痫的发生与 GAB-ABR的减少密切相关。NMDAR是兴奋性氨基酸谷氨酸受体,是发现最早也是研究最多的一种受体,它主要分布于大脑皮层、海马等部位,主要位于突出后膜。目前发现 NMDA受体至少存在 7个亚单位,其中 NMDAR1是该受体的功能单位。NMDAR介导的Ca2+细胞内流,引起的细胞内钙超载,是导致痫性放电和扩散的重要基础。因此兴奋性氨基酸 NMDA受体活性及表达增高是神经元兴奋性损伤及癫痫发病机制的关键环节。
动物研究实验表明,NMDA受体拮抗剂有广泛的抗癫痫谱,特别是对极量电休克癫痫和酒精撤退癫痫发作有效[12]。吴希如等人发现发育中 P77PMC大鼠脑内 NR1基因表达增高可能是造成 P77PMC大鼠/低惊厥阈值及对听源性惊厥易感的原因之一,他们所做的另一实验结果提示 NMDA受体活性增高是遗传性癫痫易感大鼠产生惊厥的重要因素[13]。王赞[14]、王群[15]等分别用海人酸和马桑内酯致痫大鼠观察海马各区的 NMDAR1mRNA表达的变化,得出NMDAR1mRNA表达的上调可能参与癫痫发生及癫痫易感性维持的分子机制。
我们的实验结果也可以得出同样结论,即癫痫的发生与 NMDAR1表达增多密切相关。本实验通过免疫组化镜下观察,将治疗组和模型组 GABABR和 NMDAR1的表达做比较,未发现有明显的差异,为此我们推测,由于 GABABR和 NMDAR1具有多种亚型,每种亚型又具有多个亚单位结构,乙酰谷酰胺的作用途径虽然不是通过 GABABR和 NMDAR1,但是有可能是通过受体的其他亚型起作用。因此有关乙酰谷酰胺的作用机制还有待于进一步研究,为癫痫的发病机制提供有力的证据,为癫痫的治疗提供新的科学方案。
综上所述,乙酰谷酰胺对癫痫有一定治疗作用,并且在安全用药前提下,乙酰谷酰胺的治疗效果呈现一定的剂量和治疗时间依赖性。但其作用机制可能不是通过 GABABR和 NMDAR1这两个受体,有待进一步研究。
[1] 刘建鑫,申长虹.颞叶癫痫发病机理的实验性研究进展[J].国外神经病学杂志神经外科学分册,2004,31(2):186-189.
[2] 王 艺,李智平,施忆贇.戊四氮点燃大鼠慢性癫痫模型的建立及评价[J].复旦学报(医学版),2006,33(2):206-208.
[3] 刘焯霖,梁秀龄,张 成.《神经遗传病学》[M].人民卫生出版社,2004.166-190.
[4] 徐 元,包仕尧,张志琳,等.癫痫大鼠海马细胞外液中 γ-氨基丁酸、谷氨酸、牛磺酸及甘氨酸的动态变化[J].苏州大学学报(医学版),2005,3(3):23-25.
[5] 朱雨岚,吴海威,程莉晶,等.白细胞介素 1、白细胞介素 1受体拮抗剂对癫痫大鼠行为、海马超微结构及对NMDAR活性的影响[J].中国临床康复,2005,9(9):70-72.
[6] 李 华.GABAB受体及其临床意义[J].国外医学·生理、病理科学与临床分册,2000,20(6):458-460.
[7] 汤继宏,包仕尧.癫痫发作后海马结构 GABA受体亚单位变化的研究[J].Journal of International Neurology and Neurosurgery,2005,32(4):45-48.
[8] 孟红梅,林卫红,郭桂梅,等 .GABA受体基因转染对癫痫大鼠海马区病理变化的影响[J].中风与神经疾病杂志,2007,24,(4):434-436
[9] 王晓梅,关毅敏,张文利.癫痫患者脑脊液中 GABA、谷氨酸、Asp的变化及其临床意义[J].中风与神经疾病杂志,1996,13(6):348-350.
[10] 黄 河,杨天德.NMDA受体和 GABAA受体对未成熟大脑中神经元凋亡的影响[J].中国临床康复,2004,8(4):712-713.
[11] 王乃东,赵永波,陈英辉,等 .γ-氨基丁酸 B受体亚单位在人类难治性颞叶癫痫患者中的表达[J].中华神经科杂志,2006,39(5):320-322.
[12] 徐仁四,胡元元,张 洪.致痫大鼠海马神经元氨基酸类物质含量变化的研究[J],临床神经病学杂志,2002,15(5):67-69.
[13] 吴希如,陈清棠.神经系统疾病的分子生物学基础[M].北京医科大学中国协和医科大学联合出版社,1995.79-81.
[14] 王 赞,张淑琴,寇玉红,等.老年癫痫大鼠海马 NMDA受体亚单位 1mRNA表达的研究[J].中国老年学杂志,2003,23(5):300-301.
[15] 王 群,阮旭中,史庭慧,等.马桑内酯致痫大鼠大脑皮层、海马NMDA受体亚单位 1(NMDAR1)mRNA表达的变化[J].中风与神经疾病杂志,2000,17(1):56-58.
