舒芬太尼联合小剂量硫酸镁胃肠术后静脉镇痛
2010-08-18禹正杨郭立平
李 祥, 禹正杨, 马 欣, 郭立平, 旷 昕
(1.南华大学附一院麻醉科,湖南 衡阳 421001;2.南华大学附一院肿瘤外科,湖南 衡阳 421001)
胃肠外科手术后临床镇痛用药一般以阿片类药物为主,其中舒芬太尼起效快、镇痛作用强,是常用药物之一.镁离子作为钙离子的生理性拮抗剂和天然的 N-甲基 -D-天冬氨酸受体(NMDA受体)阻滞剂,据报道可以辅助性的应用于术后镇痛,降低术后镇痛药的需要量.本研究主要观察小剂量硫酸镁复合舒芬太尼在胃肠外科手术后患者静脉自控镇痛(PCIA)中的镇痛效果以及不良反应的发生情况.
1 资料与方法
选取 2008年 2月 -2010年 2月择期行胃肠道手术的患者 60例.其中男 38例,女 22例.年龄39~60岁,体重 51~70 kg.美国麻醉医师协会(ASA)分级 I~Ⅱ级.22例行胃癌根治术,20例行结肠癌根治术,10例行胃空肠吻合术,8例行肠切除术.术前血清镁离子水平正常,肝、肾、心肺功能正常,无房室传导阻滞,术前无阿片、钙离子阻滞剂用药史.将患者随机分为两组,舒芬太尼组(S组)和硫酸镁联合舒芬太尼镇痛组(MS组),每组各 30例.两组患者年龄、身高、体重无统计学差异(P>0.05).见表1
1.1 一般资料

表1 两组患者一般情况的比较Tab.1 Comparison of general status of two groups patients
与 S组比较,P>0.05
1.2 麻醉方式
所有患者均采用静吸复合麻醉,术前 30 min给予阿托品 0.5 mg肌注.麻醉诱导:咪唑安定0.1 mg/kg,舒芬太尼 0.5μg/kg,维库溴铵0.1mg/kg,依托咪酯 0.3 mg/kg.快速诱导后插入气管插管控制呼吸.麻醉维持:吸入 1~2%的异氟醚.间断静注维库溴胺 0.05mg/kg.术中根据患者和手术情况酌情追加舒芬太尼 0.2μg/kg维持.术毕均静脉推注止吐药格拉司琼 3 mg.送病人至麻醉恢复室.
1.3 术后镇痛
当患者模拟疼痛评分(VAS)>4时开始进行自控镇痛.S组:单纯舒芬太尼镇痛,2μg/kg舒芬太尼 +3mg格拉司琼.MS组:硫酸镁联合舒芬太尼镇痛,2μg/kg舒芬太尼 +3 mg格拉司琼 +50 mg/kg硫酸镁.各组镇痛泵中药物均用生理盐水稀释至 100 ml.以一次性静脉镇痛泵背景流量 2 ml/h,负荷量 0.5m l,锁定时间 15 min,行静脉术后镇痛.
1.4 观察项目
(1)观察各组患者镇痛 48 h内的静息镇痛评分(VAS方法)[1];
(2)生命体征:持续监测 ECG、HR、MAP、SpO2及RR;
(3)不良反应:恶心呕吐、皮肤瘙痒、呼吸抑制、膝跳反射;
(4)镇痛泵按压次数;
(5)在麻醉诱导前、术后即刻及镇痛治疗结束后取静脉血 2 ml,采用 Modular Analytics型全自动生化分析仪测定血清钙、镁浓度.
1.5 统计学处理
所有资料数据用SPSS软件检验:定量资料用均值 ±标准差(±s)表示,进行 t检验;计数资料进行 χ2检验,P<0.05有统计学意义.
2 结果
1)视觉模拟评分.患者术后 0 h,4 h,8 h,12 h,24 h,48 h视觉模拟评分,两组患者在术后均获得良好的术后镇痛,MS组患者 VAS评分术后各时间点均小于 S组,有统计学意义(P<0.05),见表2.
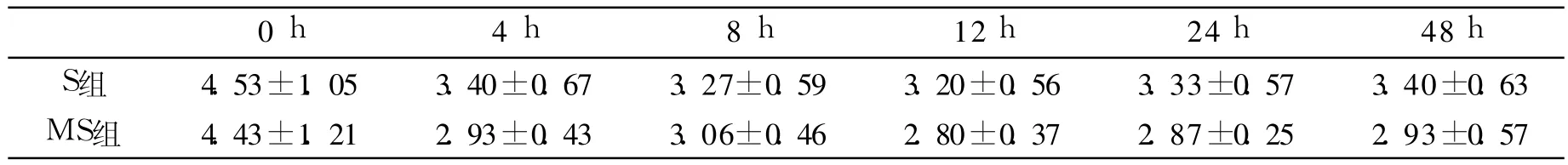
表2 两组患者术后各时间点 VAS评分Tab.2 Two groups of patients for each time point VASscore
2)三组患者生命体征平稳,各时点 HR、MAP、SpO2差异无统计学意义.
3)不良反应:MS组有 1例恶心,S组有 3例恶心呕吐,两组比较有统计学意义(P<0.05).两组均无呼吸抑制、膝跳反射消失、头晕、头痛及皮肤瘙痒发生.
4)术后 48 h内 MS组镇痛泵按压次数[(6.07±4.8)次]显著低于 S组[(14.27±10.54)次],有统计学意义(P<0.01).
5)血清钙、镁离子浓度变化情况:两组患者麻醉诱导前、麻醉结束时及 PCIA治疗后血清中钙离子浓度差异无统计学意义(P>0.05).两组患者血清镁离子浓度在麻醉结束后和 PCIA治疗后比麻醉诱导前浓度低,有统计学意义(P<0.05).PCIA治疗后两组患者的血清镁离子浓度均高于麻醉结束时,但 MS组升高幅度更高,有统计学意义(P<0.05).见表3.

表3 两组患者的血清钙及镁浓度变化情况Tab.3 Two groups of patients with serum calcium and magnesium concentration changes
3 讨论
胃肠道手术创伤大,术后疼痛剧烈,常需要大量阿片类药物来满足镇痛需要.舒芬太尼是一种新合成的阿片类药,是选择性的 μ受体拮抗药,具有高脂溶性、起效快、作用时间短、镇痛效果好、心血管系统功能稳定、无组胺释放等特点,在术后镇痛中有明显优势[2],舒芬太尼是目前替代芬太尼的常用阿片类镇痛药物.但也存在如恶心、呕吐、皮肤瘙痒甚至呼吸抑制等不良反应[3].
镁是人体必需的金属元素,也是细胞内重要的阳离子,有极为重要的生理生化作用.镁几乎参与人体所有新陈代谢过程,如:参与蛋白质合成,激活体内多种酶;维持 DNA和 RNA结构稳定性;调节神经肌肉和中枢神经系统的活动,促进钙磷及胶原蛋白沉积;降低血管中血流阻力、减少血小板聚集,改善心肌代谢以及降低急性心肌梗塞死亡率等等.
硫酸镁在临床应用广泛.硫酸镁可抑制中枢神经系统、松弛骨骼肌,具有镇静、抗痉挛以及减低颅内压等作用.大剂量镁离子可直接扩张周围血管平滑肌,引起交感神经节传导障碍,从而使血管扩张,血压下降.常用于治疗惊厥、子痫、尿毒症、破伤风及高血压脑病等.硫酸镁能刺激十二指肠粘膜,反射性地引起总胆管括约肌松弛、胆囊收缩,从而促进胆囊排空,有利胆之功效.
研究结果显示使用单纯舒芬太尼或联合使用小剂量硫酸镁的静脉 PCIA治疗方式均能起到良好的疗效被病人所接受.但 S组患者的疼痛和感觉不适程度均较 MS组患者严重,同时前者药液用量多于后者.另外,MS组患者使用 PCIA治疗后疼痛缓解程度比单纯的 S组患者明显.这表明与 S组比较,MS组患者疼痛程度较轻,可以用较少的镇痛药量达到有效的镇痛效果.MS组患者VAS评分术后各时间点均小于 S组,有统计学意义(P<0.05),这说明此组病人镇痛效果更明显.所以联合小剂量硫酸镁和舒芬太尼的镇痛方案在术后疼痛治疗中效果较 S组要好.而且通过联合使用硫酸镁后减少了镇痛泵按压的次数,术后 48 h内 MS组镇痛泵按压次数[(6.07±4.8)次]显著低于 S组[(14.27±10.54)次],有统计学意义(P<0.01).从而减少了舒芬太尼的使用量,并且用较少的镇痛剂就能到较好的镇痛效果,间接降低不良反应的发生率 MS组有 1例恶心,S组有 3例恶心呕吐,两组比较有统计学意义(P<0.05),说明硫酸镁的使用对术后镇痛效果更明显更安全.
镁离子影响阿片类临床镇痛机制复杂,目前尚不完全清楚.镁离子本身并无镇痛作用,其机制可能是镁离子在中枢神经系统中竞争性拮抗钙离子通道,同时通过突触前受体调节神经递质的释放,以及拮抗 NMDA受体的作用[4,5].
机体受到伤害性刺激及发生炎性反应时可导致钙离子内流,而钙离子可促进释放神经递质及其他炎性介质的释放.镁离子作为钙离子的生理性拮抗剂,作用于去甲肾上腺素能受体突触前膜的 N型钙离子通道,抑制去甲肾上腺素的释放,减少交感神经张力,从而降低疼痛等不良刺激对机体的影响[6].有人对慢性癌痛病人大剂量长时间使用阿片类药物的同时联合使用钙通道阻断剂,结果表明钙通道阻断剂可明显地改善疼痛治疗效果[7].
镁离子还可通过 NMDA受体起镇痛作用.NMDA受体是由两个 NR1亚单位和两个 NR2亚单位构成的异四聚体.NRl是受体的功能部分,构成离子通道;NR2具有调节受体通道动力学的作用.硫酸镁是一种生理性 NMDA受体拮抗剂,可以阻滞与 NMDA受体相关镁离子通道上的内向离子流,阻止细胞外钙离子进入细胞内[8],抑制NMDA受体介导的电流活动,抑制 PKA(蛋白激酶 A)、PKCγ(蛋白激酶 Cγ)、p-αCaMKⅡ (钙一钙调蛋白依赖性蛋白激酶 II)的表达,进而发挥一定的镇痛效应.
研究显示,钙离子浓度在手术后较术前有所下降,但无统计学差异.而两组患者血清镁离子浓度在麻醉结束后比麻醉诱导前浓度低,有统计学意义.PCIA治疗后两组患者血清镁离子浓度比麻醉结束时均增加,同时联合硫酸镁组升高更多,但仍低于麻醉诱导前.尽管目前镁离子在镇痛中的作用机制尚未十分明了,但有较多的文献支持镁离子具有一定的镇痛作用.在本研究中笔者的观察并证实了在行术后 PCIA时加用硫酸镁可加强PCIA镇痛药的效果,减少术后 PCIA镇痛药用量,同时并没发现有明显的血流动力学的改变.我们的结果与 Unlugene等人的研究结果相似,大多数患者术中及术后一段时间内血清镁离子的水平都较低,甚至在术前及术中补过硫酸镁后,术后患者的血清镁离子的水平仍低于正常水平[9].本研究中使用联合硫酸镁的剂量远低于产科子痫病人解痉降压时硫酸镁的剂量,并且 MS组的病人中均未出现膝跳反射消失、呼吸抑制等硫酸镁的并发症,这表明小剂量硫酸镁作为术后疼痛治疗的辅助用药具有可靠的安全性.
总之,联合小剂量硫酸镁联合舒芬太尼术后静脉镇痛方案可减少舒芬太尼的用量,增强镇痛效果,减少不良反应,是一种安全可行的术后静脉镇痛方法.
[1] 罗爱伦.病人自控镇痛 -镇痛治疗新概念[M].北京:中国协和医科大学北京医科大学联合出版社,1999.
[2] 郭瑞宏.开胸手术后应用舒芬太尼与芬太尼自控静脉镇痛的临床观察[J].中国疼痛医学杂志,2006,12(4):221-223.
[3] 李斌飞,张志刚,程 周,等.舒芬太尼静脉自控镇痛对妇科手术患者血浆胃动素及术后恶心呕吐的影响.实用医学杂志,2008,24(13):2229-2231.
[4] Iseri L T,Trench JH.Magnesium:nature's physiologic calcium blocker.Am Heart J,1984,108:188-194.
[5] Evans R H,Francis A A,Watkins JC.Mg2+-like selective antagonism of excitatory amino acid-induced responses by alpha,epsilon-diaminopimelic acid,D-alpha-am inoadipate and HA-966 in isolated spinal cord of frog and immature rat.Barin Res,1978,148:536-542.
[6] Shimosawa T,Takano K,Ando K,Fujita T.Magnesium inhibits norepinephrine release by blocking N-type calcium channels at peripheral sympathetic nerve endings[J].Hypertension.2004,44(6):897-902.
[7] Santillán R,Maestre JM,HurléM A,Flórez J.Enhancement of opiate analgesia by nimodipine in cancer patients chronically treated withmorphine:a preliminary report.Pain 1994;58:129-32.
[8] Carlton SM,Hargett G L.Treatment with the NMDA antagonistmemantine attenuates nociceptive responses to mechanical stimulation in neuropathic rats[J].Neurosci Lett,1995,198:115-8.
[9] Unlügen H,Gündüz M,Ozalevli M,et al.A comparative study on the analgesic effect of tramadol,tramadol plusmagnesium,and tramadol p lus ketamine for postoperative pain management after major abdominal surgery[J].Acta Anaesthesiol Scand,2002,46(8):1025-1030.
