E-cadherin和β-catenin在食管鳞癌组织中的表达及其临床病理学意义
2010-08-14申思宁李印王家祥李克
申思宁 李印 王家祥 李克*
1. 河南省肿瘤医院胸外科,河南 郑州 450008;2. 郑州大学第一附属医院外科,*肿瘤科,河南 郑州 450052
恶性肿瘤的侵袭和转移严重威胁着患者的生命。钙黏附家族和WNT信号通路在肿瘤侵袭与转移过程中起着极为重要的作用。上皮型钙黏素(E-cadherin)是钙黏附家族的主要成员,而β-连环蛋白(β-catenin)是WNT的枢纽分子。
国内外许多研究表明食管鳞癌的浸润转移与E-cadherin的低表达或不表达有关[1-2]。β-catenin是一种多功能的蛋白质,在细胞连接处它与钙黏素相互作用,参与形成黏合带,而游离的β-catenin可进入细胞核,调节基因表达[3]。Wnt信号在动物发育中起重要作用,其异常表达或激活能引起肿瘤发生[4]。
鉴于上述原因,本研究对食管鳞癌组织、癌旁不典型增生组织及正常食管黏膜组织中E-cadherin和β-catenin的蛋白表达进行检测,并分析两者与食管鳞癌临床诸病理因素的关系,从而为食管癌侵袭机制的研究提供新的思路,并为其临床治疗提供新的靶点。
1 材料和方法
1.1 材料 E-cadherin和β-catenin一抗(鼠抗人单克隆抗体,美国abcam公司),PV-9000试剂盒、DAB显色试剂盒(北京中杉试剂公司)。
1.2 方法
1.2.1 标本及处理 62例食管鳞癌手术切除标本于2006年2月26日—3月16日取自河南省肿瘤医院胸外科。其中男性36例,女性26例,年龄38~75岁,所有病例均病理学诊断明确,且术前均无放化疗及免疫治疗史。
1.2.2 免疫组织化学染色 62例标本分别取无坏死癌灶、癌旁组织(距癌灶3 cm以内)及正常黏膜组织(距癌灶5 cm以上),经HE染色证实,癌旁组织中31例有不典型增生,经40 g/L多聚甲醛固定,常规脱水,石蜡包埋,连续切片,切片厚度4~6 μm。62例均经组织学证实为鳞状细胞癌。其中组织学分级Ⅰ级15例,Ⅱ级25例,Ⅲ级22例;伴淋巴结转移者20例,无淋巴结转移者42例。浸润黏膜下层或浅肌层者7例,浸润深肌层或外膜层者55例。一抗工作浓度1∶110;二步法免疫组化检测试剂(PV-9000);DAB显色增强剂。染色方法严格参照免疫组化PV-9000试剂盒说明书进行操作,以PBS液代替一抗作为阴性对照。
1.2.3 结果判断标准 胞膜/胞质棕黄色染色为阳性,按阳性细胞比例和着色强度进行综合评分,阳性比例30%以下为1分,30%~60%为2分,60%以上为3分,着色程度:无着色为0分(阴性),浅黄色为1分(弱阳性),棕黄色为2分(阳性),棕褐色为3分(强阳性),然后根据两者乘积的积分进行统计分析,0~1分为阴性(-),≥2分为阳性[5]。
1.3 统计处理 应用SPSS 13.0统计学软件,行方差分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 E-cadherin蛋白表达及其与临床生物学行为的关系 E-cadherin阳性信号主要位于细胞膜,少数位于细胞质,呈黄色或棕黄色颗粒,其在正常食管黏膜组织、癌旁不典型增生组织及癌组织中的表达依次降低,分别为95.2%(59/62)、71.0%(22/31)、40.3%(25/62),组间比较差异有统计学意义(P<0.05,图1)。E-cadherin在不同组织中的表达及与食管鳞癌分化程度、浸润转移的关系见表1。
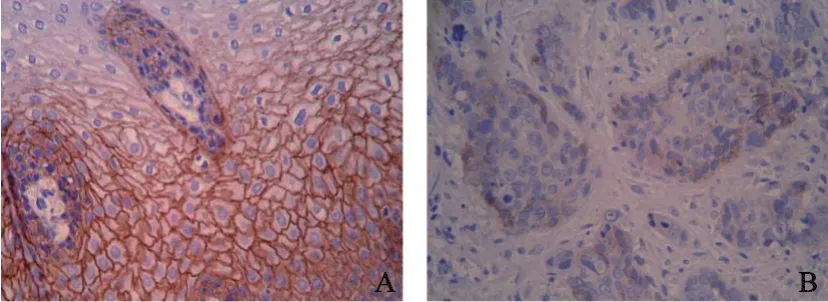
图1 E-cadherin在正常食管黏膜组织与食管鳞癌组织中的表达Fig.1 The expression of E-cadherin in normal esophageal epithelial tissues and esophageal squamous cell carcinoma(ESCC) tissues
2.2 β-catenin的表达及其胞质阳性表达与临床生物学行为的关系 正常食管黏膜组织中β-catenin阳性信号全部位于细胞膜,呈黄色或棕黄色颗粒;高分化食管癌组织中,β-catenin阳性信号主要位于细胞膜,少数位于细胞质,呈黄色或棕黄色颗粒;中分化食管癌组织中,β-catenin 阳性信号主要定位于细胞膜和细胞质,呈黄色或棕黄色颗粒;低分化食管癌组织中,β-catenin阳性信号主要定位于细胞质,少数定位于细胞核,呈黄色或棕黄色颗粒,几乎检测不到膜定位(图2)。随着正常食管黏膜组织向癌组织的转化,β-catenin的膜表达阳性率依次降低,而胞质表达阳性率则依次增高,在低分化癌组织中甚至出现了核表达。β-catenin胞质阳性表达率与食管鳞癌分化程度、浸润转移的关系见表2。
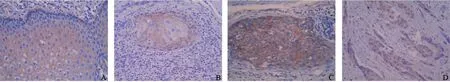
图2 正常食管黏膜组织与食管鳞癌组织中β-catenin的表达Fig.2 The expression of β-catenin in normal esophageal epithelial tissues and esophageal squamous cell carcinoma tissues(PV,×200)
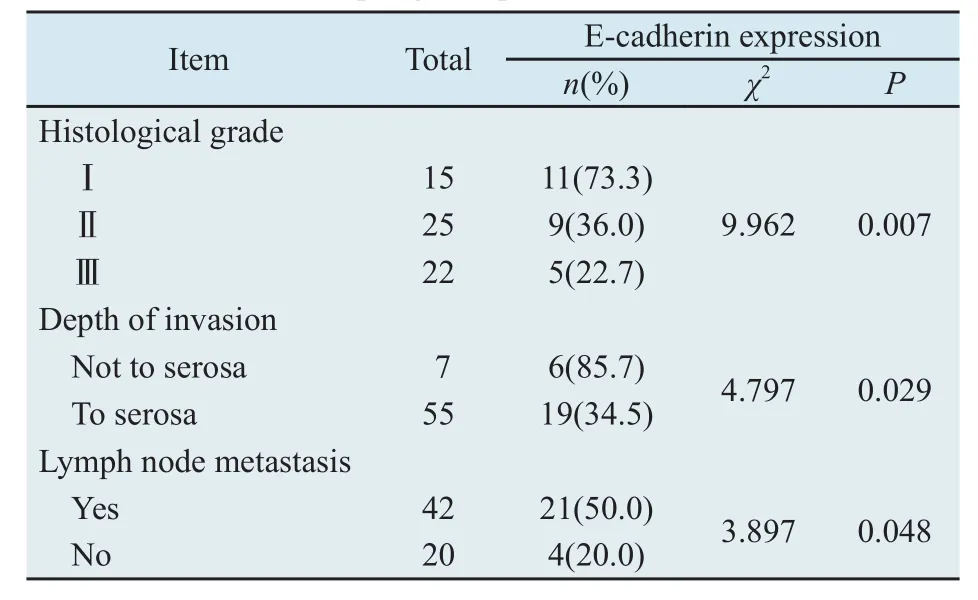
表1 E-cadherin表达与食管鳞癌临床病理因素的关系Tab.1 Correlations of E-cadherin expression to clinicopathologic features of esophageal squamous cell carcinoma
2.3 E-cadherin和β-catenin胞质蛋白表达的相关性 E-cadherin阳性的25例食管鳞癌中有12例β-catenin胞质表达阳性;E-cadherin阴性的37例食管鳞癌中有4例β-catenin胞质表达阴性,Spearman秩相关检验结果显示,E-cadherin与β-catenin胞质表达呈负相关(r=-0.453,P<0.05)。
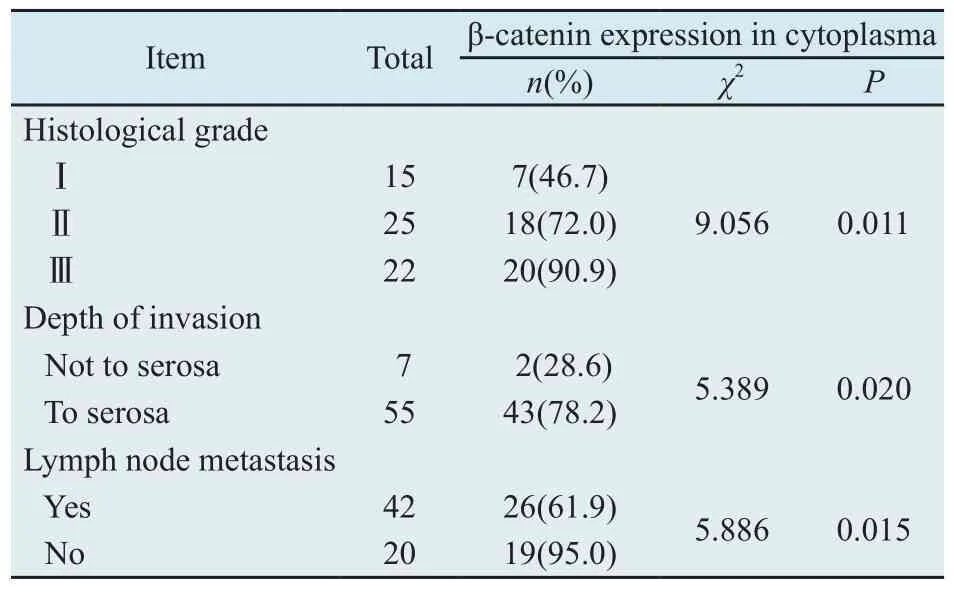
表2 β-catenin阳性表达率与食管鳞癌临床病理因素的关系Tab.2 Correlations of β-catenin expression in cytoplasma to clinicopathologic features of esophageal squamous cell carcinoma
3 讨 论
目前研究认为,E-cadherin是作为一种肿瘤转移抑制因子而发挥作用。E-cadherin通过与β-catenin结合形成Cadherin/Catenin复合体,介导细胞间紧密连接,维持细胞极性,保持组织结构完整,其表达下调或缺失使肿瘤细胞丧失接触抑制,无限制增长、去分化,细胞之间连接松散,易于从局部脱落,获得较强的侵袭能力,容易扩散和转移[1,5-8]。E-cadherin蛋白的表达缺失与肺癌、肝癌、前列腺癌、乳腺癌等的发生、发展有密切的关系[8-9]。在人类肺癌的形成过程中,E-cadherin基因的表达减少,淋巴结转移的患者E-cadherin基因的表达明显减少,肿瘤的TNM分期越晚,E-cadherin的表达水平就越低,其预后就越差[10]。
β-catenin是Cadherin/Catenin复合体的重要组分,通过将细胞外黏附分子与胞质内细胞骨架相互联接,而在维持上皮细胞的正常形态结构及细胞间的连接中发挥重要作用。正常细胞中,β-catenin通过与E-cadherin和细胞骨架蛋白的结合而受限于细胞膜上。当E-cadherin表达缺失,或者通过活化内吞入胞时,胞质中β-catenin水平升高[11]。当胞内β-catenin达到一定的水平时,形成的游离的β-catenin进入胞核内,与DNA结合蛋白TCF(T cell factor)/LEF(lymphoid enhancer factor)结合,在核内共同调控靶基因(如c-myc、c-jun、Fra和Cyclin D1等[12])的表达,从而完成Wnt信号的传递。已有的研究表明,β-catenin在胞质异常累积可出现在结肠癌、肝癌、胃癌、乳腺癌及卵巢癌等多种肿瘤中[13],而且,β-catenin从胞膜到胞质的这种转位特征与部分肿瘤的病理特点和恶性程度密切相关。
本研究结果显示,随着正常食管黏膜组织向癌组织的转化,E-cadherin的阳性表达率依次降低,而β-catenin的膜阳性表达率依次降低,胞质表达阳性率则依次增高,在低分化癌组织中甚至出现了核表达;E-cadherin的阴性表达率及β-catenin的胞质阳性表达率与食管鳞癌的浸润深度、分化程度及淋巴结转移密切相关;E-cadherin和β-catenin在食管鳞癌组织中的表达均呈负相关。提示在食管鳞癌的浸润转移过程中,可能存在着E-cadherin表达减少及β-catenin膜质转位所引起的WNT通路的异常激活,从而为食管癌侵袭机制的研究提供了新思路,并为其临床治疗提供了新靶点。
[1] Uchikado Y, Natsugoe S, Okumura H, et al. Slug expression in the E-cadherin preserved tumors is related to prognosis in patients with esophageal squamous cell carcinoma[J]. Clin Cancer Res, 2005, 1(3): 1174-1180.
[2] Nair KS, Naidoo R, Chetty R. Microsatellite analysis of the APC gene and immunoexpression of E-cadherin, catenin, and tubulin in esophageal squamous cell carcinoma[J]. Hum Pathol, 2006, 37(2): 125-134.
[3] Perrais M, Chen X, Mirna Perez-Moreno M, et al. E-cadherin homophilic ligation inhibits cell growth and epidermal growth factor receptor signaling independently of other cell interactions[J]. Mol Biol Cell, 2007, 18(6): 2013-2025.
[4] Lowy AM, Clements WM, Bishop J, et al. ß-catenin/wnt signaling regulates expression of the membrane type 3 matrix metalloproteinase in gastric cancer[J]. Cancer Res, 2006,66(9): 4734-4741.
[5] Suyama K, Shapiro I, Guttman M, et al. A signalingpathway leading to metastasis is controlled by N-cadherin and the FGF receptor [J]. Cancer Cell, 2002, 2(4): 301-314.
[6] 许良中, 杨文涛. 免疫组织化学反应结果的判断标准[J]. 中国癌症杂志, 1996, 6(4): 229-231.
[7] Wheelock MJ, Shintani Y, Maeda M, et al. Cadherin switching[J]. J Cell Sci, 2008, 121(Pt 6): 727-735.
[8] Bosch FX, Andl C, Abel U, et al. E-cadherin is a selective and strongly dominant prognostic factor in squamous cell carcinoma: a comparison of E-cadherin with desmosomal components[J]. Int J Cancer, 2005, 114(5): 779-790.
[9] Bellovin DI, Bates RC, Muzikansky A, et al. Altered localization of p120 catenin during epithelial to mesenchymal transition of colon carcinoma is prognostic for aggressive disease[J]. Cancer Res, 2005, 65(23): 10938-10945.
[10] Moersig W, Horn S, Hilker M, et al . Transfection of E-cadherin cDNA in human lung tumor cells reduces invasive potential of tumors[J]. Thorac Cardiovasc Surg, 2002,50(1): 45-48.
[11] Piedra J, Miravet S, Castano J, et al. P120 Catenin-associated fer and fyn tyrosine kinases regulate β-catenin Tyr-142 phosphorylation and β-catenin-a-catenin interaction[J].Mol Cell Biol, 2003, 23(7): 2287-2297.
[12] Cadigan KM, Liu YI. Wnt signaling: complexity at the surface[J]. J Cell Sci, 2006, 119(Pt 3): 395-402.
[13] Nabais S, Machado JC, Lopes C, et al. Patterns of beta-catenin expression in gastric carcinoma: clinicopathological relevance and mutation analysis[J]. Int J Surg Pathol, 2003, 11(1):1-9.
