胆管癌的蛋白质组学分析
2010-08-14吕济相王济明罗诗樵黄国飞
吕济相 王济明 罗诗樵 黄国飞
重庆医科大学附属第一医院肝胆外科,重庆 400016
胆管癌是消化系统常见的恶性肿瘤,在我国的消化道恶性肿瘤中居第5位,占各种恶性肿瘤死亡的0.48%,每年约有4 500人死于胆道恶性肿瘤。该病起病隐匿,临床症状及体征出现晚,早期诊断困难、预后差,因此寻找能特异性早期诊断胆管癌的方法是目前临床上迫切需要解决的问题[1]。本研究利用蛋白质组学技术[2]对胆管癌组织和胆管正常胆管黏膜组织进行对比分析,找出存在的差异蛋白,为筛选可用于临床早期诊断胆管癌的特异性生物标志物提供理论依据。
1 材料和方法
1.1 标本 本实验中用于蛋白质组学研究的组织标本全部来自于重庆医科大学附属第一医院肝胆外科,取2007—2009年间的16个病例,其中男性、女性各8例,年龄35~76岁,平均年龄55.5岁,中位年龄57岁。术前均未进行放、化疗。所有病例切除的标本均经病理证实为胆管腺癌,其中高分化4例,中分化4例,低分化8例。正常胆管组织来源于肝移植患者供肝修肝丢弃的部分。实验标本收集后均立刻放入液氮罐中冻存。
1.2 主要试剂 固相pH梯度干胶条(IPG)(pH:3~10,17 cm)(Bio-Rad公司)、IPG缓冲液(pH:3~10)、 尿素、硫脲、3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸(3-[(3-Cholanidopropyl)dimethylammonio]-1-propanesulfonate,CHAPS)、二硫苏糖醇(dithiothreitol,DTT)、三羟甲基氨基甲烷[tris(hydroxymethyl)aminomethane, Tris-base]、碘乙酰胺(iodoacetamide, IAA)、甘氨酸、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、硝酸银、十二烷基磺酸钠(sodium dodecyl sulfate,SDS)、甘油、琼脂糖、胰蛋白酶、铁氰化钾和2DE-Cleanup试剂盒GE(均 Amersham 公司)、苯甲基磺酰氟(PMSF)、四甲基二乙胺(tetramethylethylenediamine,TEMED)、乙腈、三氟乙酸(Sigma公司)、牛血清白蛋白(bovine serium albumin,BSA)(上海生工),其余为国产分析纯试剂。
1.3 主要软件 PDQuest8.0 2-DE图像分析软件(Bio-rad公司)、凝胶扫描仪Scanmaker 4685(Bechman公司)、MALDI-TOF-MS Voyager DE-PRO(美国ABI公司)等。
1.4 样品制备 在液氮条件下将组织研磨成粉末,加入细胞裂解液(尿素7 mol/L,硫脲2 mol/L,CHAPS 40 g/L,DTT 65 mmol/L,体积分数0.002的Bio-lyte两性电解质),加入DNA、RNA酶各5μL,4 ℃冰箱静置30 min,然后4 ℃ 16 000 r/min、离心1 h,取少量上清液用Bradford法定量,其余上清液分装并且放在-80℃冰箱冻存。
1.5 固相pH梯度双向凝胶电泳 ⑴第一向固相pH梯度等电聚焦:主要按Gorg等[3]的方法和Protean IEF cell等电聚焦系统指南进行;⑵第二向SDS聚丙烯酰胺凝胶电泳:将平衡后的胶条移至1.0 mm厚的120 g/L的SDS-PAGE胶上至溴酚蓝条带迁移至距底边1~2 cm处;⑶银染:参照文献[4]进行硝酸银染色。
1.6 凝胶图像分析 在相同条件下对每例患者的胆管癌组织和正常组织的总蛋白样品分别进行了3次双向凝胶电泳,银染显色的凝胶通过GS-800凝胶扫描仪获取图像,用PDQuest软件对图像进行背景消减、斑点检测、匹配和获取斑点位置坐标等。统计分析使用t检验法。选取蛋白斑点表达差异大于2倍、t检验P<0.05的斑点作为研究蛋白。
1.7 制备质谱样品 蛋白质点从银染凝胶中切取成1~2 mm2大小的胶块,经水洗、脱色、脱水、酶解和萃取后送质谱分析。
1.8 质谱数据的分析 将质谱数据使用Mascot软件在NCBInr数据库中进行搜索,参数设置为:种属Homo sapiens;肽段容忍度75×10-6;离子碎片容忍度0.2;蛋白质检索得分大于95的认为是成功鉴定的蛋白。
2 结 果
2.1 凝胶图谱分析结果 胆管癌组织和正常组织总蛋白分布模式非常相似(图1),其识别的蛋白质斑点数分别为(1 087±40)和(1 048±11),凝胶中斑点的平均匹配率分别为84.0和80.3。第一向等电聚焦(IEF)的平均偏差为(1.16±0.29)mm,第二向SDS-PAGE方向上的斑点位置偏差为(1.00±0.38) mm。
PDQuest软件分析显示,有70个蛋白质点仅存在于癌组织中(图1A),有8个蛋白质点仅出现在正常组织中(图1B);癌组织与正常黏膜组织相比,有19个蛋白质点表达上调且大于5倍,正常组织与癌组织相比,上调相差5倍的蛋白质点有41个。
2.2 质谱分析结果 在胆管癌组织和胆管正常黏膜组织的2-DE图谱中,选取胆管组织癌中高表达的蛋白斑点18个,进行MALDITOF-MS分析,得到蛋白质点的肽质量指纹图(PMF),18个点共获取18张PMF。图2为衔接蛋白成纤维细胞生长因子受体底物2蛋白的肽质量指纹图。我们根据从数据库查到的蛋白点的组织来源性,以及与胆管癌分化和生长的相关性大小列出了6个意义相对较大的差异蛋白点(表1)。
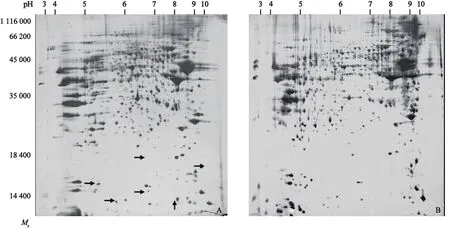
图1 胆管癌组织(A)和胆管正常组织(B)的2-DE图谱Fig.1 Two-dimensional protein maps of cholangiocarcinoma (A) and matched normal tissue (B)
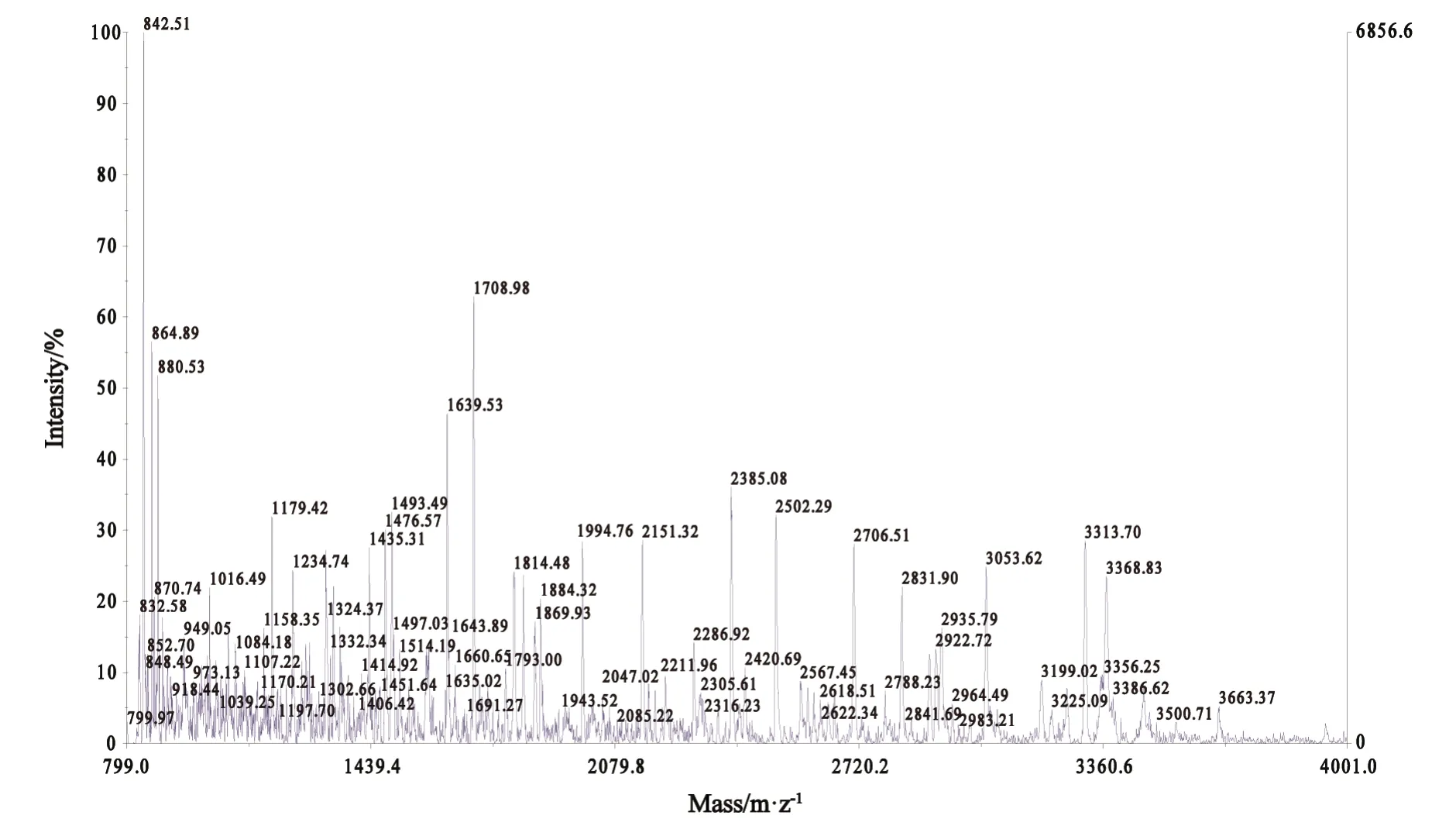
图2 衔接蛋白成纤维细胞生长因子受体底物2蛋白的肽质量指纹图(PMF)Fig.2 The peptide mass fingerprinting of fibroblast growth factor recptor substrate 2
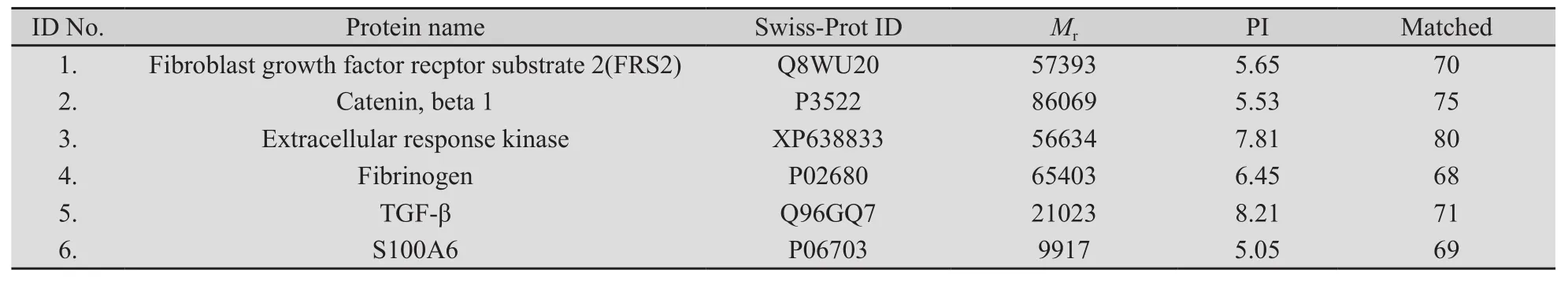
表1 胆管癌组织与正常组织差异蛋白点的鉴定结果Tab.l Characteristics of identified proteins expressed in cholangiocarcinoma and matched normal tissue
3 讨 论
尽管近年来对早期发现胆管癌从生理、生化和分子生物学等进行了许多研究,如对胆汁中的癌胚抗原(CEA)、糖类抗原等进行检测,对胆汁中以及肿瘤标本的癌基因和抑癌基因等研究也取得了一些进展,如目前实验室用于胆管癌检测的癌抗原19-9(CA19-9)的敏感度为67.5%,特异度达到86.8%[5]。但总体来说,能用于临床、同时具有高敏感性及高特异性的早期诊断胆管癌和提高其预后的标志物尚未发现。目前用于蛋白质组学研究的主要技术之一是双向凝胶电泳技术,我们通过反复摸索,建立了分辨率高、重复性好的双向凝胶电泳方法系统,这保证了我们进行肿瘤蛋白质组学差异分析的基本条件。
本实验我们鉴定出了一些差异蛋白质,其中匹配分数大于63分的差异蛋白点共有18个,并筛选出6个意义相对较大的差异蛋白点。
连环蛋白是一组具有相似结构的胞内糖蛋白家族,它们的氨基酸组成中都具有数个相同序列的结构域。目前将该家族分为四大类:α、ß、γ和p120ctn,其中ß-连环蛋白(ßcatenin)尤为重要。ß-catenin的氨基端有130个氨基酸,富含Ser、Thr位点,控制着分子的稳定性;羧基端由100个氨基酸组成,负责激活靶基因的转录。ß-catenin最重要的结构是含有12个armadillo重复区,它们形成一个棒状的超螺旋结构,可防止蛋白水解,在与E-钙黏蛋白(E-cad)、活化蛋白C(APC)、转化生长因子(TCF)等的结合过程中有重要作用[6]。ß-catenin基因突变后,胞质内游离ß-catenin积聚,发生核转位并与转录因子Tclf4结合,启动c-myc、细胞周期蛋白D1(cyclin D1)、基质金属蛋白酶MMP-7、CD44等靶基因的转录、表达,这些靶基因在细胞增殖和癌变过程中起着重要作用[7]。郑启昌等[8]研究发现在肝门部胆管癌细胞中ß-catenin存在异常表达,并与c-myc阳性表达呈显著的正相关,且ß-catenin异常表达与肝门部胆管癌的淋巴结转移密切相关。这可能是因为癌细胞膜上的ß-catenin向胞质中转移,导致 E-cad/cat复合体结构破坏和功能障碍,使防止癌细胞转移的屏障消失,从而致使癌细胞转移。
细胞外信号调节激酶(extracellular response kinase,ERK)信号转导通路是调控细胞增殖的重要途径。近期研究表明,ERK蛋白表达与某些恶性肿瘤的浸润转移密切相关。据王江宁[9]报道p-ERK1/2蛋白在高、中、低分化胆管癌组织中的表达组间比较均有统计学差异,其表达与肿瘤的病理分化程度密切相关,分化越差P-ERK1/2蛋白表达越高。但与年龄、性别、临床TNM分期无关。此外,p-ERK1/2蛋白阳性表达的患者术后无复发生存时间显著延长。因此,P-ERK1/2的表达可能与肿瘤的发展有关,并对判断胆管癌预后有一定价值。
蛋白质组学技术为研究肿瘤相关蛋白提供了有效手段,本实验运用双向凝胶电泳和质谱技术,鉴定出与胆管相关的蛋白18个。某些蛋白与肿瘤的发生发展、转移以及细胞分化相关[10]。对其功能的深入研究,有可能为胆管癌的诊断、治疗提供新的靶向性分子标志物,以达到早期发现、有效治疗的目的,改善总体预后。
[1] Jabara B, Fargen KM, Beech S, et al. Diagnosis of cholangiocarcinoma: a case series and literature review[J].J La State Med Soc, 2009, 161(2): 89-94.
[2] 魏晓丽, 王悦. 癌蛋白质组学技术及其应用[J]. 基础医学与临床, 2008, 28(10): 1107-1110.
[3] Gorg A, Obermaier C, Boguth G, et al. The current state of two-dimensional electrophoresis with immobilized ph gradient[J]. Electrophoresis, 2002, 21(6): 1037-1053.
[4] Mortz E, Kroght N, Vorum H, et a1. Improved silver staining protocols for high sensitivity protein identification using matris-assisted laser desorption/ionization -time of flight-analysis[J]. Proteomics, 2001, 11(11): 1359-1363.
[5] Weber A, Schmid RM, Prinz C. Diagnostic approaches for cholangiocarcinoma[J]. World J Gastroenterol, 2008,14(26): 4131-4136.
[6] De Langhe SP, Carraro G, Tefft D, et al. Formation and differentiation of multiple mesenchymal lineages during lung development is regulated by beta-catenin signaling[J].PLoS One, 2008, 3(1): 1516-1528.
[7] Vespúcio MV, Turatti A, Modiano P, et al. Intrinsic denervation of the colon is associated with a decrease of some colonic preneoplastic markers in rats treated with a chemical carcinogen[J]. Braz J Med Biol Res, 2008, 41(4): 311-317.
[8] 郑启昌, 陈海波, 左克强, 等. ß-连环蛋白在肝门部胆管癌中的表达及其与 c-myc 表达的关系[J]. 中国普外基础与临床杂志, 2005, 12(1): 67-70.
[9] 王江宁. ERK1/2蛋白在胆管癌组织中的表达及意义[J].山东医药, 2008, 48(14): 60-61.
[10] Sahni A, Simpson-Haidaris PJ, Sahni SK, et al. Fibrinogen synthesized by cancer cells augments the proliferative effect of fibroblast growth factor-2(FGF-2)[J]. Thromb Haemost,2008, 6(1): 176-183.
