小细胞肺癌干细胞样细胞的分离鉴定
2010-08-14高全立汪萍
高全立 汪萍
河南省肿瘤医院生物治疗科,*血液科,河南 郑州450008
肿瘤干细胞理论提出在肿瘤组织中存在有少量肿瘤干细胞。类似于正常干细胞,肿瘤干细胞也具有自我复制和分化功能,对传统的治疗方法如放疗和化疗不敏感,它们是肿瘤转移和复发的根源[1]。最近几年的研究证实在多种肿瘤中存在有肿瘤干细胞[2]。乳腺癌干细胞和脑胶质瘤干细胞是较早发现的实体肿瘤干细胞,对它们的生物学特性已有比较深入的研究[3-4]。肺癌无论在我国和全球都是发病率和病死率最高的肿瘤,然而关于人肺癌干细胞研究的文献非常少,仅有少数几篇文献报道CD133为肺癌的干细胞标记[5]。为了研究小细胞肺癌干细胞的生物学特性,我们应用新型无血清培养基从新鲜切除的肺癌组织中培养了原代肿瘤细胞,并成功传代建立了细胞系。应用流式细胞分析及分选技术,我们首次鉴定出CD44及CD90可能为小细胞肺癌的干细胞标记,并对它们的生物学特性进行了研究。
1 材料和方法
1.1 主要实验材料 Defined K-SFM 无血清培养基、Ⅱ型胶原酶、RPMI 1640、PBS、TrypLEEMExpress等购自Invitrogen 公司。超低黏附的96孔培养板、普通培养瓶及培养板均购自Corning公司。EGF(表皮生长因子)和bFGF(碱性成纤维生长因子)购自Peprotech公司。CD44-FITC、CD90-APC及相应的同型对照抗体购自BD公司。
1.2 原代细胞的培养及建系 新鲜手术切除的肺癌组织,在6孔板中用含青霉素及链霉素的RPMI 1640反复冲洗并剔除坏死组织后,用无菌剪刀反复剪切成约1 mm3大小的组织块。收集剪切后的肿瘤组织置于底面积为25 cm2的培养瓶中,用含有Ⅱ型胶原酶400 U/mL的Defined K-SFM 无血清培养基在CO2体积分数为5%的培养箱中37 ℃消化3 h后,倒置显微镜下观察大部分细胞为单个细胞,用RPMI 1640洗涤,300×g离心3次彻底去除胶原酶。收集消化后的肺癌细胞,用含EGF 20 ng/mL、bFGF 10 ng/mL 的Defined K-SFM培养基悬浮细胞并转移到25 cm2的培养瓶中,在含CO2体积分数为5%的培养箱中37 ℃培养,每3天换新鲜培养基1次。当细胞生长到80%融合时,用TrypLEEMExpress消化后传代。培养的前4代细胞在传代时每次都保留部分细胞冻存于液氮中。
1.3 免疫组织化学 将培养的细胞用胰酶消化后收集到离心管中,500×g离心10 min。去除上清液后在细胞团中加入2滴血浆和凝血酶混匀1 mim。血浆凝固后加入4%的甲醛固定30 mim,细胞团取出后用石蜡包埋。然后用常规的免疫组化方法检测P53、CK5、CD44和AE1在肿瘤细胞中的表达情况。
1.4 流式细胞学分析及分选肿瘤干细胞 于75 cm2培养瓶中原代培养后取传代在4代以内对数生长期的肺癌细胞,PBS冲洗2次后,加入2 mL的TrypLEEMExpress室温消化6 min。收集消化后的单个细胞,PBS洗涤2次,调细胞浓度为1×107个/mL,分别加入CD133-FITC及CD90-APC抗体温育20 min,最后用RPMI 1640 洗涤2次。用1 mL的RPMI1640悬浮细胞,过40 μm的无菌筛网,加PI至终浓度为1 μg/mL放置冰上待分析分选。在同样的条件下标记同型对照抗体细胞组。
应用FACSAria Ⅱ流式细胞仪 (美国BD Bioscience公司)分析分选待检的细胞。细胞样品上机后,收集5万个细胞应用BD FACSDiva软件分析。首先根据细胞的前向角和侧向角特性,圈出为单个且有活性的细胞群,再进一步圈出PI-的细胞群,对比同型对照抗体组的细胞,依据不同抗体的荧光标记特性,圈出所要分析的细胞。最后将所选的细胞无菌分选到分选管中。
1.5 单细胞克隆形成试验 用流式细胞仪将单个细胞直接分选到96孔板中,每孔1个细胞,用200 μL/孔的Defined K-SFM培养基培养。每种细胞设120个复孔。分选后用倒置显微镜观察,将只含有1个细胞的孔标记。以后每3天换液1次,定期观察各孔中形成细胞克隆的特性并计数照相。
1.6 平板集落形成试验 流式细胞仪分选的细胞计数后接种到6孔板中,每孔250个细胞,用2 mL的Defined K-SFM培养基培养。每种细胞设3个复孔。以后每隔3天换液1次,并定期用倒置显微镜观察培养细胞形成集落的状况。当大部分集落增长的细胞数目大于100个时,停止培养并用结2%的结晶紫染色。具体染色步骤为:先用PBS小心冲洗细胞1次,4%甲醛室温固定30 min,PBS再冲洗2次,2%结晶紫染色1 h,清水冲洗后照相并计数每孔中细胞集落的数目。
1.7 细胞球形成实验 将分选的细胞培养于超低黏附的96孔培养板中,每孔100个细胞,用200 μL/孔的Defined K-SFM培养基培养。每种细胞设10个复孔。以后每隔2天换液1次,换液时小心吸取每孔中上层培养液60 μL,然后再补加60 μL新鲜培养液。定期用倒置显微镜观察各个孔中形成细胞球的情况并记录照相。每大于50个细胞的细胞团计数为1个细胞球。
1.8 统计处理 应用SPSS 10.0统计软件进行统计学分析,计量资料用表示,组间比较采用t检验。
2 结 果
2.1 小细胞肺癌的原代培养和传代建系 将1例来源于小细胞肺癌的肿瘤组织经Ⅱ型胶原酶消化为单个细胞后,在含有EGF和bFGF的Defined K-SFM培养基中培养。培养至第3天,培养瓶中开始出现典型贴壁生长的上皮细胞。该培养体系能选择性生长肿瘤上皮细胞,几乎没有成纤维细胞的生长(图1)。当细胞生长的密度达到80%融合时,经特殊的胰酶消化后细胞可成功传代建立细胞系,将其命名为LC004。该细胞系细胞的生长速度较快,在1∶10比例传代的情况下,每4天即可传代1次。到目前为止,该细胞系已稳定传代到25代以上。这个小细胞肺癌细胞系的建立为以后肺癌干细胞的分离鉴定打下了良好的基础。为了较好地反映原位肺癌细胞的功能,以下试验中所选用的细胞均为细胞系中第3、4代的细胞。
2.2 免疫组织化学鉴定培养的小细胞肺癌细胞 我们对培养的细胞用免疫组织化学的方法进行了初步鉴定,结果显示培养的细胞表达AE-1、CK-5、P53和CD44(图2)。考虑到我们从肿瘤组织中培养的细胞在1∶10比例传代的情况下能稳定传代到25代以上,且培养的细胞表达P53,这些细胞应是小细胞肺癌细胞。
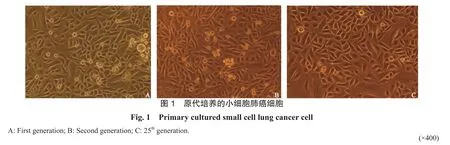

图2 建立的细胞系表达AE1(A)、CK5(B)、P53(C)和CD44(D)Fig.2 Established cell line expressed AE1(A), CK5(B), P53(C) and CD44(D)(×200)
2.3 小细胞肺癌细胞系中部分细胞高表达CD44 为了寻找可能的肺癌干细胞标记,我们首先用CD44-FITC标记肿瘤细胞后进行流式细胞学分析,发现细胞可被分为2群,其中一小群细胞(图3的P3细胞群,约有5.1%)明显高表达CD44(CD44++),从流式细胞学上分析这群细胞具有干细胞的特性,表现为所占细胞群的比例较低,细胞直径较小,而主群细胞为CD44+的细胞(图3的P2细胞群)。
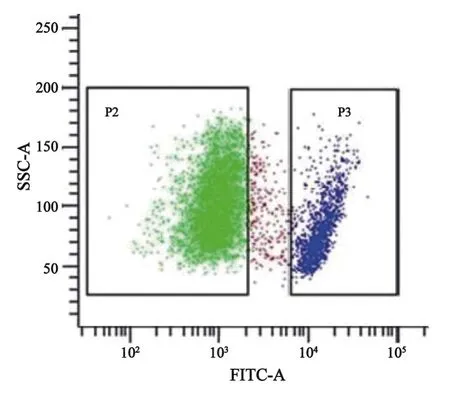
图3 CD44-FITC标记后流式细胞分析小细胞肺癌细胞系LC004Fig.3 Flow cytometry analysis of CD44-FITC stained small cell lung cancer cell line LC004
2.4 只有CD44++的小细胞肺癌细胞可形成完全克隆 将1个细胞接种于96孔板的1个孔中,经过2周培养后观察到CD44++细胞和CD44+细胞形成的克隆特性有明显不同。CD44++可形成3种克隆,其中1种克隆的细胞排列紧密,细胞体积较小,形成的克隆直径较大,这样的克隆为完全克隆(holoclone);与完全克隆相反,另一种克隆的细胞排列稀疏,细胞体积较大,形成的克隆直径较小,这样的克隆为流产克隆(paraclone);介于两者之间的克隆为部分克隆(meroclone)(图4)。文献报道只有肿瘤干细胞可形成完全克隆[6]。与CD44++细胞不同,CD44+细胞只能形成部分克隆和流产克隆。这些结果提示CD44++的肺癌细胞可能富集了肿瘤干细胞。
2.5 CD44++细胞具有较强的集落形成能力将250个分选的细胞接种到6孔板中的1个孔中,CD44++细胞形成的集落数为45.7±4.2,CD44+细胞形成的集落数为18.3±4.7,两者相比差异有统计学意义(P<0.01)。且CD44++细胞形成的集落直径较大,细胞排列密集(图5)。

图4 CD44++肺癌细胞形成的3种克隆Fig.4 Three clones formed from CD44++ lung cancer cells(×100)

图5 CD44++和CD44+细胞在6孔板中形成的集落Fig.5 Colonies formed from CD44++ and CD44+ cells in 6 well plates
2.6 细胞球形成试验 为了进一步证实只有CD44++细胞中富集了肿瘤干细胞,我们进行了细胞球形成试验。结果发现当100个/孔的细胞,在超低黏附的96孔培养板中培养19 d后,7/10孔中的CD44++细胞可以增殖形成细胞球(图6A),而CD44+细胞不能形成任何一个细胞球,且培养的过程中细胞逐渐死亡(图6B)。


图7 CD44-FITC和CD90-APC双标记小细胞肺癌细胞后流式细胞分析的结果Fig.7 Flow cytometry analysis of small cell lung cancer cell line co-stained with CD44-FITC and CD90-APC
2.7 CD90可能是小细胞肺癌的干细胞标记为了寻找更多的肺癌干细胞标记,我们用CD44-FITC和CD90-APC共同标记肿瘤细胞进行流式细胞仪分析,结果发现小细胞肺癌细胞可被分为4群,分别为CD44+CD90-、CD44+CD90+、CD44++CD90-和CD44++CD90+,其中CD44++CD90+细胞所占比例为1.9%。为了检测CD44++CD90+细胞是否富集了最多的肺癌干细胞,我们比较了CD44+(含CD44+CD90-及CD44+CD90+细胞,图7的P2细胞群)、CD44++CD90-(图7的P3细胞群)及CD44++CD90+(图7的P4细胞群)细胞的细胞球形成能力。结果CD44+细胞仍不能形成任何细胞球,9/10的CD44++CD90+细胞孔中可形成细胞球,而只有1/10的CD44++CD90+细胞孔中可形成细胞球。这些结果提示CD44++CD90+富集了最多的肿瘤干细胞,CD44++CD90-群细胞中可能也含有少量的肿瘤干细胞,而CD44+CD90+和CD44+CD90-群细胞中没有肿瘤干细胞。
3 讨 论
关于肿瘤干细胞的分离鉴定,目前常用的方法有直接从新鲜肿瘤组织中分离、从已有的稳定建立的肿瘤细胞系中分离和从原代培养的肿瘤细胞中分离。从新鲜切除的肿瘤组织中直接分离的肿瘤干细胞能较真实地反映原位肿瘤干细胞的生物学特性,但由于新鲜切除的肿瘤组织中含有多种细胞成分,且多数分离到的肿瘤干细胞不能在体外培养,这些缺点使肿瘤干细胞的分离鉴定工作变得十分艰难,对其生物学特性进行研究也很困难。从已有稳定建立的肿瘤细胞系中分选肿瘤干细胞取材容易,操作相对简单,但由于细胞系经过长期体外或动物体内传代,其中的肿瘤干细胞可能已发生很大变异,分离到的肿瘤干细胞不一定能真实反映原位肿瘤干细胞的生物学特性。而从原代培养或经体外短期传代培养的肿瘤细胞中分离的肿瘤干细胞可以解决上述两种分离方法的局限性,但由于肿瘤细胞的原代培养十分困难,限制了该技术的广泛应用。本研究中我们应用一种特殊的无血清培养基,成功地从1例小细胞肺癌组织中培养出了纯度很高的原代肺癌细胞,且细胞很容易传代扩增到25代以上。有文献报道应用无血清培养基培养的肿瘤细胞呈悬浮的细胞球生长,且细胞一旦贴壁后肿瘤干细胞就会发生分化[7]。我们应用Defined K-SFM培养基培养的小细胞肺癌细胞均为典型的贴壁细胞,而我们的试验结果支持肺癌干细胞存在于这些贴壁生长的细胞中。从试验操作的过程来看,从贴壁的细胞中分离肿瘤干细胞较从细胞球中分离肿瘤干细胞更容易可行。该细胞系的建立为我们后续的肿瘤干细胞分离鉴定工作打下了良好的基础。
肿瘤干细胞和正常干细胞往往具有相同的干细胞标记。CD44是间充质干细胞的标记,也是多种肿瘤干细胞的标记[8],但CD44是否是肺癌的干细胞标记尚无文献报道。本研究中我们首先用流式细胞仪检测了CD44在原代建立的小细胞肺癌细胞系中的表达情况,结果发现几乎所有的细胞都表达CD44,但其中约5.1%的细胞CD44明显强阳性表达,且它们的直径较小,符合肿瘤干细胞的特点。为了验证CD44强阳性的细胞是否具有肿瘤干细胞的特点,我们用流式细胞仪分选了CD44++和CD44+的细胞并研究它们的生物学特性,结果发现只有CD44++细胞可以形成完全克隆,而CD44+细胞只能形成部分克隆和流产克隆。文献报道只有肿瘤干细胞可以形成完全克隆,祖细胞可以形成部分克隆,而终末分化的细胞不能形成克隆或只能形成流产克隆[6]。这些结果提示小细胞肺癌干细胞富集在CD44++的细胞群中。与单细胞克隆的结果相似,在平板集落形成试验中,CD44++形成的集落明显多于CD44+细胞,且CD44++细胞形成的集落直径较大,细胞排列紧密,说明CD44++细胞具有较强的增殖能力。在超低黏附的培养板上能形成细胞球是肿瘤干细胞的主要特点之一[9]。在我们的试验结果中,只有CD44++的细胞可以形成细胞球,而CD44+细胞不能形成细胞球,进一步证明了肺癌干细胞富集在CD44++细胞中。
CD90是间充质干细胞的表面标记,也是肝癌干细胞的表面标记[10]。在本研究中我们发现,当用CD44和CD90共同标记小细胞肺癌细胞时,有1.9%的肺癌细胞的表达标记为CD44++CD90+。为了验证肺癌干细胞是否富集在CD44++CD90+细胞中,我们重点比较了CD44++CD90+和CD44++CD90-细胞的细胞球形成能力,结果CD44++CD90+形成细胞球的能力是CD44++CD90-细胞的8倍,而CD44+CD90+和CD44+CD90-细胞均不能形成细胞球,这些结果提示肺癌干细胞主要在CD44++CD90+细胞群中。
本研究借助于我们建立的原代肿瘤细胞培养技术,首次证实小细胞肺癌干细胞高表达CD44和CD90,并成功分离到了小细胞肺癌干细胞样细胞,为下一步深入研究肺癌干细胞的生物学特性和寻找有效的肺癌治疗方法打下了较好的基础。
[1] Frank NY, Schatton T, Frank MH. The therapeutic promise of the cancer stem cell concept[J]. J Clin Invest, 2010,120(1):41-50.
[2] Huang D, Gao Q, Guo L, et al. Isolation and identification of cancer stem-like cells in esophageal carcinoma cell lines[J]. Stem Cells Dev, 2009, 18(3): 465-473.
[3] Charafe-Jauffret E, Ginestier C, Birnbaum D. Breast cancer stem cells: tools and models to rely on[J]. BMC Cancer,2009, 25(9):202-211.
[4] Park DM, Rich JN. Biology of glioma cancer stem cells[J].Mol Cells, 2009, 28(1):7-12.
[5] Alison MR, Lebrenne AC, Islam S. Stem cells and lung cancer:future therapeutic targets[J]. Expert Opin Biol Ther, 2009,9(9):1127-1141.
[6] Li H, Chen X, Calhoun-Davis T, et al. PC3 human prostate carcinoma cell holoclones contain self-renewing tumorinitiating cells[J]. Cancer Res, 2008, 68(6):1820-1825.
[7] Singh SK, Hawkins C, Clarke ID, et al. Identification of human brain tumour initiating cells[J]. Nature, 2004, 432(7015):396-401.
[8] Marhaba R, Klingbeil P, Nuebel T, et al. CD44 and EpCAM:cancer-initiating cell markers[J]. Curr Mol Med, 2008,8(8): 784-804.
[9] 赵璇, 冉宇靓, 遇珑, 等. 人肝癌组织中肿瘤干细胞样细胞的分离及鉴定[J]. 中国肿瘤生物治疗杂志, 2009, 16(5):436-441.
[10] Yang ZF, Ho DW, Ng MN, et al. Significance of CD90+cancer stem cells in human liver cancer cell[J]. 2008, 13(2): 153-166.
