阿霉素诱导非缺血性心肌病模型小鼠方法的建立及其可行性评价
2010-08-06黄楚珠黄伟哲梁结玲肖大伟汕头大学医学院第一附属医院汕头市515041
黄楚珠,黄伟哲,梁结玲,肖大伟(汕头大学医学院第一附属医院,汕头市 515041)
阿霉素是蒽环类抗肿瘤药物,它能产生氧自由基而诱导心肌细胞凋亡,常被用于诱导非缺血性心肌病模型。目前国内、外多采用兔、大鼠[1]作为阿霉素的诱导对象,但由于采用这2种动物为对象具有体质量大、用药多、费用高、诱导心肌病模型的时间过长(一般8~12周)的缺点,为此,笔者采用小鼠作为诱导对象,必将节省大量费用。本研究通过一次性注射大剂量阿霉素的方式,短时间内建立小鼠非缺血性心肌病模型,并用高频率超声心动图评价其可行性。
1 材料
1.1 动物
BALB/c小鼠78只,♂,体质量22~24 g,周龄8~12周,由香港中文大学动物实验中心提供,动物实验合格证号:2005A018。
1.2 试药
阿霉素注射液(澳洲Ebewe公司,批号:406151,规格:2 mg·L-1)。
1.3 仪器
SONOS7500多普勒超声诊断仪(美国飞利浦公司);AxioplanⅡimaging荧光相差倒置显微镜(德国Zeiss公司);TECNAI10透射电子显微镜(荷兰飞利浦公司)。
2 方法
2.1 超声心动图检查
小鼠随机分为对照组和给药组,各39只。给药前所有小鼠均接受超声心动图检查,获取基础状态超声指标。给药组经腹腔一次性注射阿霉素20 mg·kg-1[2],对照组注射同容量的生理盐水。2组在给药后第3、4、5天进行超声心动图检查,测定各项指标。超声检查前2~3 d重复训练清醒状态下的小鼠[3]。训练方法:左手捉鼠,右手将探头固定于小鼠左胸前壁,模仿超声过程,一般重复6~8次,直至小鼠心率稳定于540~650次·min-1,随后剔除左胸前壁鼠毛。实验超声检查由2人完成,一人捉鼠并固定探头,另一人操作机器。基础状态下和注射阿霉素后第3、4、5天检查小鼠,探头放置于左胸前壁,切取满意的左室长轴切面后,在乳头肌水平将M型取样线垂直于左室后壁而获得M型超声心动图,随即获取主动脉流速曲线。获取的超声图像传送至工作站保存,并由2位未参与试验的超声师行数据统计分析。选取3个连续心动周期,采用美国超声心动图协会推荐方法进行测量,测量数据包括:舒张末期左室内径(LVEDD)、收缩末期左室内径(LVESD)、心率(HR),左室收缩功能由左室短轴缩短率(FS)和每分钟输出量(CO)评价。HR由主动脉多普勒血流信号测量。FS和CO由以下公式 计 算 :FS=(LVEDD - LVESD)/LVEDD;CO=HR ×(LVEDD3-LVESD3)。
2.2 组织学检查
超声检查完毕后在第5天处死所有小鼠,取心脏,称重,取左心室中上1/3切面,10%福尔马林液固定,石蜡包埋,5 μm切片,HE染色。于40×10倍荧光相差倒置显微镜下根据Billingham推荐方法评价每只小鼠心肌的病变程度[4],即根据心肌胞浆空泡化和肌纤维丧失占所取切面的百分数进行评分,随后取各组评分的中位数:0分表示切面未见心肌胞浆空泡化和肌纤维丧失;1分表示心肌胞浆空泡化和肌纤维丧失占切面<5%;1.5分表示心肌胞浆空泡化和肌纤维丧失占切面5%~15%;2.0分表示心肌胞浆空泡化和肌纤维丧失占切面16%~25%;2.5分表示心肌胞浆空泡化和肌纤维丧失占切面26%~35%;3分表示心肌胞浆空泡化和肌纤维丧失占切面>35%。
2.3 电镜检查
取小鼠的左心室游离壁中上1/3心肌标本,放置4%戊二醛固定0.5 h,制作成体积约1 mm3的样本,送电镜室,用2%四氧化锇(pH 7.2),双重固定2 h,梯度丙酮(50%、70%、80%、90%、100%丙酮各15 min;100%丙酮2次,各10 min)脱水,环氧树酯包埋,半薄切片经甲苯胺蓝染色后,再行超薄切片,醋酸双氧铀和枸橼酸铅双重电子染色。部分标本醋酸铀-柠檬酸铅双染色行透射电镜观察[5]。在透射电子显微镜下观察细胞核、线粒体、肌丝及新生的异常结构。
2.4 统计学处理
超声测量值以均数±标准差表示,2组间比较采用Student T-test,组织学病理评分以中位数表示,与心功能测量值关系采用Pearson相关分析。
3 结果
3.1 一般情况
对照组均存活,无异常改变,第5天称得心脏重量为(0.149±0.005)g。给药组小鼠普遍出现厌食、体质量下降、活动减少,第4、5天小鼠存活只数分别为36、30,第5天给药组小鼠心脏重量为(0.108±0.012)g,有显著性差异(P<0.05)。
3.2 超声心动图检查结果
对照组在不同时间点的超声指标均稳定。给药组小鼠HR仅在第1天内有微弱升高趋势,随后下降,第3、4、5天均降低,与当天对照组比较有显著性差异(P<0.05或(P<0.01)。给药组FS在第3、4、5天呈下降趋势,第5天与当天对照组比较有显著性差异(P<0.05)。给药组CO在第4天即明显下降,与当天对照组比较有显著性差异(P<0.05);给药组LVEDD在第5天明显减少,与当天对照组比较有显著性差异(P<0.01)。具体结果见表1(第0天n=39;给药组第4天n=36,第5天n=30)。
表1 各组小鼠超声心动图检测结果(±s)Tab 1 Ultrasonic echocardiogram of each grou(p±s)
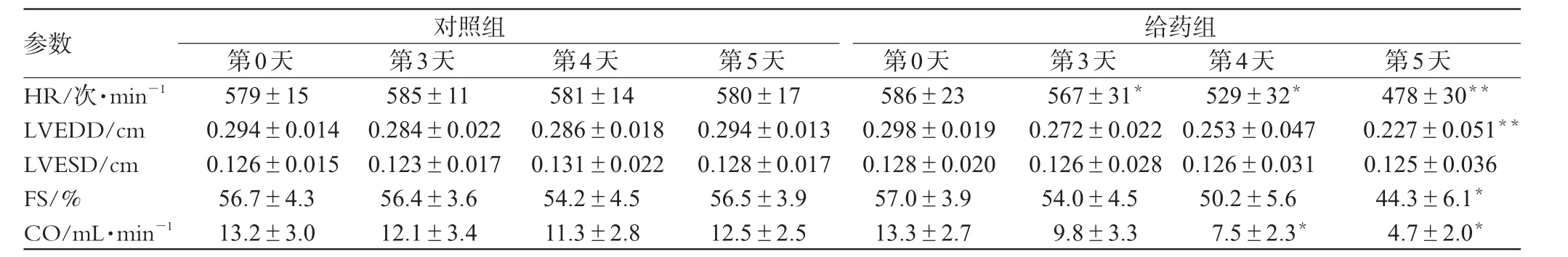
表1 各组小鼠超声心动图检测结果(±s)Tab 1 Ultrasonic echocardiogram of each grou(p±s)
与同一天对照组比较:*P<0.05,**P<0.01vs.control group at the same day:*P<0.05,**P<0.01
参数HR/次·min-1 LVEDD/cm LVESD/cm FS/%CO/mL·min-1对照组给药组第0天579±15 0.294±0.014 0.126±0.015 56.7±4.3 13.2±3.0第3天585±11 0.284±0.022 0.123±0.017 56.4±3.6 12.1±3.4第4天581±14 0.286±0.018 0.131±0.022 54.2±4.5 11.3±2.8第5天580±17 0.294±0.013 0.128±0.017 56.5±3.9 12.5±2.5第0天586±23 0.298±0.019 0.128±0.020 57.0±3.9 13.3±2.7第3天567±31*0.272±0.022 0.126±0.028 54.0±4.5 9.8±3.3第4天529±32*0.253±0.047 0.126±0.031 50.2±5.6 7.5±2.3*第5天478±30**0.227±0.051**0.125±0.036 44.3±6.1*4.7±2.0*
3.3 HE染色光镜检查
对照组胞浆丰富,肌纤维排列整齐;病理评分中位数均为0。给药组心肌损伤明显,细胞内空泡形成,肌纤维断裂、排列紊乱,细胞间隙水肿;第5天病理评分中位数为2.5。各组小鼠心肌细胞HE染色图见图1,给药组小鼠第5天病理评分见表2。
3.4 第5天电镜检查
对照组肌丝完整,线粒体未见异常;给药组可见肌丝排列紊乱,部分肌丝溶解,髓样结构形成,线粒体肿胀,线粒体嵴模糊。各组小鼠心肌细胞电镜检查图见图2。
4 讨论
阿霉素通过激活一氧化碳合成酶、结合三价铁和诱生过氧化氢等多种机制,促使心肌细胞内产生大量氧自由基,导致细胞凋亡[5]。注射20 mg·mL-1阿霉素后第24小时,即能发现Tunnel阳性的小鼠心肌凋亡细胞显著增多[6]。
本研究进一步显示,一次性腹腔注射20 mg·mL-1阿霉素,能在小鼠上建立稳定的非缺血性心肌病模型。组织病理切片示心肌纤维断裂、胞内空泡化,电镜下见线粒体肿胀、部分肌丝溶解,均属阿霉素心脏毒性的典型表现[7]。给药组的第5天心肌Billingham评分均在1.5分以上,证实阿霉素的心肌损伤充分、可靠;给药组的第4、5天小鼠存活数量足够接受检查。给药组小鼠FS减少,CO及心率下降,符合心功能不全的典型表现,与国外其它实验组的结果一致[8,9]。
高频率超声心动图能监测心肌病小鼠的心功能改变。本研究采用飞利浦公司提供的6~15 MHz线阵探头,检查频率设定为15 MHz,横向分辨率和纵向分辨率在理论上可达0.02、0.001 mm[10],足以提供清晰的超声图象。此外,对照组在3、4、5 d测量的数值皆均匀一致,离散趋势小;相应给药组的心功能指标随时间变化逐渐偏低,符合病程变化,说明高频率超声心动图确能有效地评价该心肌病模型。
HR、CO、FS与相应的心肌病理评分相关系数依次为0.934(P<0.001)、0.842(P<0.001)、0.765(P<0.01)。与CO 和FS比较,HR与组织学病理评分之间的相关系数最大,测量值变异系数最小,可见HR是评价心肌病模型的最敏感指标,追踪该模型HR的改变是必不可少的。第5天给药组各心功能指标均显著下降,电镜检查显示肌纤维内出现典型的阿霉素心肌毒性改变,说明给药后第5天心肌病模型已经成功建立。
本实验所测得的小鼠LVEDD减少,与长时间阿霉素诱导的扩张型心肌病表现不符,可能是小鼠心脏重量急剧减轻所致,该结果与其它实验组的结果一致[8]。
阿霉素短时间内能在小鼠上诱导出心肌病心衰模型,该模型具有经济、可靠、省时等优点,同时,使用高频率超声心动图评价该模型建立成功。
(致谢:本研究部分在香港中文大学儿科学系宋银子教授指导并帮助下完成,特致谢!)

表2 给药组小鼠第5天病理评分(n=30)Tab 2 Pathologic scores of administration group on the fifth day(n=30)

图1 各组小鼠心肌细胞HE染色图(10×40)A.对照组;B.给药组Fig 1HE staining of myocardium of each grou(p10×40)A.control group;B.administration group

图2 各组小鼠心肌细胞电镜检查图(×8 000)A.对照组;B.给药组Fig 2 Electron microgram of myocardium of each group( ×8 000)A.control group;B.administration group
[1]Schwarz ER,Pollick C,Dow J,et al.A small animal model of non-ischemic cardiomyopathy and its evaluation by transthoracic echocardiography[J].Cardiovascular Research,1998,39(1):216.
[2]Li K,Sung RY,Huang WZ.Thrombopoietin protects against in vitro and in vivo cardiotoxicity induced by doxorubicin[J].Circulation,2006,113(18):2 211.
[3]黄伟哲,肖大伟,张保亭.比较麻醉和清醒状态对高频超声心动图评价小鼠心功能影响的研究[J].中华超声影像学杂志,2006,15(2):128.
[4]Herman EH,Zhang J,Ferrans VJ.Comparison of the protective effects of desferrioxamine and ICRF-187 against doxorubicin-induced toxicity in spontaneously hypertensive rats[J].Cancer Chemother Pharmacol,1994,35(2):93.
[5]Kalyanaraman B,Joseph J,Kalivendi S,et al.Doxorubicin-induced apoptosis:implications in cardiotoxicity[J].Mol Cell Biochem,2002,234(1):119.
[6]Matoba S,Hwang PM,Nguyen T,et al.Evaluation of pulsed Doppler tissue velocity imaging for assessing systolic function of murine global heart failure[J].J Am Soc Echocardiogr,2005,18(2):148.
[7]费洪文,王新房,周 诚,等.阿霉素诱导兔心肌病模型的建立及经胸超声心动图评价[J].中国超声医学杂志,2004,20(8):572.
[8]Weinstein DM,Mihm MJ,Bauer JA.Cardiac peroxynitrite formation and left ventricular dysfunction following doxorubicin treatment in mice[J].Pharmacol Exp Ther,2000,294(1):396.
[9]Sung R,Stephens M,Blayney L,et al.Cardiac hypertrophy and its regression in rat:comparison of morphological changes in response to aortic constriction,iron deficiency anaemia and isoprenaline[J].J Mol Cell Cardiol,1982,14(9):501.
[10]Yang XP,Lin YH,Rhaleb NE.Echocardio-graphic assessment of cardiac function in conscious and anesthetized mice[J].Am J Physiol,1999,277(5):H 1 967.
