京尼平苷酸对佐剂性关节炎模型大鼠滑膜细胞体外培养增殖及分泌细胞因子的影响Δ
2010-08-06张煜伟中国人民武装警察部队医学院天津市300162
金 鑫,朱 江,张煜伟,张 超(中国人民武装警察部队医学院,天津市 300162)
类风湿性关节炎(Rheumatoid arthritis,RA)是慢性关节病变的全身自身免疫性疾病,它以滑膜炎为特征,表现为滑膜细胞类肿瘤样增生。笔者前期研究[1~3]表明,栀子浸膏及其单体京尼平苷能够抑制RA大鼠足肿胀并下调血清中致炎因子白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的水平,提示该药物可能对RA有治疗作用。京尼平苷酸(GA)是京尼平苷的衍生物,GA可抑制佐剂性关节炎(AA)大鼠继发性炎症,降低血清中TNF-α、IL-1β水平,体外可诱导AA大鼠滑膜细胞细胞凋亡[4]。本文通过观察GA对体外培养AA大鼠滑膜细胞分泌细胞因子TNF-α、IL-1β、IL-10及细胞周期的影响,进一步探讨该药物的作用机制。
1 材料
1.1 仪器
TS100型倒置相差显微镜(日本Nikon公司);3110型CO2培养箱(美国Thermo Forma公司);SUNRISE型酶标仪(奥地利Tecan公司);EPICS XL型流式细胞仪(美国Coulter公司)。
1.2 试药
京尼平苷酸(成都锦泰和医药化学技术有限公司,批号:含量(HPLC法):≥98%);注射用甲氨喋呤(MTX,江苏恒瑞医药股份有限公司,批号:07102412,规格:每支5 mg);冻干卡介苗(北京生物制品研究所,批号:20080129,规格:每支60 mg);弗氏不完全佐剂、Ⅰ型胶原酶、脂多糖(Lipopolysaccharide,LPS)、MTT(美国Sigma公司);TNF-α、IL-1β和IL-10酶联免疫吸附测定(ELISA)试剂盒(武汉博士德公司,批号:EK0526、EK0393、EK0418);兔抗Vimentin蛋白抗体(北京博奥森生物有限公司,批号:bs-0756R);兔SP免疫组化试剂盒、二氨基联苯胺(DAB)显色试剂盒(北京中衫金桥生物技术有限公司,批号:K86922E、290573)。
1.3 动物
健康Wistar大鼠,♂,体质量180~200 g,北京维通利华实验动物技术有限公司提供(动物合格证号:SCXK(京)2007-0001)。
2 方法
2.1 模型的建立[5]
用弗氏完全佐剂(卡介苗80℃、1 h灭活,与弗氏不完全佐剂充分乳化,含卡介苗10 g·L-1)于大鼠右后足跖皮内注射0.1 mL致炎,用关节炎指数[4]评定大鼠的关节肿胀程度,于注射弗氏完全佐剂后第25天筛选关节炎指数在3分以上的大鼠进行滑膜细胞的体外培养。
2.2 大鼠滑膜组织的分离与滑膜细胞培养
取造模成功大鼠,脱臼处死,置于75%乙醇浸泡2 min,局部乙醇消毒于膝关节正中纵行切开皮肤,分离肌肉露出膝盖骨,继续向下分离,可见平滑光亮的滑膜组织,用手术剪分离关节囊的纤维层和滑膜层,取出滑膜层组织,同法采集另一侧膝关节滑膜层组织。将滑膜组织在D-Hanks液中漂洗3次,去除脂肪组织,剪成1 mm3的小块,用0.2%的Ⅰ型胶原酶消化4 h,离心去上清后用0.25%胰酶消化30 min,200目滤网过滤,滤液离心后细胞沉淀用含10%胎牛血清的RPMI-1640培养基重悬后在37℃、5%CO2培养箱中培养,取2~3代细胞用于试验。
2.3 原代成纤维样滑膜细胞免疫细胞化学鉴定
将2~3代滑膜细胞制成1×106个·L-1细胞悬液,在6孔板内爬片培养,弃上清,磷酸盐缓冲液(PBS)洗涤,冷甲醇固定15 min,PBS洗涤,滴加3%H2O2灭活内源性酶15 min,PBS洗涤,羊血清封闭20 min后,滴加兔抗VimentinⅠ抗,4℃孵育过夜,PBS洗涤,滴加羊抗兔Ⅱ抗37℃孵育1 h,PBS洗涤,滴加链霉亲合素-生物素-过氧化物酶复合物(SABC)37℃30 min,DAB显色,自来水清洗,梯度乙醇脱水,二甲苯透明,封片,镜下观察阳性细胞数量和纯度。
2.4 分组与加药
将处于对数生长期的滑膜细胞用0.25%胰蛋白酶消化制成所需浓度的细胞悬液,接种于培养板中,用含10%胎牛血清的RPMI-1640培养基培养,细胞贴壁后换含1%胎牛血清的培养基培养24 h使细胞同步化,细胞分组加药处理,进行指标检测,细胞分为GA高、中、低(10-5、10-6、10-7mol·L-1)浓度组、阳性对照组(MTX,10-6mol·L-1)和对照组(等体积生理盐水)。
2.5 MTT法检测细胞增殖
滑膜细胞制成1×106个·L-1细胞悬液,接种于96孔培养板中,每孔200 μL,分组及给药方法同“2.4”项,每组设8个复孔。分别于给药后1、3、5 d测定细胞增殖情况,每孔加MTT(5 g·L-1)20 μL,37 ℃孵育4 h,弃上清,将板晾干,每孔加入二甲基亚砜(DMSO)150 μL在摇床上震荡15 min,以570 nm为测量波长,630 nm为参比波长用酶标仪测定各孔吸光度(A值),以A值代表细胞增殖能力。
2.6 流式细胞术测定细胞周期
滑膜细胞制成1×106个·L-1细胞悬液,接种于6孔板中,按“2.4”项下方法分组给药,每组3个复孔,药物处理48 h后,常规方法收集细胞,离心弃上清,PBS洗1次,每管加70%乙醇1 mL固定,用吸管将细胞分散成单个,-20℃过夜。离心弃固定液,加50 mg·L-1RNA酶A(Rnase)37 ℃孵育 1 h,加50 mg·L-1碘化丙啶(PI)染液,4 ℃避光1 h,400目的筛网过滤1次,在流式细胞仪上测定不同细胞周期的细胞比例(G1期为DNA合成前期,S期为DNA合成期,G2期为DNA合成后期,M期为有丝分裂期)。
2.7 ELISA法检测滑膜细胞外液中IL-1β、TNF-α、IL-10水平
调整滑膜细胞密度为3×106个·L-1,接种于24孔培养板中,每孔1 mL,按“2.4”项下方法分组,各加药组在含药培养基中另加LPS,浓度为5 mg·L-1,目的为刺激滑膜细胞分泌细胞因子。加药处理48 h后,收集细胞上清,参照ELISA试剂盒说明书测定各组滑膜细胞外液中IL-1β、TNF-α、IL-10的水平。
2.8 统计学处理
数据采用均数±标准差(±s)表示,组间均数比较采用t检验和单因素方差分析,数据使用SPSS 13.0软件分析,以P<0.05为差异具有显著性。
3 结果
3.1 成纤维样滑膜细胞形态学的观察和鉴定
体外培养的原代滑膜细胞根据其形态学特征,可分为3种类型:(1)巨噬细胞样细胞;(2)成纤维细胞样细胞(Fibroblast-like synoviocytes,FLS);(3)树突状细胞。滑膜细胞在体外培养通过几次传代后主要以梭形的FLS为主,光镜下细胞呈长梭形,两极胞突细长,末端多与邻近细胞连接并交织成网状,细胞核呈卵圆形位于细胞中央,细胞较薄,透亮,排列有局部方向性,FLS光镜图见图1。Vimentin蛋白是中胚层组织细胞特征性蛋白,可用于FLS的鉴定,结果可见2~3代滑膜细胞大多数为FLS,纯度达到试验要求,Vimentin染色图见图2。
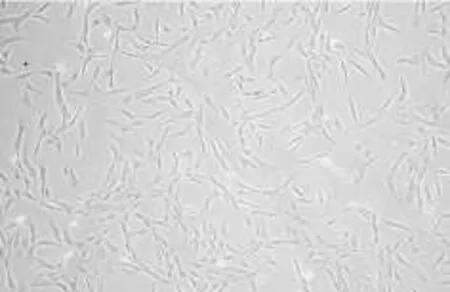
图1 FLS光镜图(×200)Fig 1 FLS light micrograph(×200)

图2 FLS免疫组化Vimentin染色图(×100)Fig 2 Immunohistochemistry Vimentin staining of FLS(×100)
3.2 细胞增殖情况
不同浓度GA连续给予5 d,A值降低。与对照组比较,GA高剂量组和阳性对照组大鼠滑膜细胞A值显著降低(P<0.05或P<0.01),表明GA在体外可抑制AA模型大鼠滑膜细胞增殖,抑制作用呈现剂量依赖性增强。各组大鼠滑膜细胞增殖情况见表1。
表1 各组大鼠滑膜细胞增殖情况(A,±s,n=8)Tab 1 Proliferation of synoviocytes in each group(A,±s,n=8)
与对照组比较:*P<0.05,#P<0.01vs.control group:*P<0.05,#P<0.01
组别1 d 3 d5 d对照组0.339 7±0.014 00.480 2±0.017 50.613 8±0.030 6 GA高浓度组0.301 8±0.027 7*0.447 2±0.023 5*0.533 8±0.029 6#GA中浓度组0.311 0±0.032 40.461 7±0.036 40.579 7±0.023 7 GA低浓度组0.327 3±0.032 30.469 0±0.0330.584 5±0.016 4阳性对照组0.207 5±0.022 2#0.175 5±0.020 2#0.156 7±0.028 3#
3.3 细胞周期情况
不同浓度药物处理细胞48 h后,与对照组比较,GA高、中浓度组大鼠G1期滑膜细胞比例明显增加,S期和G2/M期滑膜细胞比例明显减少(P<0.01);阳性对照组大鼠G1期滑膜细胞比例明显增加,S期滑膜细胞比例明显减少(P<0.01),G2/M期滑膜细胞比例没有明显改变,表明GA能够阻滞G1期细胞向S期移行,阻滞DNA合成和复制,从而抑制滑膜细胞增殖。各组大鼠滑膜细胞周期分布变化情况见表2。
表2 各组大鼠滑膜细胞周期变化情况(±s,n=3)Tab 2 Cell cycle of synoviocytes in each grou(p±s,n=3)
与对照组比较:*P<0.01vs.control group:*P<0.01
细胞周期分布/%组别对照组GA高浓度组GA中浓度组GA低浓度组阳性对照组G1S G2/M 10.7±1.9 5.6±0.5*5.9±0.7*9.9±1.3 10.9±1.7 74.7±1.9 84.9±2.2*84.6±3.6*75.7±2.6 84.2±3.9*14.7±1.9 9.5±2.2*9.4±2.6*14.4±3.3 4.9±0.7*
3.4 IL-10、IL-1β、TNF-α变化情况
与对照组比较,GA高浓度组与阳性对照组TNF-α、IL-1β水平明显降低,IL-10水平明显升高(P<0.05或P<0.01),GA中浓度组TNF-α水平降低、IL-10水平升高(P<0.05),表明GA能通过抑制滑膜细胞分泌致炎因子,增加抑炎因子的分泌,阻止或缓解关节炎症的发生和发展。各组大鼠滑膜细胞外液TNF-α、IL-1β、IL-10变化情况见表3。
表3 各组大鼠滑膜细胞外液TNF-α、IL-1β、IL-10的变化情况(±s,n=4)Tab 3 Levels of TNF-α,IL-1β and IL-10 in extracellular fluid of synoviocyte(s±s,n=4)

表3 各组大鼠滑膜细胞外液TNF-α、IL-1β、IL-10的变化情况(±s,n=4)Tab 3 Levels of TNF-α,IL-1β and IL-10 in extracellular fluid of synoviocyte(s±s,n=4)
与对照组比较:*P<0.05,#P<0.01vs.control group:*P<0.05,#P<0.01
组别对照GA MTX IL-10/ng·L-1 21.37±9.05 43.38±11.82#35.01±10.69*23.83±10.23 45.19±10.98#浓度/mol·L-1-10-5 10-6 10-7 10-6 TNF-α/ng·L-1 40.98±9.24 26.38±8.83#32.19±5.59*34.82±11.26 25.18±9.22#IL-1β/ng·L-1 58.47±10.08 44.39±9.46*47.52±11.02 52.71±13.33 43.96±10.61*
4 讨论
RA的基本病理改变是滑膜炎,常导致关节破坏、畸形,最终导致不同程度的功能障碍,患病率居自身免疫性结缔组织病首位。目前治疗RA主要是采取西药来控制和缓解症状,但副作用大,且无根治作用;中药治疗多采取复方制剂,但存在物质基础不清,单体疗效及作用机制不明等问题。中药栀子系茜草科植物的成熟果实,有泻火除烦、清热利尿、凉血解毒功效。GA为栀子提取的单体,是京尼平苷衍生物,可由京尼平苷酯解产生,由于二者化学结构相似,由构效关系推测GA可能具有相似的抗炎作用。
RA的发病机制至今仍不清楚,除与免疫功能失调相关外,过度增生的滑膜细胞功能改变在关节损伤和组织重构中起着至关重要的作用。文献[6,7]报道RA滑膜细胞具有转化细胞的特性,引起RA关节滑膜组织炎性增生的基本原因可能是由于滑膜细胞凋亡机制障碍,引起细胞增殖和凋亡失平衡所致。
在RA中多种炎症介质参与了关节炎症的发展过程,其中TNF-α和IL-1β是参与RA发病的主要的细胞因子,在关节损伤中起重要作用[8]。RA的关节液中可检测出高水平的IL-1,IL-1可促进滑膜细胞增殖,诱导前列腺素E和胶原酶的产生,是RA软骨降解和骨破坏的主要细胞因子之一[9]。TNF-α通常和IL-1表现出协同性生物学效应,TNF-α可以调节IL-1分泌,上调RA滑膜细胞分泌胶原酶、金属蛋白酶、环氧化酶和前列腺素E2,导致滑膜炎症、软骨破坏,造成关节损伤[10]。IL-10是重要的炎症抑制因子,具有很强的免疫抑制及免疫调控作用,提示它在RA的发病中起着一定保护作用[11]。IL-10可抑制有核细胞分泌多种细胞因子如IL-1、TNF-α及粒细胞巨噬细胞集落刺激因子(GM-CSF)等而表现其抗炎作用;亦可刺激B细胞成熟和活化分泌多种抗体,如IgM、IgA;同时诱导合成Bcl-2蛋白,阻断B细胞凋亡而达到抗炎作用。
本试验研究表明,GA在体外可以抑制AA大鼠FLS增殖,抑制作用呈药物剂量依赖性增强,其机制与阻滞细胞周期G1期向S期移行、阻滞DNA合成和复制有关;GA还可以下调FLS分泌致炎因子TNF-α、IL-1β水平,而上调抑炎因子IL-10水平,这些可能是其抗RA的作用机制之一。
[1]朱 江,高 欣,谢文利,等.京尼平苷对类风湿性关节炎大鼠血清IL-1β和TNF-α的影响[J].中国中药杂志,2005,30(9):708.
[2]朱 江,蔡德海,芮 菁.栀子的抗炎镇痛作用研究[J].中草药,2000,31(3):198.
[3]朱 江,谢文利,晋玉章,等.栀子浸膏对类风湿行关节炎大鼠血清IL-1β和TNF-α的影响[J].武警医学院学报,2005,14(3):162.
[4]金 鑫,孙 静,谢文利,等.京尼平苷酸对佐剂性关节炎大鼠抗炎作用及滑膜细胞凋亡机制研究[J].中国中药杂志,2009,34(23):3 082.
[5]徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2001:920.
[6]Fassbender HG.The disease picture in rheumatoid arthritis as a result of different pathomehanisms[J].Z Rheumatol,1985,44(1):33.
[7]Firestein GS,Yeo M,Zvaifler NJ.Apoptosis in rheumatoid arthritis synovium[J].J Clin Invest,1995,96(3):1 631.
[8]Hirayama T,Danks L,Sabokbar A,et al.Osteoclast formation and activity in the pathogenesis of osteoporosis in rheumatoid arthritis[J].Rheumatology,2002,41(11):1 232.
[9]Dayer JM.The pivotal role of interleukin-1 in the clinical manifestations of rheumatoid arthritis[J].Rheumatology,2003,42(Suppl 2):ii3.
[10]Shi J,Schmitt TE,DiMattia DA,et al.The differential efects of IL-1 and TNF-α on proinflammatory cytokine and matirx metalloproteinase expression in human chondrosarcoma cells[J].Inflamm Res,2004,53(8):377.
[11]Malaviya AM,Assoc J.Cytokine network and its manipulation in rheumatoid arthritis[J].Physicians India,2006,54(Suppl):15.
