酒石酸唑吡坦片在蒙古族和汉族人体内的药动学研究Δ
2010-08-06白音杨磊郭涛夏东亚赵东祥李强项勇内蒙古赤峰学院医学院赤峰市0000沈阳军区总医院药剂科沈阳市110016沈阳药科大学药学院沈阳市110016解放军第313医院赤峰临床部赤峰市0000
白音,杨磊,郭涛,夏东亚,赵东祥,李强,项勇(1.内蒙古赤峰学院医学院,赤峰市0000;.沈阳军区总医院药剂科,沈阳市 110016;3.沈阳药科大学药学院,沈阳市 110016;.解放军第313医院赤峰临床部,赤峰市 0000)
酒石酸唑吡坦是一种新型镇静催眠药,是γ-氨基丁酸A型(GABAA)-苯二氮类受体激动药,选择性作用于大脑的ω1苯二氮受体亚型而达到镇静催眠作用。临床用于治疗失眠,以及用作手术前用药。酒石酸唑吡坦在健康受试者体内的药动学在国内、外已有文献报道,但是未见文献报道酒石酸唑吡坦在蒙古族人体内的药动学的研究文献。我国是一个多民族的国家,各民族间遗传背景、生活环境、饮食习惯等存在的差异,可能影响药物的体内过程,可能出现药物效应的民族差异。本文首次通过研究蒙古族、汉族两民族单剂量口服酒石酸唑吡坦后的药动学,比较两者之间的差异,为临床合理用药提供理论依据。
1 材料
1.1 仪器
高效液相色谱仪,包括600型四元泵、717自动进样器、2475荧光检测器、Empower色谱工作站(美国Waters公司)。
1.2 试药
酒石酸唑吡坦片(法国赛诺菲安万特公司,规格:每片10 mg,批号:7T028);酒石酸唑吡坦对照品(中国药品生物制品检定所,批号:100367-200501);内标:盐酸阿夫唑嗪对照品(中国药品生物制品检定所,批号:100728-200501);乙腈为色谱纯,其余试剂为分析纯。
2 方法
2.1 色谱条件
色谱柱:Diamonsil C18柱(200 mm×4.6 mm,5 μm);流动相:乙腈-0.02 mol·L-1磷酸二氢钠缓冲液(用磷酸调pH值至3.5)(25∶75);流速:1.0 mL·min-1;激发波长:254 nm;发射波长:390 nm;柱温:室温;进样量:20 μL。
2.2 受试者的选择
汉族健康志愿者10名,男、女各5名,年龄(22.0±0.9)岁,体质量(55.0±4.9)kg,身高(164±5)cm,体质量指数(BMI)(20.4±1.2)kg·m-2。蒙古族健康志愿者10名,男、女各5名,年龄(20.8±1.3)岁,体质量(57.8±5.0)kg,身高(168±6)cm,BMI(20.4±1.3)kg·m-2。所有受试者试验前进行体检、心电图、血常规和肝肾功能检查均正常后才可入选参加试验,且试验前15 d未服用其它药物。其父母、祖父母、外祖父母3代均为同一民族婚配。该试验方案经过沈阳军区总医院医学伦理委员会批准通过。受试者均为自愿参加且在试验前签署知情同意书。
2.3 给药方案与血样采集
健康志愿者用药前禁食1夜,于次日早晨空腹单剂量服用酒石酸唑吡坦片1片(相当于唑吡坦10 mg)后,2 h后方可饮水,4、9 h统一进标准餐。受试者于服药前0 h及服药后0.25、0.5、0.75、1、1.5、2、3、4、6、9、12 h时采前臂静脉血4 mL。离心分离血浆,于-25℃冷冻保存至测定。在整个试验过程中对不良反应进行监测和记录。
2.4 血浆样品处理
取血浆0.5 mL,分别加入甲醇100 μL、内标溶液(50 μg·L-1盐酸阿夫唑嗪甲醇溶液)50 μL、4.0 mol·L-1氢氧化钠溶液50 μL,涡旋混合1 min。加无水乙醚5 mL,涡旋混合3 min,3 000 r·min-1离心10 min,分取上层有机相于另一试管中,于37℃氮气流下吹干,残留物加入流动相100 μL溶解,取20 μL进样分析。
2.5 数据处理
用孙瑞元编制的DAS Ver 2.0药动学软件,根据拟合度值选择房室模型和权重,并计算药动学参数。蒙、汉两民族受试者药动学参数比较采用t检验进行比较。
3 结果
3.1 方法学验证
3.1.1 专属性考察:空白血浆、空白血浆+酒石酸唑吡坦对照品+内标,蒙、汉两民族受试者服药后的血浆样品色谱图见图1。

图1 高效液相色谱图Fig 1 HPLC chromatograms
由图1可知,酒石酸唑吡坦与内标分离良好,酒石酸唑吡坦与内标的峰形好,保留时间分别为9.3、5.3 min,血浆中的内源性杂质对测定无干扰。
3.1.2 标准曲线的制备:取空白血浆0.5 mL,依次加入系列酒石酸唑吡坦对照品溶液100 μL,使酒石酸唑吡坦血药浓度为2.0、5.0、10.0、25.0、50.0、100.0、250.0 μg·L-1,按“2.4”项下方法操作并进样测定,记录色谱。以血浆样品中待测物浓度(X)为横坐标,待测物与内标的峰面积比值(Y)为纵坐标,用加权(W=1/X2)最小二乘法进行回归运算,求得直线回归方程Y=-0.022+0.041X(r=0.999 4)。结果表明,酒石酸唑吡坦血药浓度在2.0~250.0 μg·L-1范围内线性关系良好。最低检测限为2 μg·L-1。
3.1.3 回收率与精密度试验:取健康受试者空白血浆0.5 mL,制备成酒石酸唑吡坦血药浓度为5.0、50.0、200.0 μg·L-1的低、中、高3种浓度的质量控制样品,进行方法回收率及精密度试验,结果日内、日间精密度均小于8.8%;另以待测物的峰面积与相应浓度标准液直接进样的峰面积的比值计算提取回收率,结果提取回收率均大于58%,满足测试要求。精密度及回收率试验结果见表1。
表1 精密度及回收率试验结果(±s,n=22)Tab 1Results of precision and recovery tes(t±s ,n=22)
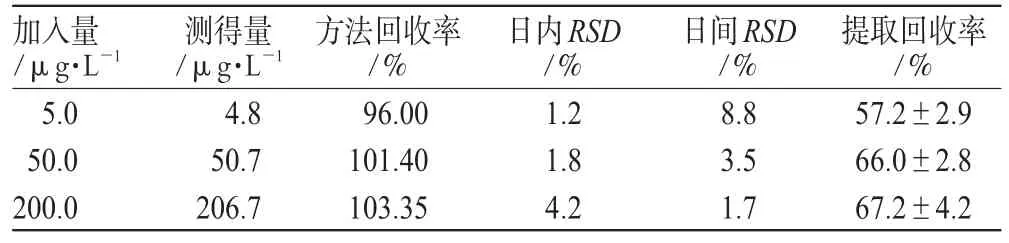
表1 精密度及回收率试验结果(±s,n=22)Tab 1Results of precision and recovery tes(t±s ,n=22)
加入量/μg·L-1 5.0 50.0 200.0日内RSD/%1.2 1.8 4.2测得量/μg·L-1 4.8 50.7 206.7方法回收率/%96.00 101.40 103.35日间RSD/%8.8 3.5 1.7提取回收率/%57.2±2.9 66.0±2.8 67.2±4.2
3.1.4 稳定性考察:分别将血浆样品于室温放置4 h和8 h,于-25℃放置并冻融3次,-25℃放置1个月,以考察其稳定性。结果,除高浓度质控样品冻融第3次RSD为10%以外,其他各条件下各浓度样品的RSD均<10%,表明在上述条件下血浆样品基本稳定。
3.1.5 质控样品:配制酒石酸唑吡坦血浆浓度为5.0、50.0、200.0 μg·L-1的低、中、高3种浓度的质量控制样品,同时保存,与受试者血浆样品随行测定,质量控制样品的测定结果符合要求(在±15%之内)。
3.2 药-时曲线
蒙古族、汉族受试者单剂量口服酒石酸唑吡坦10 mg后,在不同时间点的平均药-时曲线见图2。

图2 蒙、汉两民族受试者单剂量口服酒石酸唑吡坦10 mg后的平均药-时曲线Fig 2 Mean plasma concentration-time curves of zolpidem tartrate in Han and Mongolian healthy volunteers after a single oral dose of 10 mg zolpidem tartrate
3.3 药动学参数及其蒙、汉两民族的比较
用DAS Ver 2.0药动学软件进行房室模型的拟合,蒙、汉两民族均符合一室开放模型。药动学参数见表2。两民族间的药动学参数经t检验,结果无显著性差异(P>0.05)。表明酒石酸唑吡坦在两民族人体内的药动学过程无显著性差异。
3.4 安全性评价
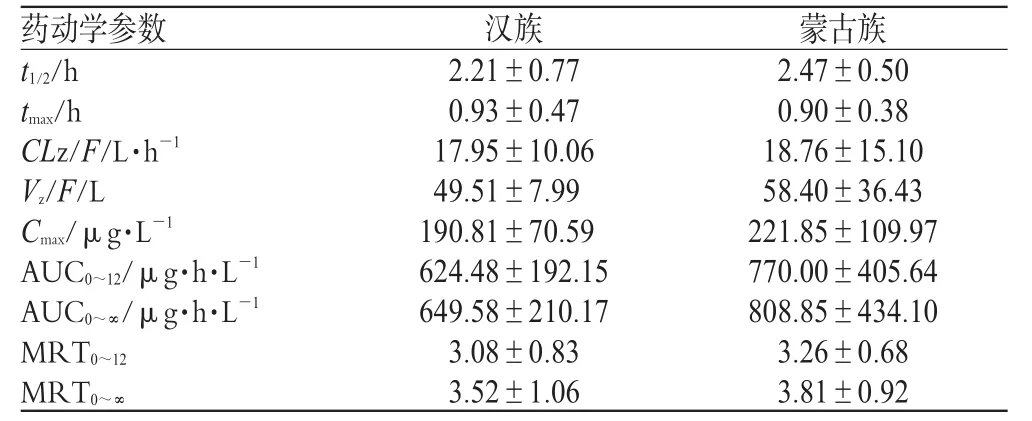
表2 蒙、汉两民族受试者单剂量口服酒石酸唑吡坦10 mg后的主要药动学参数Tab 2 Pharmacokinetic parameters of zolpidem tartrate in Han and Mongolian healthy volunteers after a single dose of 10 mg zolpidem tartrate
在本试验中,两民族受试者单剂量口服酒石酸唑吡坦片10 mg以后,均有不同程度不良反应发生,其中,蒙古族1名受试者发生呕吐,汉族有3名受试者主诉有恶心等胃肠道不良反应,与药品说明书上提示的不良反应一致,这可能与首次空腹服用酒石酸唑吡坦片有关,进食后上述症状减轻或消失。
4 讨论
研究结果表明,酒石酸唑吡坦在蒙、汉两民族健康受试者体内过程均符合一室开放模型,其药动学参数与文献报道一致,蒙古族组Cmax较汉族组Cmax稍高;AUC0~12较汉族组稍大,t1/2较汉族组稍长,但是各药动学参数经独立样本t检验,结果均无显著性差异(P>0.05)。
虽然,蒙、汉两民族在口服单剂量酒石酸唑吡坦后,其药动学参数在统计学上无显著性差异,但是无论是汉族还是蒙古族,其各药动学参数存在一定个体差异,这与文献报道一致[1~3]。由于酒石酸唑吡坦的代谢受细胞色素P450(CYP)异构酶与CYPA4共同作用,CYPA4具有多态性,在蒙、汉两民族健康志愿者中,也体现了这种个体差异性。本试验方法可用于人体内洒石酸唑吡坦的药动学研究,其结果为酒石酸唑吡坦的个体化用药提供了理论依据。
[1] 宋洪杰,李 珍,石 晶,等,高效液相色谱-荧光检测法测定人血浆中酒石酸唑吡坦的浓度[J].中国药学杂志,2001,36(5):333.
[2] 刘治军,殷 琦,李可欣,等,国产酒石酸唑吡坦的生物利用度和生物等效性研究[J].中国新药杂志,2005,14(8):1 036.
[3] 熊玉卿,姜 敏,戴 群.酒石酸唑吡坦在中国健康受试者体内的生物等效性研究[J].中国药学杂志,2001,36(11):748.
