长白山毛樱桃总黄酮对冻伤及炎症相关性的影响①
2010-07-30张成义邵世和史玉玲江苏大学基础医学与医学技术学院镇江212013
张成义 邵世和 史玉玲 (江苏大学基础医学与医学技术学院,镇江212013)
长白山毛樱桃在冻伤治疗中的应用,属于药食同源,无明显的毒副作用,且民间应用、经验方及临床小病例观察,防治冻伤疗效快速显效,愈后不易复发。长白山毛樱桃为长白山脉系植物果实,民间广泛应用毛樱桃泡酒防治冻伤,疗效奇特,“樱桃外用防治冻伤”在许多文献中都有科普介绍[1,2]。但未见对樱桃治疗冻伤的系统研究记载。该实验拟以民间用法为线索,通过液氮法建立兔耳及小鼠足冻伤炎症模型,观察毛樱桃总黄酮(Prunus tomentosa thumb total flavone,PTTTF)的抗冻伤作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 普通级新西兰大白兔12只,雌雄各半,2.0~2.5千克,兔耳大小厚薄相近,由吉林大学实验动物中心提供,合格证:SCXK-(吉)2003-0003。昆明种小白鼠18~22克,雌雄兼用,由长春高新区医学实验动物中心提供,合格证:SCXK-(吉)2003-0004。
1.1.2 实验耗材及仪器 毛樱桃总黄酮(PTTTF),北华大学药学院提供,为淡黄色粉末;冰醋酸,上海华联制药有限公司;-86℃超低温冰箱(MDFU4086S型),日本SANYO公司;BS210S型电子分析天平,赛多利斯仪器系统有限公司;WFJ2000型可见分光光度计,尤尼柯仪器有限公司;H◦S11-Ni1型电热恒温水浴锅,北京长安科学仪器厂;台式低速LDZ4-0.8自动平衡微型离心机,北京医用离心机厂;RB-200智能热板仪,成都泰盟科技有限公司;微量移液器,法国Glison公司;生物摄像显微镜,Motic公司。
1.3 毛樱桃总黄酮的制备 称取鲜毛樱桃500克洗净捣烂,以1∶4体积比加入含1%盐酸的75%乙醇,超声频率为40 kHz,提取40分钟,回流提取2小时,减压浓缩使含醇量达75%,然后避光4℃静置12小时(蛋白质、多糖等沉淀除去),滤去沉淀,滤液置于旋转蒸发仪减压浓缩至近干。将浓缩物混悬分散于水中,过滤去除不溶物,滤液装聚酰胺柱[3],加聚酰胺30倍量的水洗脱,弃去洗脱液,再加90%乙醇洗脱,至洗脱液无色,收集洗脱液并减压浓缩,将浓缩物真空冷冻干燥,即得PTTTF[4]。采用紫外波谱分析、盐酸-镁粉反应、三氯化铝络合反应、铅盐反应定性为黄酮类,采用HPLC,以芦丁为对照品,测得冷冻干燥物中总黄酮含量为78.3%,折合生药含总黄酮量0.61%。使用时现配制成相应浓度生理盐水溶液并调节pH至近中性;外用配制成10 mg/ml,皮下注射配制成每5 ml含100、50和10mg溶液。
1.4 方法
1.4.1 动物的饲养 各组雌雄小鼠分笼饲养,常规颗粒饲料喂养,每只小鼠每天进食约5克,自由饮水;12小时自然光照,室温控制在20℃~25℃,湿度为40%~60%。无菌垫料、饮水瓶定时更换,定时消毒。新西兰大白兔在实验室适应1周后开始实验。
1.4.2 PTTTF对兔耳局部冻伤的影响[5]取新西兰大白兔12只,用固定架固定露出头部,将直径25 mm铁柱浸入-196℃液氮中,取出后立即将其紧贴于兔耳5秒,左右耳平行致冻伤,右耳作为自身对照。分两组每组6只,分别为PTTTF组(10 mg/ml)和阳性对照组(0.025%醋酸去炎松软膏组)。致伤后2小时开始给药,各组分别用棉球涂抹左耳给药每次0.5 ml,每天3次,连续给药7天,每天记录兔耳厚度(耳厚度测量:以螺旋测微器改制的耳厚度测量仪,测量耳冻伤局部表面覆盖直径为2 cm时的厚度)及局部冻伤变化情况,统计每组治疗耳(左耳)与对照耳(右耳)厚度的差异性并计算耳肿胀抑制率,第7天给药后30分钟处死动物,切取实验兔耳,10%甲醛溶液固定,石蜡包埋,切片,HE染色,于光学显微镜下进行病理观察。耳肿胀抑制率=
1.4.3 PTTTF对小鼠巴豆油耳肿胀的影响[6]选取昆明种健康小鼠50只,体重(18±2)克,随机分为5组,每组10只,分为空白对照组,阳性对照组、PTTTF高剂量组(100 mg/kg)、PTTTF中剂量组(50 mg/kg)和PTTTF低剂量组(10 mg/kg)和PTTTF高、中、低剂量组小鼠每日一次,每次分别颈背部皮下注射(sc)PTTTF 5 ml/kg,空白对照组小鼠每日一次,每次颈背部皮下注射等量的生理盐水,阳性对照组每日一次,每次颈背部皮下注射地塞米松磷酸钠注射液(Dex)25 mg/kg,各组连续给药7天,末次给药后30分钟,每只小鼠右耳廓两面均匀涂抹2%巴豆油溶液(组成:巴豆油2%,乙醚78%,无水乙醇20%)0.05 ml,左耳不涂作自身空白对照。4小时后断髓处死,剪下耳片,用8 mm打孔器打下双侧耳片,用电子天平分别称重,以右耳片重量减去左耳重量所得的差值作为肿胀的程度并计算肿胀抑制率。耳肿胀度(mg)=右耳重(mg)-左耳重(mg),肿胀抑制率=
1.4.4 PTTTF对醋酸所致小鼠腹腔毛细血管通透性增高的影响[7]选取昆明种健康小鼠50只,体重(18±22)克,分组方法及给药同1.4.3,各组连续给药7天,末次给药后30分钟由尾静脉注射0.5%伊文斯兰生理盐水10 ml/kg,继而腹腔注射0.6%冰醋酸10 ml/kg,20分钟后将小鼠脱颈椎处死,用5 ml生理盐水冲洗腹腔,轻揉腹部数分钟,剪开腹腔,收集腹腔冲洗液放入试管中,1 000 r/min,离心5分钟,移取上清用可见分光光度计测定吸光度(A590)值。
2 结果
2.1 PTTTF对兔耳局部冻伤的影响 以右耳作自身对照,造模后2小时可见每组家兔左右耳均红肿,且左右耳肿胀程度无明显差异(见图1A1、B1),PTTTF组局部给药第四天,可明显抑制治疗耳(左耳)炎症局部毛细血管舒张、充血和水肿,而冻伤模型对照耳(右耳)炎症局部毛细血管舒张、充血、水肿及青紫比较明显,治疗耳与对照耳比较,肿胀程度具有极显著差异(P<0.001),肿胀抑制率为26.84%(见图1B4),较阳性对照组(见图 1A4)肿胀抑制率为21.87%)治疗作用明显;给药第七天,PTTTF组治疗耳充血水肿基本消退,治疗耳与对照耳比较,肿胀程度具有极显著差异(P<0.001),肿胀抑制率为32.52%(见图1 B7、B7),较阳性对照组(肿胀抑制率29.68%)(见图1 A7)治疗作用更明显(见表1),对兔耳轻、中度冻伤有显著的治疗作用。组织病理学可见:PTTTF组,对照耳光镜下可见大量中性粒细胞渗出,红细胞浸润,组织疏松水肿,而治疗耳镜下中性粒细胞少量渗出,无明显组织水肿;阳性对照组对照耳,光镜下可见大量中性粒细胞渗出,红细胞浸润,组织疏松水肿,治疗耳镜下中性粒细胞少量渗出,组织水肿较轻(见图2)。
2.2 PTTTF对小鼠巴豆油耳肿胀的影响 以耳肿胀度为观测指标,与阴性对照组(15.26±3.22)比较,PTTTF 50 mg/kg(12.68±2.25)能明显减轻巴豆油所致的小鼠耳肿胀(P<0.05),肿胀抑制率为16.91%,PTTTF 100 mg/kg(11.41±2.44)显著抑制巴豆油所致的小鼠耳肿胀(P<0.01),抑制率达25.23%,并有剂量依赖趋势,但作用弱于地塞米松组(10.33±1.82),抑制率32.31%(见图3)。
2.3 PTTTF对醋酸所致小鼠腹腔毛细血管通透性增高的影响 以腹腔渗出液A590为观测指标,与阴性对照组(0.508±0.141)比较,PTTTF 10 mg/kg(0.446±0.066)对小鼠腹腔毛细血管通透性抑制率为12.2%(P>0.05),PTTTF 50 mg/kg(0.403±0.071)对小鼠腹腔毛细血管通透性抑制率为20.67%(P<0.05),PTTTF 100 mg/kg(0.317±0.085)对小鼠腹腔毛细血管通透性抑制率为37.6%(P<0.01),具有剂量依赖性,但作用弱于地塞米松组(0.191±0.055),小鼠腹腔毛细血管通透性抑制率为62.4%(P<0.001,见图4)。

图1 PTTTF对兔耳液氮冻伤的治疗效果Fig.1 The therapeutic effect of PTTTF on frostbite in the rabbit ears

表1 PTTTF对兔耳液氮冻伤模型的影响Tab.1 The effects of PTTTF on rabbit ear swelling by liquid nitrogen

图2 PTTTF对兔耳液氮冻伤的病理学影响(×400)Fig.2 Pathologic effect of PTTTF on the rabbit's frostbite ears caused by liquid nitrogen(×400)
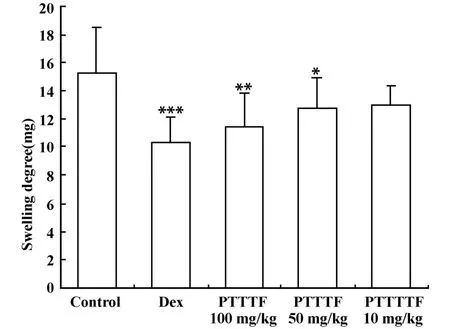
图3 PTTTF对小鼠巴豆油耳肿胀的影响Fig.3 Effects of PTTTF on conton oil-induced ear edema in mice
3 讨论
近年来,随着地球环境的恶化,南方冬季大幅度转冷,为了保障军队和广大人民的寒季卫生和防止大范围人群突发性冻伤的发生,预防和治疗冻伤已成为当前研究热点,积极研究和开发有效抗冻伤药,是对应全球近年来气候环境恶化的当务之急。

图4 PTTTF对醋酸所致小鼠腹腔毛细血管通透性增高的影响Fig.4 Effects of PTTTF on acetic acid-induced abdominal capillary hypermeability in mice
冻伤表现为免疫性炎症反应,其病理过程错综复杂,其原因亦众说不一,目前倾向于直接损伤,血液循环障碍,组织缺氧及炎症反应的血管活性物质和毒性物质作用的综合损伤学说[8,9]。局部组织在寒冷刺激下,冻伤区域的毛细血管早期收缩之后出现渗出,使组织出现水肿,发生炎症性改变[10,11]。在光学显微镜下对冻伤兔耳组织形态学进行观察,可见以下损伤变化:红细胞及白细胞渗出,中性粒细胞增多,组织疏松,毛细血管扩张。这与冻伤后组织进行性缺血缺氧,炎性反应及酶系统的改变有一定的关系[12]。Serda等[13]研究发现局部组织冻伤早期水肿是因组织胺、5-羟色胺、缓激肽等损伤血管内皮引起的急性非特异性炎性反应。在损伤因子刺激较为强烈、组织损伤较为严重的情况下,常出现不同程度的全身反应,即发热和白细胞增多等。
黄爱玲[14]、JIA等[15]通过研究发现,黄酮类化合物具有多种生物学活性,尤其抗炎、免疫调节等作用已基本明确。通过民间应用“樱桃泡酒治疗冻伤有效”的经验提示:其抗冻伤有效部位主要在醇提取物中。经本实验证实毛樱桃醇提物中总黄酮含量为78.3%,提示其主要活性成分为黄酮类。对液氮冻伤动物病理模型研究表明治疗冻伤第四天,肿胀抑制率为26.84%,第七天,肿胀抑制率为32.52%,且作用强于醋酸去炎松软膏,提示毛樱桃总黄酮有较强的抗冻伤作用。通过小鼠巴豆油耳肿胀试验和小鼠腹腔毛细血管通透性试验证实毛樱桃总黄酮可明显抑制非特异性炎症反应,而冻伤性炎症为非特异性炎症。通过对以上多种病理动物模型的药效学观察,充分验证了PTTTF对冻伤的治疗作用与民间应用效果相一致。由于PTTTF可降低毛细血管通透性及抑制非特异性炎症反应,从而促进冻伤性炎症的转归和组织修复,使损伤部位达到快速愈合,为冻伤的病理、病机研究及冻伤治疗的天然药物开发奠定了理论基础。PTTTF治疗冻伤的作用机制将有待于进一步研究。
1 王宜民,丛培月.验方-樱桃酒治疗冻疮[J].山东医刊,1962;84(12):36-36.
2 丛培月.用樱桃酒治疗冻伤效果好[J].药学通报,1965;9(9):369-370.
3 白云娥,漆小梅,赵 华 et al.聚酰胺分离金莲花总黄酮[J].中国医院药学杂志,2006;26(5):512-514.
4 吴晓宁,余陈欢,包启年.杭白菊总黄酮抗炎作用及其机制初探[J].中国临床药理学与治疗学,2009;14(9):1000-1004.
5 薛智谋,周慧英,周正宇 et al.“采和I、II号”治疗冻伤的实验研究[J].上海实验动物科学,2003;23(2):89-97.
6 徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2004:886-887,911-912.
7 陶 勇,肖玉秀,石米扬 et al.连钱草提取物对炎症递质的影响[J].医药导报,2007;26(8):840-843.
8 Salimi Z,Wolverson MK,Herbold D R et al.Frostbite:experimental asses-smental of tissue damage using Tc-99m pyrophosphate[J].Work in progress Rodiology,2000;25(3):56-59.
9 Sarikaya I,Aygit A C,Candan L et al.Assessment of tissue Viability after frostbite injury by technetium-99m-Scintigraphy in an experimental rabbit model[J].Eur JNucl Med,2000;27(1):41-45.
10 王凤芝,丁国珍,王玉明译.寒冷与冻结损伤[M].北京:解放军出版社,2001:108-121.
11 阮仕荣.冻伤病理生理和诊治研究进展[J].人民军医,2002;45(3):138-140.
12 Hamlet M P.Prevention and treatment of cold injury[J].Int JCircumpolar Health,2000;59:108-113.
13 Serda SM,Wei E T.Corticotropin releasing factor inhibitsthe acute inflammatory responseof rat pawskin to cold injury[J].Cryobiology,1991;28(2):185-190.
14 黄爱玲.黄酮类化合物药理作用研究进展[J].安徽农学通报,2007;13(10):71-72.
15 JIA G H,JIA S H S H.Development in pharmacological research of flavonesof liquorice[J].Chin Pharmaceu-tical J,1998;33(9):513-516.