小鼠Lewis肺癌细胞Foxp3的表达对T淋巴细胞增殖的影响及机制①
2010-07-30盖晓东付海英吉林大学白求恩医学院免疫学系长春130021
历 春 盖晓东 贾 婷 付海英 李 一 (吉林大学白求恩医学院免疫学系,长春130021)
Foxp3(forkhead box P3)属于叉头转录因子家族中的一员,是CD4+CD25+调节性T细胞(regulatory T cells,Tregs)特异性的表面标志和发育及功能的决定因素[1,2]。Tregs是一类具有免疫抑制功能的T淋巴细胞亚群,在维持机体自身耐受过程中具有重要作用[3,4]。此外,Tregs还参与肿瘤的免疫逃逸,在肿瘤组织及肿瘤患者外周血中均检测到Foxp3的高表达[5-7]。最新研究发现Foxp3在胰腺癌等肿瘤细胞内也有表达[8-13],而肿瘤细胞表达Foxp3是否与肿瘤的免疫逃逸相关尚不明确。因此,为了研究肿瘤细胞表达的Foxp3是否参与肿瘤的免疫逃逸,本研究检测小鼠Lewis肺癌(LLC)细胞Foxp3的表达,构建pcDNA3.1-Foxp3真核表达载体,将其转染小鼠LLC细胞,检测Foxp3过表达对T淋巴细胞的增殖和TGF-β1、IL-10表达的影响,探讨LLC 细胞中Foxp3表达在肿瘤免疫逃逸中的作用及可能机制。
1 材料与方法
1.1 实验试剂 pcDNA3.1(+)质粒(Invitrogen公司);胶回收试剂盒、质粒提取试剂盒、MMLV反转录酶 、Ex Taq DNA 聚合酶 、T4 DNA 连接酶 、DNA marker、EcoRⅠ和XhoⅠ限制性内切酶均为Takara公司产品;Foxp3单克隆抗体(eBiscience公司)、SP免疫组化试剂盒购自福州迈新生物技术公司;FuGENE HD(Roche);TGF-β1及IL-10 ELISA试剂盒均购自武汉博士德公司;刀豆蛋白A(ConA)购自Sigma公司。
1.2 实验动物 吉林大学实验动物中心提供C57BL/6小鼠7只,雌性,4~6周龄,体重18~22克。
1.3 细胞培养 小鼠LLC细胞用含10%新鲜小牛血清的DMEM培养液于37℃,5%CO2孵箱培养。
1.4 RT-PCR检测细胞中目的基因的表达 Trizol试剂提取细胞总RNA,逆转录成cDNA,以cDNA为模板,PCR仪扩增目的基因片段。Foxp3引物为:上游:5′-CAGCTGCCTACAGTGCCCCTAG-3′;下 游 :5′-CATTTGCCAGCAGTGGGTAG-3′。扩增条件:预变性94℃2分钟,(变性94℃30秒,退火 60℃30秒,延伸72℃1分钟),共进行35个循环,最后72℃延伸10分钟。扩增产物为 382 bp。TGF-β1引物为:上游 :5′-GCCCTGGATACCAACTATTGC-3′;下 游 :5′-GCAGGAGCGCACAATCATGTT-3′。扩增条件 :预变性94℃2分钟,变性 94℃30秒,退火58℃30秒,延伸72℃1分钟,共进行26个循环,最后72℃延伸10分钟。扩增产物为 360 bp。IL-10引物为:上游:5′-GCTCTTACTGACTGGCAT-3′;下 游:5′-GGCCTTGTAGACACCTTGGT-3′。扩增条件:预变性 94℃2分钟,变性94℃30秒,退火56℃30秒,延伸 72℃1分钟,共进行35个循环,最后72℃延伸10分钟。扩增产物为 440 bp。内参 β-actin 引物为:上游:5′-TGGAATCCTGTGGCATCCATGAAAC-3′;下游 5′-TAAAAC GCAGCTCAGTAACAGTCCG-3′。扩增条件:预变性94℃2分钟,(变性 94℃30秒,退火52℃30秒,延伸72℃1分钟),共进行25个循环,最后72℃延伸10分钟。扩增产物为320 bp。引物由上海生工有限公司合成。
1.5 免疫组化检测LLC细胞Foxp3蛋白的表达 LLC细胞经预冷的PBS洗涤,冷丙酮固定10分钟,PBS清洗后加内源性过氧化物酶阻断剂15分钟,PBS清洗后加血清室温封闭30分钟,加大鼠抗小鼠Foxp3(1∶100),并用PBS做阴性对照,于4℃冰箱孵育过夜。次日用PBS清洗,加羊抗大鼠IgG(1∶100)室温孵育40分钟,PBS清洗后加DAB显色5分钟,用自来水冲洗3分钟终止反应,然后依次进行苏木素衬染、盐酸水化及封固。每张切片在400倍显微镜下随机选取300个细胞,着色强度分为:不着色(-);浅黄色(+);黄色(++);棕黄色(+++)。将结果按下列公式计算:Foxp3蛋白表达积分=(+)%×1+(++)%×2+(+++)%×3。
1.6 pcDNA3.1-Foxp3真核表达载体的构建和鉴定 Trizol试剂提取小鼠脾细胞总RNA,逆转录成cDNA,扩增Foxp3全长开放读码框。根据GeneBank中小鼠Foxp3的mRNA基因全序列(AY357712)设计引物,功能片段约为1300 bp。上游引物为5′-CCA ATG CCC AACCCT AGG C-3′(下划线为EcoRⅠ酶切位点),下游引物为 5′-CAGT CTC GAG TCAAGGGCA GGGATT GGAGCA C-3′(下划线为XhoⅠ酶切位点)。PCR产物和pcDNA3.1载体分别用EcoRⅠ和XhoⅠ作双酶切,琼脂糖凝胶电泳回收并纯化产物,T4 DNA连接酶连接后产物转化DH5α,涂板筛选阳性克隆。阳性克隆用EcoRⅠ/XhoⅠ作双酶切后进行琼脂糖凝胶电泳及DNA测序鉴定。
1.7 FuGENE HD介导的重组质粒pcDNA3.1-Foxp3瞬时转染LLC细胞 转染前24小时,消化LLC细胞,细胞以5×105个/孔接种六孔板。实验分3组:LLC组,pcDNA3.1-LLC组及pcDNA3.1-Foxp3-LLC组。转染当日,细胞达到80%融合。转染前1小时各组均更换新鲜完全培养液,pcDNA3.1-LLC组及pcDNA3.1-Foxp3-LLC组分别取2μg质粒DNA(pcDNA3.1及pcDNA3.1-Foxp3),加入无血清的DMEM培养液至总体积为100μl,轻轻混匀,室温放置。分别取FuGENE HD 6μl,加入上述DNA稀释液中,轻轻混匀,室温放置15分钟后将转染工作液轻轻混匀,分别逐滴加入 pcDNA3.1-LLC组及 pcDNA3.1-Foxp3-LLC组培养液中,轻轻混匀培养液,置37℃,5%CO2孵箱培养。
1.8 C57BL/6小鼠脾淋巴细胞的制备 将C57BL/6小鼠断髓处死,无菌取脾脏,研磨后用淋巴细胞分离液分离,收集中间乳白色层制成脾淋巴细胞悬液,用PBS洗涤2次,离心(1 500 r/min,5分钟),重新悬浮于PBS,计数并调细胞浓度。
1.9 淋巴细胞转化试验检测转染Foxp3的LLC细胞对T淋巴细胞增殖的影响 分别取瞬时转染48小时后 LLC组、pcDNA3.1-LLC组及 pcDNA3.1-Foxp3-LLC组的细胞以1×104个/孔(100μl)接种96孔板中,待细胞贴壁后加入丝裂霉素C至终浓度25 μg/ml,置于细胞培养箱中37℃、5%CO2条件下培养2小时。以1×105个细胞/孔(100μl)的密度将脾淋巴细胞接种于已接种LLC细胞的96孔板中,同时设单纯淋巴细胞组作为对照组,DMEM培养液作为空白调零,以ConA(终浓度5 mg/L)刺激淋巴细胞转化,每组5个复孔。
收集瞬时转染48小时后LLC组、pcDNA3.1-LLC组及pcDNA3.1-Foxp3-LLC组的培养上清,置于96孔培养板,每孔100μl。加入分离的脾淋巴细胞悬液100μl(1×105个细胞)/孔,分组同上,以ConA(终浓度5 mg/L)刺激淋巴细胞转化,每组5个复孔。
以上各孔均于37℃、5%CO2条件下培养72小时;每孔加MTT溶液至MTT终浓度为0.5mg/ml,继续培养4小时;每孔加入DMSO 150μl,震荡 10分钟;使用酶标仪测定各孔的光密度值,检测波长为570 nm。淋巴细胞增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%。
1.10 ELISA检测培养上清中TGF-β1和IL-10的浓度 分别取LLC组、pcDNA3.1-LLC组和pcDNA3.1-Foxp3-LLC组瞬时转染48小时后的培养上清,采用酶联免疫吸附试验(ELISA),参照试剂盒说明检测其中分泌的TGF-β1和IL-10蛋白含量,检测波长为450 nm。
1.11 统计学处理 采用SPSS 12.0统计软件进行分析,样本均数比较采用t检验,P<0.05为有统计学意义。
2 实验结果
2.1 LLC细胞Foxp3 mRNA的表达 为了证实Foxp3在LLC细胞中的表达,首先采用RT-PCR方法从基因水平对LLC细胞进行Foxp3 mRNA的检测,结果显示2个LLC细胞样本在382 bp处均有目的条带出现,与阳性对照脾细胞Foxp3条带相符,但没有脾细胞表达强;阴性对照NIH-3T3细胞无Foxp3 mRNA表达;初步表明小鼠LLC细胞表达Foxp3。见图1。
2.2 LLC细胞Foxp3蛋白的表达 为进一步证实LLC细胞中Foxp3在蛋白水平的表达,对LLC细胞进行了免疫组化检测。结果显示,Foxp3蛋白在LLC细胞中呈阳性表达,表现为细胞核内棕黄色均匀细颗粒,但着色较浅,见图2。此结果进一步证明LLC细胞表达Foxp3。
2.3 重组质粒pcDNA3.1-Foxp3的构建
2.3.1 Foxp3全长基因的扩增结果 为进一步研究Foxp3在LLC细胞表达的可能作用,构建pcDNA3.1-Foxp3重组质粒。首先扩增小鼠Foxp3全长基因。结果小鼠脾细胞总RNA经RT-PCR扩增后,琼脂糖凝胶电泳显示在约1.3 kb处可见一明显扩增条带,与Foxp3全长基因片段长度相符,见图3。
2.3.2 重组质粒pcDNA3.1-Foxp3的酶切电泳鉴定 为鉴定重组质粒pcDNA3.1-Foxp3,采用EcoRⅠ和XhoⅠ内切酶对重组质粒进行酶切电泳鉴定。经双酶切的重组质粒pcDNA3.1-Foxp3和pcDNA3.1空质粒分别电泳后,前者出现了1.3和5.4 kb两条带(1.3 kb为Foxp3 cDNA产物,5.4 kb为pcDNA3.1线状质粒),而pcDNA3.1空质粒则只有5.4 kb一条带,初步表明重组质粒构建成功,见图4。
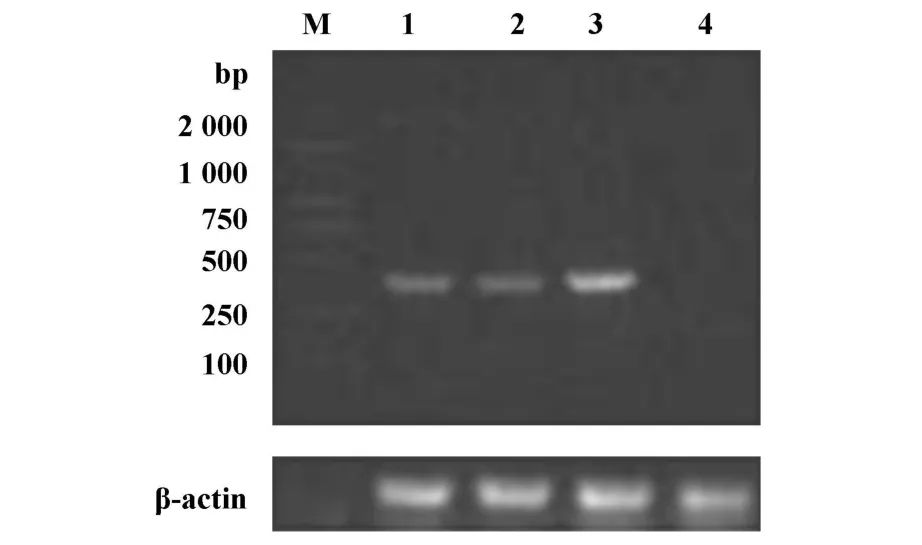
图1 Foxp3 mRNA在LLC细胞的表达Fig.1 The expression of Foxp3 mRNA in LLC cells
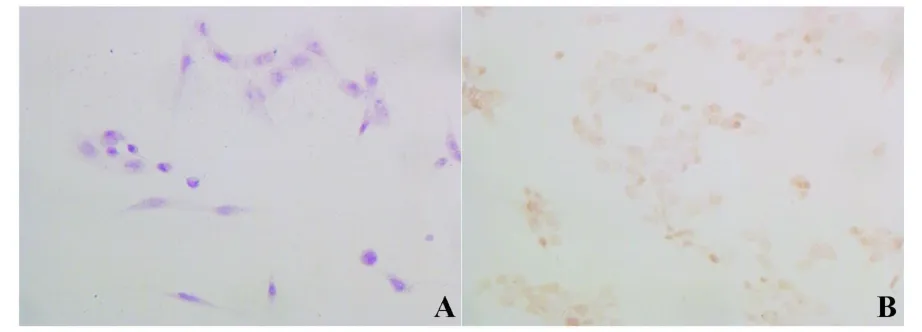
图2 免疫组化结果显示LLC细胞表达Foxp3蛋白(×400)Fig.2 The expression of Foxp3 protein in LLC cells by IHC
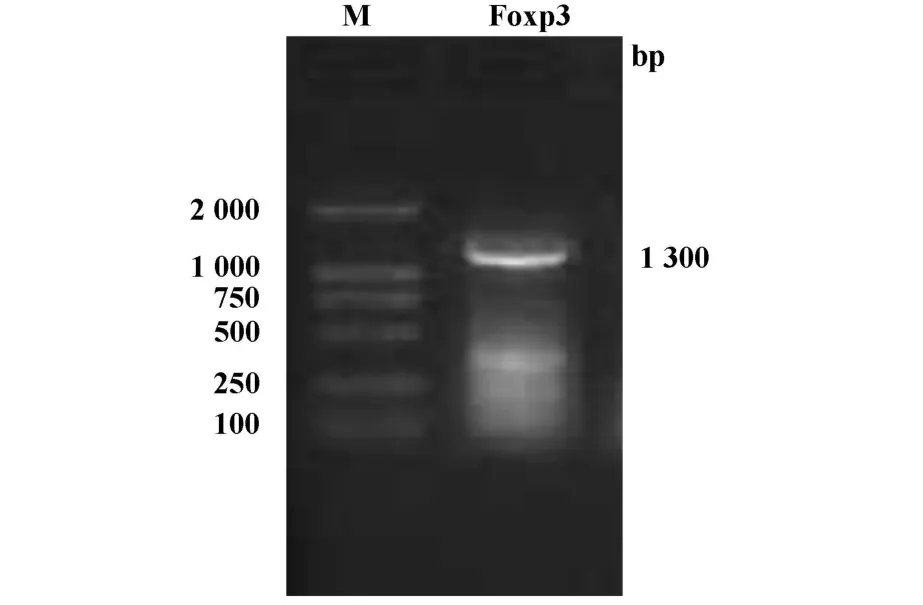
图3 Foxp3的PCR产物电泳图Fig.3 Gel electrophoresis result of Foxp3 PCR products
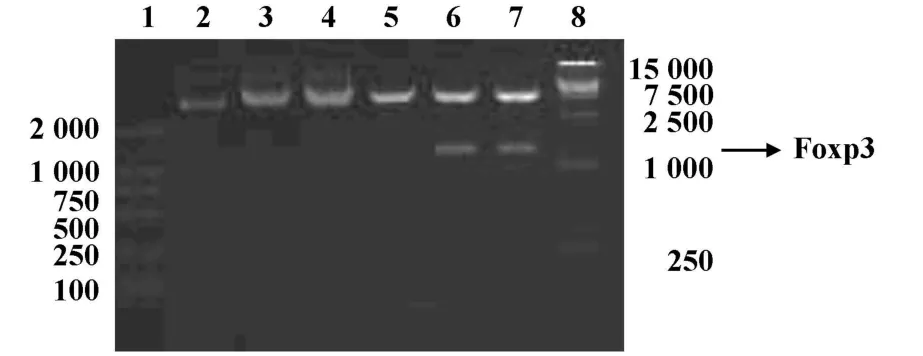
图4 重组质粒pcDNA3.1-Foxp3酶切后的电泳鉴定Fig.4 Enzyme-cutting identification of recombinant plasmid pcDNA3.1-Foxp3 by EcoRⅠand XhoⅠ
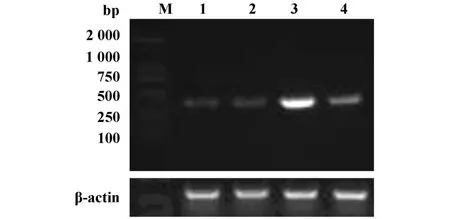
图5 pcDNA3.1-Foxp3转染LLC细胞后Foxp3 mRNA的表达水平Fig.5 The expression level of Foxp3 mRNA in LLCcells after transfected with pcDNA3.1-Foxp3
2.3.3 重组质粒pcDNA3.1-Foxp3的测序鉴定 为进一步证实重组质粒为pcDNA3.1-Foxp3,对重组质粒进行了测序,结果证实所克隆的基因为小鼠Foxp3。
2.4 瞬时转染LLC细胞48小时后Foxp3 mRNA的表达 为证实转染后Foxp3的高表达,采用RT-PCR方法从基因水平对LLC细胞进行了检测。结果显示,pcDNA3.1-Foxp3-LLC组Foxp3 mRNA表达较LLC组和pcDNA3.1-LLC组明显增强(P<0.01),而在LLC组和pcDNA3.1-LLC组中Foxp3mRNA表达之间无明显差异(P>0.05)。见图5、6,结果证明LLC细胞转染pcDNA3.1-Foxp3后Foxp3基因表达上调。
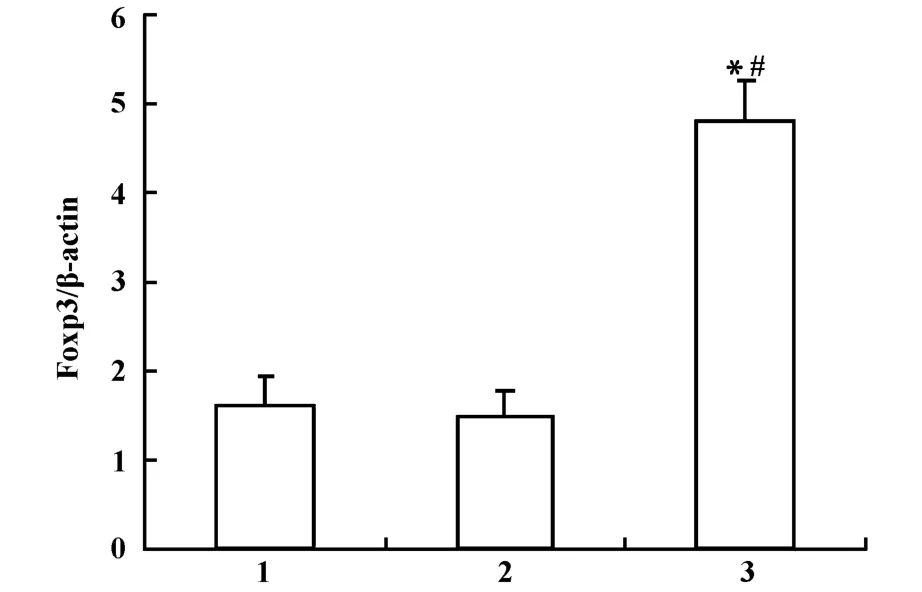
图6 pcDNA3.1-Foxp3转染LLC细胞后Foxp3 mRNA的表达水平Fig.6 The expression level of Foxp3 mRNA in LLC cells after transfected with pcDNA3.1-Foxp3
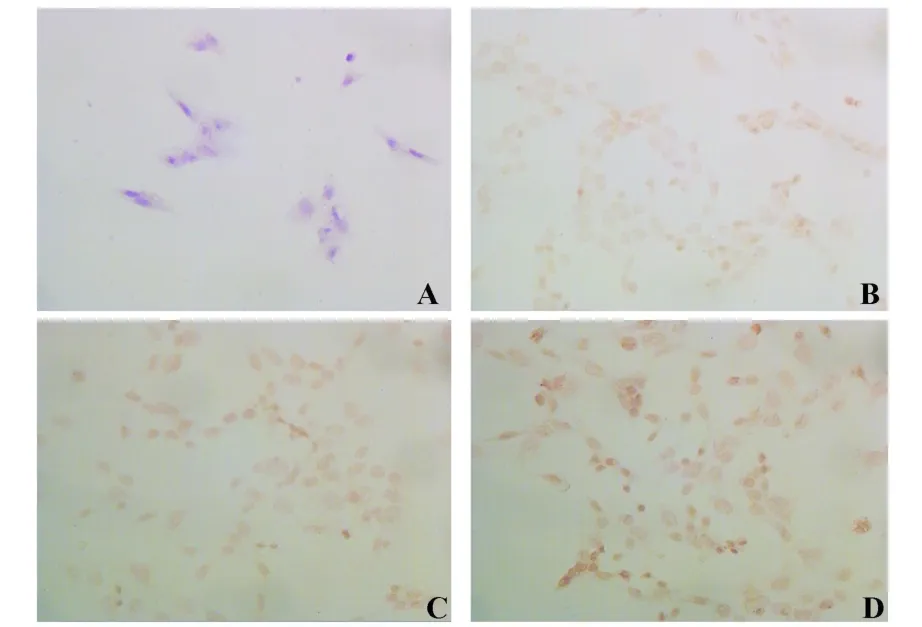
图7 pcDNA3.1-Foxp3转染LLC细胞后Foxp3蛋白的表达水平(×400)Fig.7 Theexpression level of Foxp3 protein in LLC cells after transfected with pcDNA3.1-Foxp3(×400)
2.5 瞬时转染48小时后LLC细胞Foxp3蛋白的表达 为进一步证实Foxp3基因是否成功转入LLC细胞,对转染48小时后的细胞进行免疫组化检测。结果显示,LLC组和pcDNA3.1-LLC组Foxp3蛋白着色较浅,且较均匀;而pcDNA3.1-Foxp3-LLC组Foxp3蛋白的着色较深,且深浅不一,见图7。LLC组、pcDNA3.1-LLC组及pcDNA3.1-Foxp3-LLC组Foxp3蛋白表达积分分别为(184.7±4.73)%、(188.6±5.68)%及(221.7±7.64)%。pcDNA3.1-Foxp3-LLC组Foxp3蛋白表达积分与LLC组和pcDNA3.1-LLC组比较差异有显著性(P<0.05),而在LLC组和pcDNA3.1-LLC组中Foxp3蛋白表达之间无明显差异(P>0.05)。结果提示pcDNA3.1-Foxp3被成功导入LLC细胞,并能高表达Foxp3蛋白。
2.6 转染Foxp3的LLC细胞对T淋巴细胞增殖的影响 为研究LLC细胞Foxp3对T淋巴细胞增殖的影响,采用淋巴细胞转化试验,将转染Foxp3的LLC细胞及其上清分别与ConA刺激下的脾淋巴细胞共培养72小时。结果显示,LLC组、pcDNA3.1-LLC组及pcDNA3.1-Foxp3-LLC组的LLC细胞及其上清均可使T淋巴细胞的增殖受到抑制,且 pcDNA3.1-Foxp3-LLC组的LLC细胞及其上清对T淋巴细胞增殖的抑制作用更为显著,与LLC组和pcDNA3.1-LLC组比较有统计学意义(P<0.05),而在LLC组和pcDNA3.1-LLC组之间无明显差异(P>0.05),见表1、表2。以上结果提示LLC细胞中的Foxp3可抑制T淋巴细胞的增殖,其作用方式可能是通过细胞接触的方式或促进某种细胞因子的分泌而实现的。
表1 转染Foxp3的LLC细胞对T淋巴细胞增殖的影响(±s,%)Tab.1 The effect of Foxp3 transfected LLC cells on T cell proliferation±s,%)
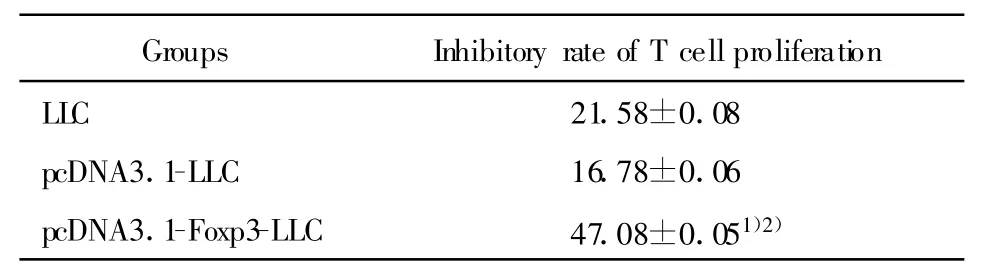
表1 转染Foxp3的LLC细胞对T淋巴细胞增殖的影响(±s,%)Tab.1 The effect of Foxp3 transfected LLC cells on T cell proliferation±s,%)
Note:Compared with LLC group,1)P<0.05;Compared with pcDNA3.1-LLC group,2)P<0.05.
Groups Inhibitory rate of T cell proliferation LLC 21.58±0.08 pcDNA3.1-LLC 16.78±0.06 pcDNA3.1-Foxp3-LLC 47.08±0.051)2)
表2 转染Foxp3的LLC细胞上清对T淋巴细胞增殖的影响(±s,%)Tab.2 The effect of the supernatant from cultured Foxp3 transfected LLC cells on T cell proliferation(±s,%)
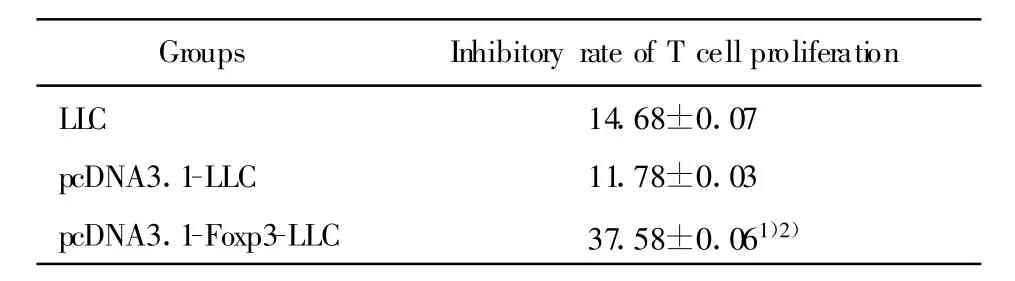
表2 转染Foxp3的LLC细胞上清对T淋巴细胞增殖的影响(±s,%)Tab.2 The effect of the supernatant from cultured Foxp3 transfected LLC cells on T cell proliferation(±s,%)
Note:Compared with LLC group,1)P<0.05;Compared with pcDNA3.1-LLC group,2)P<0.05.
Groups Inhibitory rate of T cell proliferation LLC 14.68±0.07 pcDNA3.1-LLC 11.78±0.03 pcDNA3.1-Foxp3-LLC 37.58±0.061)2)
2.7 转染 Foxp3的LLC细胞对TGF-β1和IL-10 mRNA和蛋白表达的影响 为研究LLC细胞中Foxp3对T淋巴细胞增殖抑制作用的可能机制,采用RTPCR和ELISA方法检测Foxp3过表达对免疫抑制因子TGF-β1和IL-10 mRNA和蛋白表达的影响。结果显示,pcDNA3.1-Foxp3-LLC组细胞中 TGF-β1和 IL-10 mRNA表达较LLC组、pcDNA3.1-LLC组明显增强(P <0.05),见图 8、图 9;同时 ,pcDNA3.1-Foxp3-LLC组培养上清中TGF-β1和IL-10蛋白的含量较LLC组、pcDNA3.1-LLC组也均有显著增加(P<0.05),而在LLC组和pcDNA3.1-LLC组之间无明显差异(P>0.05),见图10。结果提示,LLC细胞中Foxp3可能通过上调免疫抑制因子TGF-β1和IL-10的表达从而抑制T淋巴细胞的增殖。
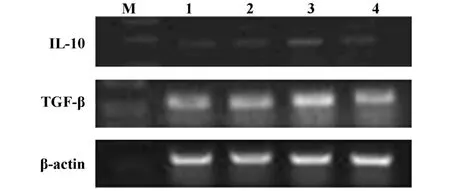
图8 转染 Foxp3的LLC细胞对 TGF-β1和IL-10 mRNA表达的影响Fig.8 Theeffect of Foxp3 transfected LLCcells on mRNA expression of TGF-β1 and IL-10
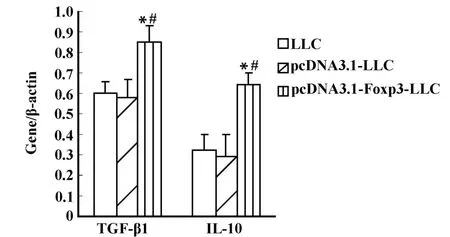
图9 转染 Foxp3的LLC细胞对 TGF-β1和IL-10 mRNA表达影响Fig.9 Theeffect of Foxp3 transfected LLCcells on mRNA expression of TGF-β1and IL-10
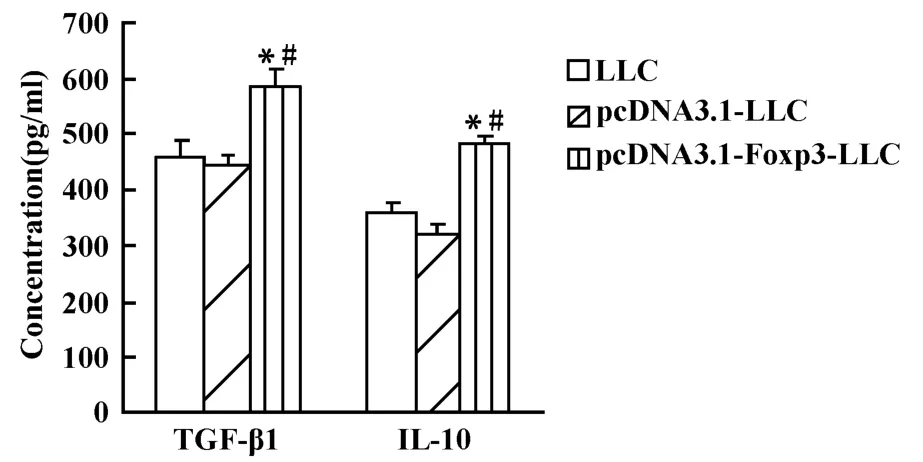
图10 转染 Foxp3的LLC细胞培养上清对TGF-β1和IL-10蛋白分泌的影响Fig.10 The effect of Foxp3 transfected LLC culture supernatant on protein secretion of TGF-β1 and IL-10
3 讨论
目前Foxp3仍然被认为是Tregs的一个最特异标志,在肿瘤免疫逃逸机制中发挥重要作用[14]。最新研究发现,Foxp3在胰腺癌、乳腺癌等肿瘤细胞的细胞核或胞浆内也有表达[8-13]。Hinz等[8]发现TGF-β2可诱导胰腺癌肿瘤细胞中Foxp3的表达,通过小干扰RNA方法特异地抑制肿瘤细胞Foxp3表达后,IL-6、IL-8的表达上调。Merlo等[9]对397例乳腺癌标本的研究显示Foxp3的表达与患者总生存率密切相关,可作为临床预测预后的独立因子。而Zuo等[10]对乳腺癌的研究显示Foxp3可以抑制癌基因SKP2转录,并抑制乳腺癌肿瘤细胞的生长。本实验通过RT-PCR和免疫组化方法分别检测了小鼠LLC肺癌细胞株Foxp3的mRNA和蛋白表达。结果显示Foxp3在mRNA和蛋白水平均有表达,而且免疫组化结果显示Foxp3蛋白主要分布于细胞核,表明Foxp3在小鼠LLC细胞主要为核表达。
Tregs在肿瘤免疫中发挥免疫抑制作用,而Foxp3在肿瘤细胞表达的作用尚不明确。本实验探讨LLC细胞中Foxp3的作用是否和在Tregs中一样通过抑制T淋巴细胞的增殖而参与肿瘤的免疫逃逸过程。首先构建pcDNA3.1-Foxp3真核表达载体,将其瞬时转染LLC细胞,通过RT-PCR和免疫组化方法从基因和蛋白水平证实了Foxp3的过表达。淋巴细胞转化试验结果显示,LLC组、pcDNA3.1-LLC组及pcDNA3.1-Foxp3-LLC组的细胞及其上清均可抑制T淋巴细胞的增殖转化,并且pcDNA3.1-Foxp3-LLC组的细胞及其上清对T淋巴细胞增殖的抑制作用更为显著。结果表明在有无细胞直接接触的情况下,Foxp3均可显著抑制T淋巴细胞的增殖。因此推测Foxp3在LLC细胞的作用可能与其在Tregs中的作用一样通过抑制T淋巴细胞的增殖参与肿瘤的免疫逃逸。
TGF-β1和IL-10是参与肿瘤免疫逃逸的重要免疫抑制分子。TGF-β1作为TGF-β超家族的成员,是一种强大的免疫抑制因子,可通过多种机制促进肿瘤的恶性进展[15]。IL-10对多种免疫细胞有抑制作用,从而介导免疫抑制。有研究报道Foxp3在Tregs发挥免疫抑制的主要机制之一是通过细胞间直接接触或分泌TGF-β1和IL-10的方式直接或间接参与了肿瘤免疫逃逸的过程[16,17]。为此,我们检测了Foxp3过表达的LLC细胞中 TGF-β1和 IL-10的mRNA和蛋白表达。结果显示,pcDNA3.1-Foxp3-LLC组的细胞中TGF-β1和IL-10 mRNA表达水平较 LLC组、pcDNA3.1-LLC组均明显增强,而且其培养上清中TGF-β1和IL-10蛋白的浓度较LLC组、pcDNA3.1-LLC组均显著增加。表明LLC细胞中的Foxp3与免疫抑制因子TGF-β1和IL-10密切相关,LLC细胞中Foxp3抑制T淋巴细胞的增殖作用可能是通过上调TGF-β1和 IL-10 的表达,促进TGF-β1 和 IL-10 的分泌而实现的。同时本研究还发现,转染Foxp3的LLC细胞上清对T淋巴细胞增殖的抑制作用弱于转染Foxp3的LLC细胞与T淋巴细胞直接接触时的抑制作用,提示除了免疫抑制因子TGF-β1和IL-10的作用外,可能还有其他机制参与其中,有待进一步研究。
以上研究表明,小鼠LLC细胞Foxp3可能通过上调TGF-β1和IL-10的表达抑制T淋巴细胞的增殖从而参与肿瘤的免疫逃逸。因此,在肿瘤微环境中,不仅Tregs发挥免疫抑制作用促进肿瘤的免疫逃逸,同时,肿瘤细胞表达的Foxp3也参与了肿瘤的免疫逃逸作用。深入研究肿瘤细胞Foxp3在肿瘤免疫逃逸过程中的作用机理将会为肿瘤的免疫治疗提供新的靶位和治疗途径。
1 Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003;299:1057-1061.
2 Fontenot JD,Rasmussen JP,Williams L M et al.Regulatory T cell lineage specification by the forkhead transcription factor Foxp3[J].Immunity,2005;22:329-341.
3 Lim H W,Hillsamer P,Banham AH et al.Cutting edge:direct suppression of B cells by CD4+CD25+regulatory T cells[J].J Immunol,2005;175(7):4180-4183.
4 Marson A,Kretschmer K,Frampton G et al.Foxp3 occupancy and regulation of key target genes during T-cell stimulation[J].Nature,2007;445:931-935.
5 Miller A M,Lundberg K,Ozenci V et al.CD4+CD25 high T cells areenriched in the tumor and peripheral blood of prostate cancer patients[J].J Immunol,2006;177:7398-7405.
6 Le Gouvello S,Bastuji-Garin S,Aloulou N et al.High prevalence of Foxp3 and IL17 in MMR-proficient colorectal carcinomas[J].Gut,2008;57(6):772-779.
7 Jensen H K,Donskov F,Nordsmark M et al.Increased intratumoral FOXP3-positive regulatory immune cells during interleukin-2 treatment in metastatic renal cell carcinoma[J].Clin Cancer Res,2009;15:1052-1058.
8 HinzS,Pagerols-Raluy L,Oberg HH et al.Foxp3expression in pancreatic carcinoma cells as a novel mechanism of immune evasion in cancer[J].Cancer Res,2007;67:8344-8350.
9 Merlo A,Casalini P,Carcangiu M L et al.FOXP3 expression and overall survival in breast cancer[J].J Clin Oncol,2009;27(11):1746-1752.
10 Zuo T,Liu R,Zhang H et al.FOXP3 is a novel transcriptional repressor for the breast cancer oncogene SKP2[J].JClin Invest,2007;117:3765-3773.
11 Ebert LM,Tan B S,Browning J et al.The regulatory T cell-associated transcription factor Foxp3 is expressed by tumor cells[J].Cancer Res,2008;68:3001-3009.
12 Lu H.Foxp3 expression and prognosis:role of both thetumor and T cells[J].J Clin Oncol,2009;27(11):1735-1736.
13 Raskin L,Rennert G,Gruber S B et al.Foxp3 germline polymorphisms are not associated with riskof breast cancer[J].Cancer Genet Cytogenet,2009;190(1):40-42.
14 Gallimore A,Godkin A.Regulatory Tcells and tumour immunity-observations in mice and men[J].Immunology,2008;123:157-163.
15 Moustakas A,Pardali K,Gaal A et al.Mechanisms of TGF-βsignaling in regulation of cell growth and differentiation[J].Immunology Letters,2002;82(1-2):85-91.
16 Strauss L,Bergmann C,Szczepanski M et al.A unique subset of CD4+CD25highFoxp3+T cells secreting interleukin-10 and transforming growthfactor-beta1 mediates suppression in the tumor microenvironment[J].Clin Cancer Res,2007;13:4345-4354.
17 Larmonier N,Marron M,Zeng Y et al.Tumor derived CD4+CD25+regulatory T cell suppression of dendritic cell function involves TGF-beta and IL-10[J].Cancer Immunol Immunother,2007;56:48-59.