蛇毒C型凝集素家族结构及抗原表位预测①
2010-07-30钟立鹏黄春洪南昌大学基础医学院生物化学教研室南昌330006
涂 硕 陈 柯 钟立鹏 黄春洪 (南昌大学基础医学院生物化学教研室,南昌330006)
血栓栓塞性疾病及其并发的病变,是最常见的死亡病因之一。血小板作为血栓的主要成分,在血栓特别是在动脉血栓和微血管血栓形成过程中,起着关键作用。它通过其表面的膜糖蛋白GPIb-Ⅸ-Ⅴ复合物的α链,与血管假性血友病因子(von Willebrand Factor,vWF)结合,产生有力的信号导致血小板激活和聚集,最终导致血栓形成[1]。通过阻断血小板膜GPIb与vWF的结合是发展新一代抗血栓药物的热点,特别是对于治疗动脉血栓和预防再梗具有更大优势。C型凝集素蛋白(C type lectin protein,CLP)是天然的GPIb结合蛋白,能竞争性阻断vWF与GPIb的结合。例如从五步蛇蛇毒中分离的Agkisacutacin能够降低全血黏度,延长凝血时间,能特异作用血小板GPIb,早期抑制血小板聚集形成血栓[2]。
C型凝集素蛋白家族是蛇毒中共同存在的一个家族,目前从不同种属蛇毒分离的CLPs有近100种,其中从五步蛇蛇毒中分离的组分有Agkisacutacin、ACFI/II、Agacutegrin、Agkicetin、Acutus IX/X[3-4]。蛇毒中丰富的CLPs是抗血栓药物开发的天然宝库。然而,蛇毒是一种非常复杂的蛋白质溶液,要从众多毒素蛋白中分离出目的蛋白,往往需要复杂的工艺。亲和层析法是一种高特异性分离方法,常用于血清中抗体的分离,因此,构建CLP免疫亲和层析法将可大大提高蛇毒CLPs药物发现与分离的效率。实现这种高效率分离的重要前提是制备得到CLP抗体。而欲得到特异性抗体,则首先必须设计并合成蛇毒CLPs共同抗原,与载体蛋白偶联后免疫动物才能获得。本研究利用生物信息学原理与相关软件,分析蛇毒CLP家族结构特性,并对CLPs的抗原表位进行预测与验证,确定共有抗原表位肽段。
1 材料与方法
1.1 五步蛇毒C型凝集素蛋白序列比对 从蛋白质数据库(http://www.expasy.ch/sprot/)中选取五步蛇(Agkistrodon acutus)蛇毒 CLPs蛋白序列13条,登记号分别是Q8JIW0(ACF1/2 A)、Q8JIW1(Agkisacutegrin B)、Q8AYA3(Agglucetin β2)、Q8AYA4(Agglucetin β1)、Q9DEA1(Agkicetin-C β)、Q9DEA2(Agkicetin-C α)、Q9OWL9(Akitonin)、Q9DEF8(Anticoagulant B)、Q9DEF9(Anticoagulant A)、Q9IAM1(Agkisacutacin A)、Q8JIV8(C-type lectin)、Q8JIV9(Agglucetin α1)、Q8AYA5(Agglucetinα2),采用在线的Align功能进行匹对。选择与共同序列同源性最高的Q8AYA3进行结构和抗原表位预测。
1.2 蛇毒C凝集素二级结构及线性抗原表位预测 应用DNAstar Protean程序模块预测Q8AYA3二级结构与B细胞抗原表位。采用Chou-Fasman法和Garnier-Robson法预测Q8AYA3二级结构,各残基Pα、Pβ、PT、PC 等参数意义参考文献[5];用 Karplus-Schultz法预测分子骨架的柔韧性。用Kyte-Doolitle法根据序列的氨基酸组成预测Q8AYA3蛋白的疏水区和亲水区;用Emini法预测Q8AYA3蛋白的表面可及性(可能性);用Jameson-Wolf法预测Q8AYA3的抗原指数,分析Q8AYA3的B细胞抗原表位。
采用另一种蛋白质分析软件antheprot进行验证性预测。主要是预测Q8AYA3的亲水性、疏水性及溶液可及性区段,采用Parker及Welling方法分别预测Q8AYA3的B细胞抗原表位,最后综合DNAstar结果综合分析Q8AYA3的B细胞抗原表位。
1.3 Q8AYA3的空间结构模建与空间表位预测 采用Swiss-model法[6]在线(http://swissmodel.expasy.org/)对五步蛇各种CLPs进行结构模建,采用automated mode方式进行空间结构预测。
采用在线软件SEPPA[7](Spatial Epitope Prediction of Protein Antigens)(http://lifecenter.sgst.cn/seppa/)进行预测。SEPPA自动搜寻与Q8AYA3同源性最高的CLP晶体结构,并预测此晶体结构空间表位。
1.4 实验验证 将表位预测设计的结果送上海科肽生物技术公司合成,纯度为95%以上。参照文献[8]方法,用MBS(马来酸酰亚胺苯甲酸-N羟基琥珀酸亚胺酯,Sigma公司)法将多肽与载体蛋白KLH(钥孔蓝蛋白,Sigma公司)进行偶联。KLH-肽偶联物与完全弗氏佐剂等体积混合,首次免疫新西兰白兔。2周和4周后,KLH-肽联合不完全弗氏佐剂进行第二次与第三次免疫。耳缘静脉采血,得免疫血清,用琼脂糖双扩散法检测多克隆抗体的生成情况。
2 结果
2.1 蛇毒C型凝集素序列比对 利用在线Align工具对五步蛇13条CLPs序列进行比对,结果如图1。蛇毒CLPs通常由两个同源性较高的分子量约为13~17 kD的亚基通过一对二硫键组成异二聚体,亚基的氨基酸长度为147-159,其中第1-23位为信号肽。各序列Cys位置比较保守,形成三对链内二硫键。以Q8AYA3为例,其二硫键主要是 Cys27-Cys38、Cys55-Cys145和Cys121-Cys137。CLP的两个亚基通过一个亚基的Cys79与另一个亚基的Cys75形成链间二硫键。比对分析发现,CLPs的N端结构域如α螺旋和β折叠以及中间的Loop同源性较高,主要起到了维持蛋白结构作用;而靠近C端的序列同源性较差,可能是CLPs多样性和结合底物多样性的原因。
2.2 二级结构及抗原表位预测 采用DNAstar protean模块的Chou Fasman方案和Garnier Robson法进行二级结构分析,结果表明:Q8AYA3相对分子量为17 233.98,等电点是7.89,二级结构主要为4个α-螺旋和6个β-折叠,见图2。
2.3 Q8AYA3亲水性、可及性、可塑性及抗原性参数 Q8AYA3亲水性、可及性、可塑性及抗原性预测结果见图3。采用Kyte-Doolittle方法分析Q8AYA3的亲水性,结果表明氨基酸区段 31-38、43-64、68-75、95-119、127-146为亲水性高的区域。Emini法预测的表面可及性区段为 Lys43-Ala51、Glu57-Lys60、His68-Glu72、Asp99-Gly107、Thr126-Asp129。 根据 Karplus Schulz可塑性与Jameson-Wolf抗原指数预测结果,Q8AYA3的可塑性区与抗原表位区恰好对应,即19-25 、30-37 、43-64 、68-75 、96-113 、117-121 、122-132 、136-142。
2.4 Antheprot分析结果 采用Antheprot软件分析了Q8AYA3的亲水性、疏水性、抗原指数、溶剂可及性(即表面可及性)。结果见图4,其中Lys43-Gly62区抗原指数(Parker et al)、亲水性、溶液可及性指数均最高,其次为98NDCKREWSDGTKL110区。这两个区段分别与DNAstar软件预测的43-64区和95-119区完全吻合,多个预测方法共同表明这两个区段具有良好的抗原表位特征。从13条CLPs序列对比结果可以发现43-64区保守性很高,并靠近N端(图1),是一个较为理想的蛇毒CLPs“共同抗原”。而98~110区保守性略差,并位于多肽链中段,是抗原表位次要选择。结合抗原设计原则,最终确定一个13肽的序列,即46KTW( A)DAEKFCTEQ58为最优化的B细胞抗原表位区。由于CLPs的49位多数为A(Ala),所以序列设计为KTWADAEKFCTEQ。
2.5 Q8AYA3的结构预测与空间表位预测 输入Q8AYA3氨基酸序列,在Swiss-model进行同源模建,数据库自动匹配的结构模板为1c3aB,该蛋白是来源于黄斑原矛头蝮(Protobothrops flavoviridis)的CLP蛋白flavocetin-Aβ亚基。Q8AYA3与 flavocetin-Aβ序列相似度为63%,图5为预测的Q8AYA3空间结构,该结构中主要有2个α-螺旋和7个β-折叠组成,与DNAstar预测的二级结构结果稍有不同。实际上,CLP每个亚基中都含有3对非常保守的二硫键,导致CLPs的空间结构非常类似,也导致了蛋白质表面参数的相同。

图1 13条五步蛇CLPs序列比对结果Fig.1 Alignment of the13 venom C typelectin sequences of five-pace snake

图2 Dnastar软件预测的Q8AYA3二级结构结果Fig.2 The secondary structure of Q8AYA3 protein predicted by Dnastar software
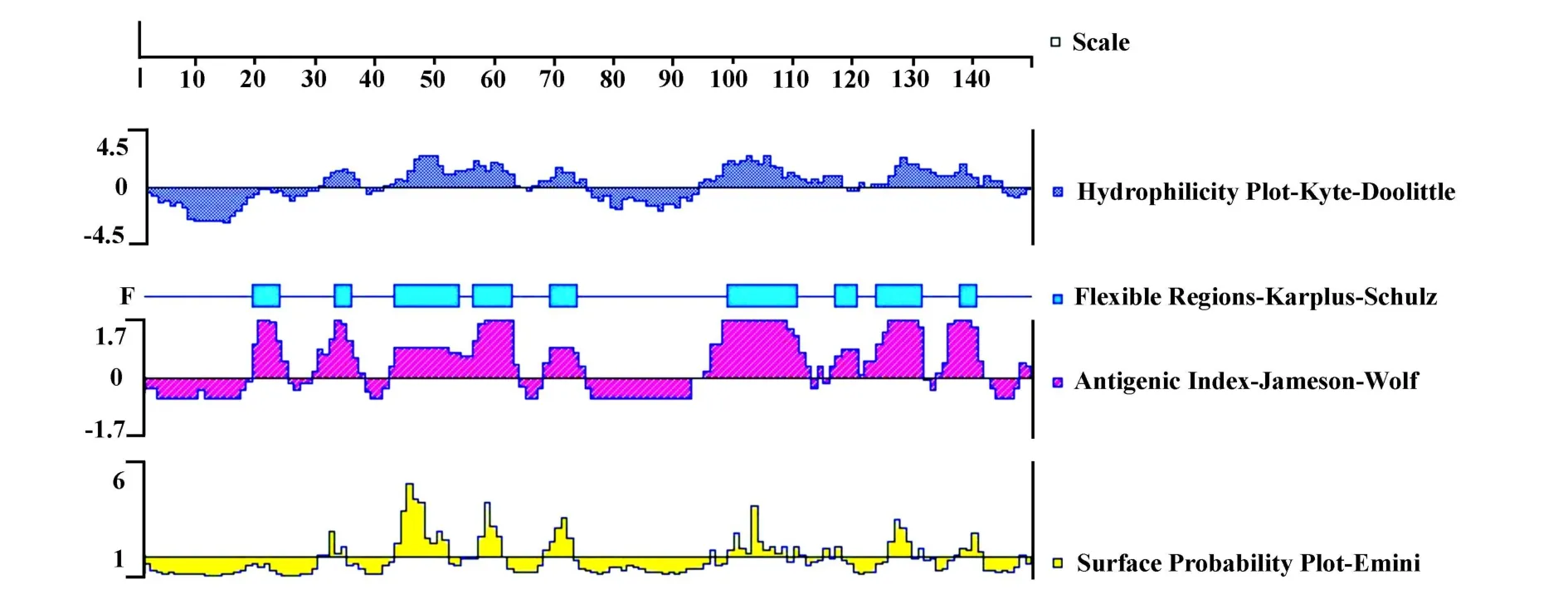
图3 Q8AYA3亲水性、可及性、可塑性及抗原性分析结果Fig.3 Hydrophilicity,surface probability,flexibility and antigenic index of Q8AYA3 predicted by Dnastar
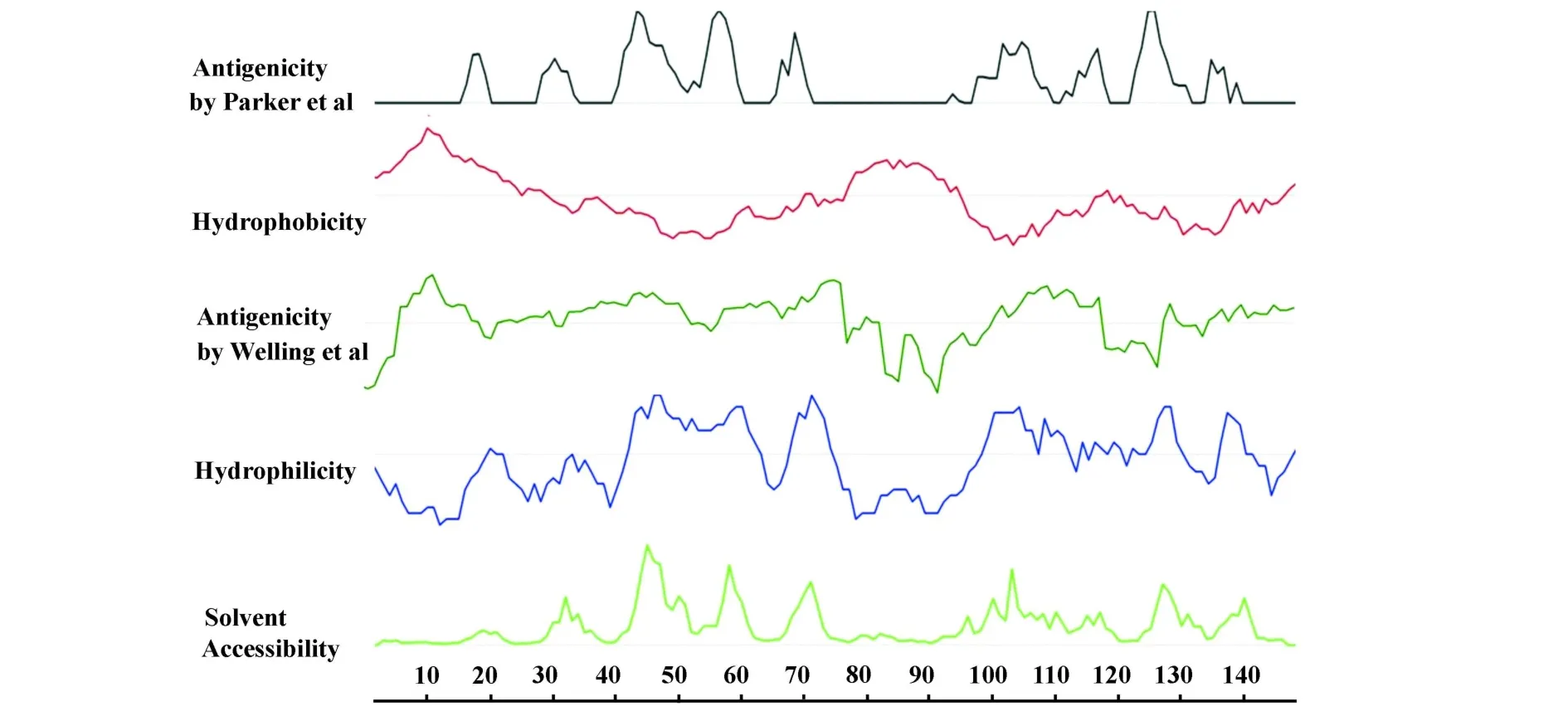
图4 Q8AYA3抗原性、亲水性、可及性指数的Antheprot软件分析结果Fig.4 Antigenicity,hydrophilicity and solvent accessibility of Q8AYA3 predicted by Antherprot software
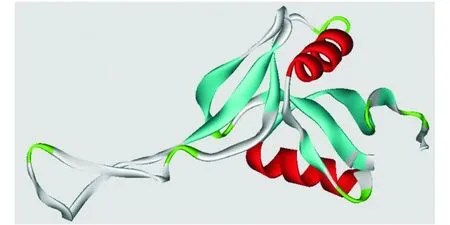
图5 同源模建得到的Q8AYA3空间结构Fig.5 Tertiary structure of Q8AYA3 predicted by swiss modeling
Q8AYA3空间抗原表位预测需要其晶体结构实验数据。用SEPPA在线工具,对已知晶体结构的flavocetin-Aβ的空间表位进行了预测。结果见图6(已经去除信号肽),黄色标记的氨基酸为空间抗原表位区。因为flavocetin-Aβ是Q8AYA3同源度最高的CLP蛋白,因此可以大致反映出Q8AYA3的空间抗原表位区。值得注意的是,flavocetin-Aβ中KFc-TQQHKG与前面预测的共同抗原“KTWADAEKFCTEQ”属于同源性片段。这也说明该共同抗原肽是五步蛇CLP家族的理想抗原表位区。

图6 SEPPA预测的flavocetin A空间表位结果(已去除信号肽)Fig.6 The predicted spatial epitope of flavocetin A by use of SEPPA,a computational server

图7 琼脂糖双向扩散验证免疫血Fig.7 Identification of the immune serum by quincuncial style agarose doubleimmuno-diffusion
2.6 实验验证 依照上述预测的“共同抗原”序列合成多肽,多肽与KLH偶联后免疫新西兰兔。第三次免疫之后10天采血,用0.8%琼脂糖双扩散法进行检测抗体的生成情况,结果见图7。中间孔为兔血清,1、2和3号孔分别为多肽、KLH蛋白和肽-KLH,4号和5号孔分别为五步蛇蛇毒和纯化的蛇毒CLP。从结果看,1号多肽与血清没有沉淀线,其他四个孔与血清孔均有明显的沉淀线。结果说明:①多肽与血清没有沉淀线,可能原因是多肽分子量太低而导致无沉淀。而血清与蛇毒粗毒及蛇毒C型凝集素均有沉淀,说明血清中确实含有针对此抗原表位肽的抗体;②血清中还存在抗载体蛋白KLH的抗体。
3 讨论
从上世纪80年代Hopp和Woods提出亲水性参数对抗原表位预测的方法以来[8],已有许多参数、算法发表,对B细胞蛋白抗原表位研究起到巨大的推动作用。现在已经有许多关于蛋白质B细胞抗原表位肽预测的报道。一般来说,选择蛋白质氨基酸序列的抗原表位,除了利用适当的蛋白质分析软件,还需要综合考虑选定片段的亲水性、可塑性、转角结构、电荷数等。序列以12-15个氨基酸为宜,序列应避免出现4个以上连续相邻的疏水性残基,序列中带电荷的氨基酸越多越好[9,10]。Chou-Fasman/Garnier-Robson、Karplus-Schulz、Kyte-Doolittle、Emini 和Parker/Welling预测法为目前常用的二级结构、柔性、亲水性、表面可及性及抗原性预测法。综合分析这些度量值,可以大大提高预测的准确性。但值得注意的是,这种综合分析是一种“全人工”的分析过程,缺乏客观的标准,因此在预测的准确性上还难以令人满意。无论是本论文中的软件,还是在线程序如PEOPLE、BEPITOPE、Becepred等,都是将上述度量指标进行独立地分析,缺乏数理数值上的运算和评分,人工评判会严重影响预测结果的特异性。随着蛋白质结构数据库及表位肽数据的不断扩大,采用机器学习方法,Saha等[11]开发了基于神经网络法的ABCpred软件,通过Swiss-port和Bcipep数据库提取的结构属性作为训练集,最终预测的准确性和特异性均大大提高。
本论文中,作者采用了2种分析软件,并结合空间表位进行综合预测,三方面结果有较好的一致性。但是,除了 46-58区外,还存在一段序列,即98NDCKREWSDGTKL110,也可能是理想的抗原表位区。该肽段位于转角区,具有较高的抗原指数、亲水性和可塑性,更有意思的是该肽段与SEPPA预测的空间表位也具有同源区(SDGTK)(图6,第二行突出显示区),以上各参数表明98-110也是理想的抗原表位区。从二级结构特征看,该区域甚至比46-58区(螺旋区)更好。但是从蛇毒CLPs家族同源性分析,该肽段的序列同源性比46-58区差。考虑到实验最终目的是筛选蛇毒CLPs,因此优先考虑CLP家族中同源性更高的片段作为“共同抗原”,即46-58区,序列为KTWADAEKFCTEQ。由于蛇毒蛋白质结构数据较少,暂时没有采用ABCpred法对结果进行验证。
通过生物软件对蛋白质抗原表位进行预测,将合成的抗原表位肽与载体蛋白偶联,免疫制备相应的抗体已有多篇成功的报道。例如Hui(1983)用纤维蛋白β链氨基端的七肽(Gly-His-Arg-Pro-Leu-Asp-Lys)通过MBS与KLH(钥孔戚血蓝蛋白)偶联后,作为免疫原制备抗纤维蛋白单克隆抗体获得成功[12];我国雒喜忠等对视黄酸诱导蛋白(RAI)进行了抗原表位预测,得出RAI的44-55区为抗原表位区,合成相应肽段并与KLH偶联,制备得到了多克隆抗体[13];南文龙等[14]利用多种软件和方法,综合预测了H5N1亚型禽流感病毒血凝素Th和B细胞表位,取得了与实验一致的结果。本论文中,我们已经将合成的KTWADAEKFCTEQ13肽与KLH交联,与佐剂联合免疫得到了抗体血清。虽然血清与多肽没有沉淀线,但蛇毒及蛇毒CLP与血清均有很明显的沉淀,而且KLH-肽与血清的沉淀线要强于KLH与血清的沉淀线,说明免疫获得了成功,也证明本文预测的结果的准确性,但特异性还有待于进一步实验确定。
1 Huizinga EG,Tsuji S,Rornijn RA et al.Structureof glycoprotein Ibαand its complex with von willebrand factor A1 domain[J].Science,2002;297:1176-1179.
2 Li W F,Chen L,Li X M et al.A C-type lecin-like protein from Agkistrodon acutus venom binds to both platelet glycoprotein Ib and coagulation factor IX/factor X[J].Biochem Biophys Res Commun,2005;332(3):904-912.
3 Lu Q M,Navdaev A,Clemetson JM et al.Snakevenom C-typelectins interacting with platelet receptors,Structure-function relationshipsand effects on haemostasis[J].Toxin,2005;45(8):1089-1098.
4 Clemetson K J,Lu Q,Clemetson JM.Snake C-type lectin-like proteins and platelet receptors[J].Pathophysiol Haemost Thromb,2005;34(4-5):150-155.
5 万 涛,孙 涛,吴加金.蛋白质顺序性抗原决定簇的多参数综合预测[J].中国免疫学杂志,1997;13(6):329-333.
6 Arnold K,Bordoli L,Kopp J et al.The SWISS-MODEL Workspace:A web-based environment for protein structurehomology modeling[J].Bioinformatics,2006;22:195-201.
7 Sun J,W u D,Xu T L et al.SEPPA:a computational server for spatial epitope prediction of protein antigens[J].Nucleic Acids Research,2009;37:612-616.
8 Hoop J P,Wood K R.Prediction of p rotein antigenic determinants from amino acid sequence[J].Proc Natl Acad Sci USA,1981;78(6):3824-3828.
9 黄艳新,鲍永利,李玉新.抗原表位预测的免疫信息学方法研究进展[J].中国免疫学杂志,2008;24(10):758-762.
10 Davydov Y I,Tonevitsky A G.Prediction of linear B-cell epitopes[J].Molecular Biology,2009;43(1):166-174.
11 Saha S,Bhasin M,Raghava GP S.Bcipep:A database of B-cell epitopes[J].BMCGenomics,2005;6(1):79-85.
12 Hui K Y,Haber E,Matsueda G R et al.Monoclonal antibodiesto a synthetic fibrin-like protein bind to human fibrin but not fibrinogen[J].Science,1983;222:1129-1131.
13 雒喜忠,王 阁,许 文 et al.RAI16蛋白合成肽多克隆抗体的制备及初步应用[J].细胞与分子免疫学杂志,2008;24(9):898-901.
14 南文龙,金宁一,鲁会军 et al.H5N1亚型禽流感病毒血凝素Th和B细胞表位预测及抗原分析[J].中国免疫学杂志,2009;25(8):630-637.