粘膜佐剂LTB优化的抗淋病ltB-nspA融合基因疫苗鼻饲免疫效果研究①
2010-07-30胡四海戴志兵胡耀华张愉快余敏君南华大学病原生物学研究所衡阳421001
王 健 胡四海 戴志兵 胡耀华 张愉快 余敏君 (南华大学病原生物学研究所,衡阳421001)
淋病奈瑟菌俗称淋球菌,是引起淋病的病原菌,淋病是我国目前发病人数最多的性传播疾病,感染淋球菌还可增加HIV传播的危险性[1]。如何有效控制和预防淋病,成为全世界普遍关注的公共卫生问题,而研制出有效的疫苗,是预防和控制淋病的关键。Plante等[2]首先克隆了奈瑟氏淋球菌的表面蛋白A(Neisseria gonorrhoeae surface protein A,NspA)基因,发现NspA抗原不但能在淋球菌表面持续表达,而且高度保守、具有较强免疫原性,是一个颇具潜力的淋球菌疫苗候选抗原。大肠杆菌不耐热肠毒素B亚单位(Bsubunit of Escherichia coli heat-labile entero-toxin,LTB)是继霍乱弧菌肠毒素CTB之后发现的一种有效的粘膜佐剂,它去除了大肠杆菌不耐热肠毒素的毒性A亚单位,仍保留较好的粘膜佐剂活性[3]。抗淋病免疫主要靠体液免疫,尤其是粘膜免疫。为了研究具有较强粘膜保护能力的淋球菌疫苗,本课题组将 nspA和ltB基因融合,构建了pcDNA3.1(-)/ltB-nspA融合基因疫苗。本研究在此基础上将该融合基因疫苗通过鼻饲途径免疫雌性BALB/c小鼠,检测其所诱发的特异性体液免疫应答(尤其是粘膜免疫应答)和细胞免疫应答水平,为研制高效抗淋病基因疫苗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 菌株、载体、抗原及实验动物 E.coli JM109本室保存;pcDNA3.1(-)、pcDNA3.1(-)/ltB 、pcDNA3.1(-)/nspA、pcDNA3.1(-)/ltB-nspA载体(本课题组已成功转染真核细胞)由本室保存;重组蛋白NspA由南华大学病原生物学研究所本课题组提供;SPF级4~6周龄雌性BALB/c小鼠购自南华大学实验动物学部。
1.1.2 主要试剂 质粒小量提取试剂盒购自北京博大泰克生物工程有限公司;限制性内切酶(BamHⅠ、HindⅢ)购自大连宝生物工程公司。DNA ladder购自晶美生物工程公司;二抗:HRP标记的羊抗鼠IgG和HRP标记羊抗鼠sIgA分别购自Abcam和Sigma公司;IFN-γ含量测定试剂盒购自晶美生物公司;其他试剂为进口分装或国产分析纯。
1.2 方法
1.2.1 核酸疫苗的制备 将本室保存的真核质粒pcDNA3.1(-)/ltB-nspA、pcDNA3.1(-)/nspA、pcDNA3.1(-)/ltB 、pcDNA3.1(-)转化入 E.coli JM109,在氨苄抗性的LB平板上培养14~18小时后挑选菌落克隆扩增,提取质粒经PCR和BamHⅠ与HindⅢ双酶切鉴定,筛选阳性菌落。将转化成功并鉴定正确的重组克隆菌大量扩增培养,去内毒素质粒提取试剂盒大量提取真核质粒,核酸蛋白定量分析仪测定浓度后,无菌PBS调整核酸浓度为2 000μg/ml。
1.2.2 动物免疫 选取4~6周龄雌性BALB/c健康小鼠60只,随机分为5组,即:pcDNA3.1(-)/ltB-nspA、pcDNA3.1(-)/nspA为实验组;pcDNA3.1(-)/ltB、空质粒pcDNA3.1(-)和PBS空白组为对照组,每组均为12只。实验组接种pcDNA3.1(-)/ltB-nspA、pcDNA3.1(-)/nspA重组质粒,对照组接种pcDNA3.1(-)/ltB、pcDNA3.1(-)空质粒和无菌PBS,均接种40 μl。分别于初次免疫后的第2周、4周再免疫2次,共免疫3次,每只80μg/次。
1.2.3 免疫小鼠标本的收集 每次免疫前一天及末次免疫后2周收集小鼠生殖道灌洗液100μl;收集小鼠尾静脉血50~80μl分离血清,所有标本于-20℃保存;末次免疫后2周剖杀小鼠,无菌取小鼠脾脏,经200目尼龙纱布网滤过-制成单个细胞悬液备用。
1.2.4 小鼠生殖道粘膜特异性sIgA的检测 以纯化、复性的重组蛋白NspA为抗原包被ELISA板,以小鼠生殖道灌洗液标本作一抗,采用间接ELISA法检测sIgA的水平。将重组蛋白用pH 9.6的碳酸盐缓冲液稀释至 40.0μg/ml,每孔100μl包被 ELISA板,4℃过夜;用PBST洗涤 3次;用封闭液 4℃封闭12小时;PBST洗涤3次,5分钟/次。加各组小鼠生殖道贯洗液标本,100μl/孔,37℃温育2小时,PBST洗涤3次,5分钟/次;再加HRP标记的羊抗鼠sIgA 100μl/孔,37℃温箱中温育1小时,PBST洗涤3次,5分钟/次。最后加入新配置的TMB显色液显色并于酶标仪上读取各孔A450值。
1.2.5 小鼠血清中特异性IgG的检测 以纯化、复性的重组蛋白NspA为抗原包被ELISA板,以小鼠血清标本作为一抗,以HRP标记的羊抗鼠IgG为二抗,采用间接ELISA法检测血清IgG水平。其操作方法同上sIgA抗体的检测。
1.2.6 ELISA双抗体夹心法检测IFN-γ产生水平 将无菌收集的小鼠脾细胞加入5 ml 0.83%NH4Cl放置5分钟溶解红细胞,1 000 r/min离心5分钟收集淋巴细胞,用含10%小牛血清的RPMI1640培养基重悬细胞。台酚蓝染色,调整活细胞数为 6×106ml-1,接种于24孔板中,1 ml/孔;每组的每个培养孔加入特异性抗原NspA 10μg,培养板置37℃5%CO2的培养箱中培养72小时后离心取上清备用;采用双抗体夹心法检测IFN-γ含量,具体操作按试剂盒说明书进行。
1.2.7 MTT比色法检测淋巴细胞的增殖 将无菌收集的小鼠脾细胞加入5 ml 0.83%NH4Cl放置5分钟溶解红细胞1 000 r/min离心5分钟收集淋巴细胞,用含10%小牛血清的RPMI1640培养基重悬细胞。台酚蓝染色,调整细胞浓度为1×106ml-1,加入96孔板,每孔200μl;每只小鼠脾淋巴细胞分成两组,特异性抗原NspA刺激组,无刺激的阴性对照组,其中每组重复4孔。NspA刺激组每孔加入 2 μg,混匀后,置37℃、5%CO2培养 72 小时 。于终止培养前4小时每孔加入5 mg/ml的MTT 20μl,继续培养4小时后弃上清,每孔加入二甲基亚砜(DMSO)150μl,震荡溶解15分钟,570 nm波长测定各孔的A570值。刺激指数(SI)=实验组 A570值/空白对照组 A570值。并用刺激指数来评价小鼠脾淋巴细胞的增殖程度。
1.3 统计学处理 运用SPSS16.0软件进行分析。抗体水平、脾细胞刺激指数及细胞因子水平以±s表示,组间均数的比较采用方差分析,以 P<0.05表示差异有统计学意义。
2 结果
2.1 真核重组质粒的鉴定 重组质粒pcDNA3.1(-)/ltB 、pcDNA3.1(-)/nspA、pcDNA3.1(-)/ltB-nspA经PCR和双酶切鉴定,1.0%琼脂糖凝胶电泳,均能得到目的条带,大小分别约为ltB(372 bp)、nspA(525 bp)和 ltB-nspA(900 bp),见图1。
2.2 小鼠生殖道粘膜NspA特异性sIgA抗体水平的检测 以重组蛋白NspA作检测用抗原包被ELISA板,间接ELISA法对各免疫组小鼠每次免疫前一天和末次免疫后2周收集的小鼠生殖道灌洗液行sIgA检测,结果显示:在不同时间的免疫中,第4周、6周pcDNA3.1(-)/ltB-nspA融合基因组小鼠生殖道粘膜sIgA水平(A450:0.296±0.045、0.316±0.048)和pcDNA3.1(-)/nspA 单基因组生殖道粘膜sIgA水平(A450:0.224±0.038、0.249±0.040)均明显高于 pcDNA3.1(-)/ltB 、pcDNA3.1(-)、PBS组(P <0.01);此外,第4周、6周 pcDNA3.1(-)/ltB-nspA融合基因组小鼠生殖道粘膜sIgA水平明显高于pcDNA3.1(-)/nspA单基因组(P<0.05),见图2。
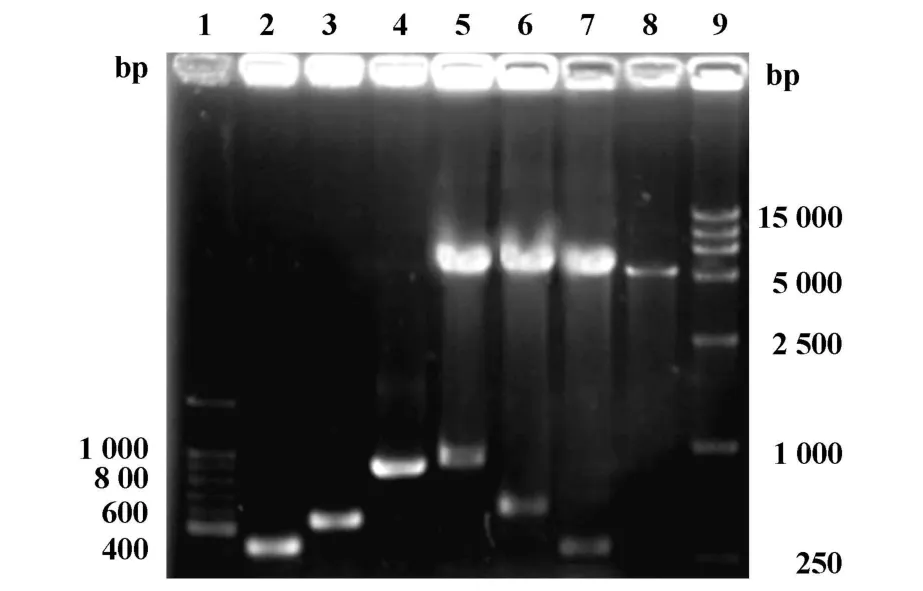
图1 真核重组载体经 PCR和 BamHⅠ、HindⅢ双酶切鉴定图谱(1.0%琼脂糖凝胶电泳)Fig.1 Profile of PCR products and digested products by BamHⅠ,HindⅢ of eukaryotic recombinants(1.0%agerose gel electrophoresis)
2.3 小鼠血清NspA特异性IgG抗体的检测 以重组蛋白NspA作检测用抗原包被 ELISA板,间接ELISA法对各免疫组小鼠每次免疫前一天和末次免疫后2周收集的小鼠血清行IgG检测,结果显示:在不同时间的免疫中,第4周、6周 pcDNA3.1(-)/ltB-nspA融合基因组小鼠血清IgG水平(A450:0.521±0.029、0.643±0.156)和pcDNA3.1(-)/nspA 单基因组血清IgG水平(A450:0.500±0.036、0.595±0.142)均明显高于pcDNA3.1(-)/ltB 、pcDNA3.1(-)、PBS组(P<0.01);但pcDNA3.1(-)/ltB-nspA融合基因组与pcDNA3.1(-)/nspA单基因组小鼠血清中IgG水平差异不显著(P>0.05),见图3。
2.4 脾淋巴细胞培养上清IFN-γ水平的检测 按照说明书建立IFN-γ检测的标准方程、绘制标准曲线。检测结果显示pcDNA3.1(-)/nspA和pcDNA3.1(-)/ltB-nspA免疫组小鼠脾淋巴细胞培养上清中IFN-γ的水平明显高于 pcDNA3.1(-)/ltB、空质粒 pcDNA3.1(-)和PBS对照组(P<0.01);但 pcDNA3.1(-)/nspA和pcDNA3.1(-)/ltB-nspA两组间IFN-γ的水平无显著性差异(P>0.05),见表1。

图2 小鼠生殖道抗NspA特异性sIgA抗体水平Fig.2 sIgA levels of NspA in different intranasally immunized groups
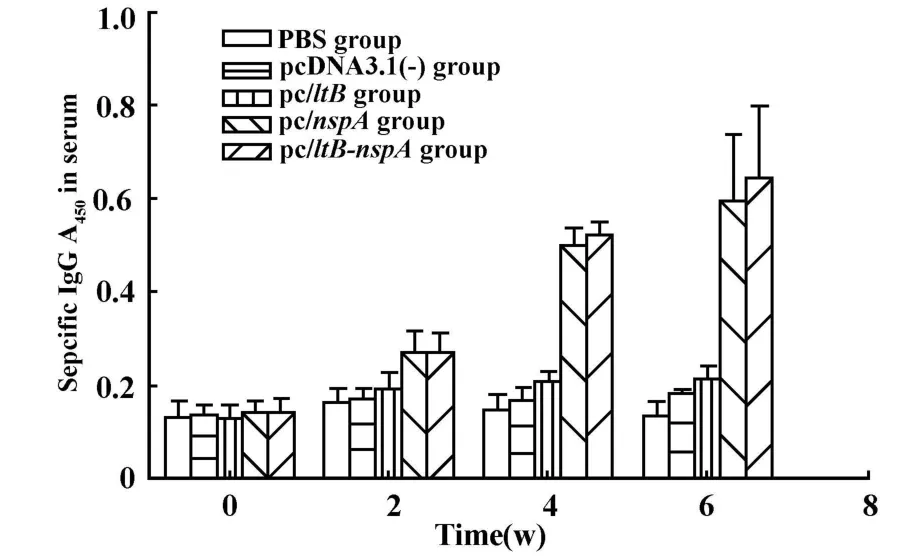
图3 小鼠生殖道抗NspA特异性IgG抗体水平Fig.3 IgG levels of NspA in different intranasally immunized groups

表1 免疫小鼠脾淋巴细胞刺激指数(SI)及培养上清IFN-γ含量(pg/ml)Tab.1 Stimulation index,IFN-γ(pg/ml)in cultured supernatant of splenic lymphocyte from immunized mice
2.5 MTT比色法检测脾淋巴细胞的增殖反应 用特异性抗原NspA刺激后,pcDNA3.1(-)/nspA和pcDNA3.1(-)/ltB-nspA免疫组小鼠的脾淋巴细胞刺激指数明显高于 pcDNA3.1(-)/ltB、空质粒 pcDNA3.1(-)和PBS对照组(P<0.01),但pcDNA3.1(-)/nspA和pcDNA3.1(-)/ltB-nspA两组间差异不显著(P>0.05),见表1。
3 讨论
核酸疫苗是将编码某种抗原蛋白的外源基因直接导入动物体内,并通过宿主细胞的表达系统合成抗原蛋白,刺激机体产生细胞免疫和体液免疫应答,对病原体和肿瘤等产生免疫力的基因疫苗。基因疫苗在体内的抗原表达和递呈过程与病原体的自然感染相似,能直接递呈并启动机体免疫系统,诱导机体产生体液免疫及细胞免疫应答。作为第三代疫苗,与第一代疫苗(减毒、灭活疫苗)及第二代疫苗(亚单位疫苗)相比,因其高效 、持久、广谱、简便、廉价、无致病性等优势而得到广泛的研究和应用[4,5]。
淋球菌NspA是淋球菌最具特征的外膜蛋白,不但能在淋球菌表面持续表达,而且高度保守、具有较强免疫原性,是一个颇具潜力的淋球菌疫苗候选抗原。大肠杆菌不耐热肠毒素B亚单位(LTB)是大肠杆菌不耐热肠毒素(Escherichia coli heat-labile enterotoxin,LT)分子的非毒性结合亚单位,能与大多数细胞(包括上皮细胞、白细胞)表面的GM1神经节苷酯结合,将其与目的抗原混合或偶联于目的抗原,通过粘膜免疫途径免疫动物,可以广泛激活粘膜免疫系统,在粘膜表面产生高效价的特异性的sIgA抗体,而且在血循环中产生高效价的IgG抗体,同时也可诱发细胞免疫应答,是目前所知最有效的粘膜佐剂之一[6]。抗淋病免疫主要靠体液免疫,尤其是粘膜免疫,诱导高效的粘膜免疫应答,产生粘膜保护力是评价淋球菌疫苗效果的最重要的指标。实验证明,粘膜途径免疫不仅能有效的诱发粘膜免疫,同时又可诱发系统免疫应答[7,8]。以 LTB作为粘膜佐剂,促进疫苗抗原产生有效的粘膜免疫应答,是研制经粘膜感染病原体疫苗的策略之一。
此外,选择合适的免疫途径也十分重要。Zhu等[9]用淋球菌外膜囊泡抗原通过鼻粘膜途径免疫BALB/c小鼠,发现可在小鼠生殖道灌洗液中检测到较高水平的特异性sIgA,血清及生殖道灌洗液中均可检测到特异性IgG。由此可见,疫苗抗原经粘膜途径免疫能有效诱导粘膜免疫应答。常用的粘膜免疫方法主要包括胃肠道、鼻腔、生殖道等。鼻腔免疫因避免了胃肠道酸性环境及酶对抗原的破坏、操作简便易行而被广泛采用。
本研究采用本课题组构建的淋球菌NspA与大肠杆菌LTB融合基因疫苗,经粘膜途径(鼻饲)免疫雌性BALB/c小鼠,探讨粘膜佐剂优化的核酸疫苗诱导的体液免疫及细胞免疫水平,尤其是粘膜sIgA水平。结果显示:ltB-nspA融合基因组及nspA单基因组小鼠生殖道局部sIgA及血清IgG水平均明显高于pcDNA3.1(-)/ltB、空质粒pcDNA3.1(-)和 PBS对照组(P<0.01),表明经粘膜途径免疫后基因疫苗诱导产生了较高水平的体液免疫应答;ltB-nspA融合基因组sIgA水平明显高于nspA单基因组(P<0.05),表明粘膜佐剂LTB能辅佐NspA诱导小鼠产生更强的粘膜免疫应答,与戴志兵等[10]LTB优化的抗淋病LTB-PorB重组蛋白的免疫活性的研究结果基本一致,这对有效阻断淋球菌对粘膜上皮细胞的粘附,从而阻断其进一步对宿主细胞的感染具有重要意义。小鼠脾淋巴细胞经重组抗原NspA刺激后,基因疫苗pcDNA3.1(-)/ltB-nspA组和pcDNA3/1(-)/nspA组的脾淋巴细胞刺激指数和培养上清中IFN-γ含量均明显高于 pcDNA3.1(-)/ltB、空质粒pcDNA3.1(-)和PBS对照组(P<0.01),表明核酸疫苗经粘膜免疫小鼠后,也能诱导小鼠产生较强的特异性细胞免疫。
上述研究结果表明,基因疫苗pcDNA3.1(-)/nspA和pcDNA3.1(-)/ltB-nspA均能诱导较高水平的体液免疫及细胞免疫应答,尤其是 ltB-nspA融合基因组较nspA单基因组诱导产生了更高水平的粘膜特异性sIgA,证实粘膜佐剂LTB能有效辅佐NspA在小鼠生殖道粘膜诱导产生更高水平的粘膜免疫,为进一步研究高效抗淋病基因疫苗提供了部分实验依据。
1 Unemo M,Palmer H M,Blackmore T et al.Global transmission of pro-lyliminopeptidase-negative Neisseria gonorrhoeae strains:implications for changes in diagnostic strategies[J].Sex Transm Infect,2007;83(1):47-51.
2 Plante M,Cadieux N,Rioux CR et al.Antigenie and molecular consevvationof the gonococcal NspA protein[J].Infect Immun,1999;67(6):2855-2861.
3 Pizza M,Giuliani M M,Fontana M R et al.Mucosal vaccines:nontoxic derivativesof LT and CT as mucosal adjuvants[J].Vaccine,2001;19:2534-2541.
4 Ledgerwood JE,Graham B S.DNA vaccines:a safe and efficient platform technology for responding to emerging infectious diseases[J].Hum Vaccin,2009;5(9):623-626.
5 吴庭才,张春杰.核酸疫苗的特点、组成及在动物免疫中的应用[J].生物学通报,2009;44(5):5-7.
6 Walmsley A M,Alvarez M L,Jin Y et al.Expression of the B subunit of Escherichia coli heat-labile enterotoxin as a fusion protein in transgenic tomato[J].Plant Cell Rep,2003;21(10):1020-1026.
7 Wang D,Christopher M E,Nagata LP et al.Intranasal immunization with liposome-encapsulated plasmid DNA encoding influenza virus hemagglutinin elicits mucosal-cellular and humoral immune response[J].J Clin Virol,2004;31(Suppl 1):S99-S106.
8 Vaidv M,Hagan D T.Microparticles for intranasal immunization[J].Adv Drug Delw Rev,2001;51(1-3):127-135.
9 Zhu W,Thomas C E,Chen CJ et al.Comparison of immune responses to gonococcal PorB delivered as outer membrane vesicles,recombinant protein,or Venezuelan equine encephalitis virus replicon particles[J].Infection and Immunity,2005;73(11):7558-7568.
10 戴志兵,胡四海,陈 敏 et al.淋球菌porB和大肠杆菌ltB融合基因的构建、表达及其免疫活性[J].微生物学报,2010;50(4):517-523.