药物生物转化研究方法简述
2010-07-30刘伟卿
刘伟卿 周 静
药物生物转化是指药物在体内经历的化学结构的变化过程。大部分药物经生物转化后药理活性降低甚至消失,最终随尿和粪便排除体外,但也有一些药物通过生物转化后药理活性增强或毒性增加。因此,药物生物转化不仅影响药物作用的强弱和持续时间的长短,而且还会影响药物治疗的安全性,具有重要的现实意义。对于创新药物,需了解其在体内的生物转化情况。通过药物生物转化研究,发现并确定产生药理作用的物质基础,掌握药物生物转化规律,对于设计更合理的给药途径、给药方法、给药剂量,以及对制剂处方的设计、工艺改革和临床都具有指导意义。
药物生物转化的主要部位在肝脏,肝外生物转化场所有:消化道、肺、皮肤、脑、鼻黏膜、肾脏等,也可被肠内细菌转化。肝脏外器官的生物转化活性比肝脏要低得多,所以至今为止对药物生物转化的研究大多以肝脏为主。
1 传统体内方法
传统体内方法是指在动物或人服药过后,经过一段时间后收集血液、尿液和胆汁等生物样品(动物还可以获得组织器官等实验样本)。然后用溶剂提取或采取柱色谱或薄层制备,有的经HPLC制备得到较纯品,再对原药及生物转化产物进行紫外、红外、质谱、磁共振等光谱分析,推断生物转化产物的结构,并用化学方法合成生物转化产物的对照品,进一步验证其结构。常用的动物有小鼠、大鼠、家兔和豚鼠等。
该方法可以综合地考虑各种体内因素对药物的影响,能够真实全面地反映药物生物转化的体内整体特征。车庆明等[1]从口服黄芩苷的人尿液中,发现并鉴定了3个主要生物转化产物的化学结构,并确定了黄芩苷元是主要药物生物转化产物的中间体,他们在体内共存,构成黄芩苷的药效物质基础。
本法的缺点是难度比较大,许多药物在生物体内的分布都比较广,加上生物转化的器官和酶系的多样性,使药物及其生物转化产物在体内的浓度都比较低,检测具有一定的难度。但是,现代分析技术的进步和分析仪器灵敏度的提高将弥补传统体内方法的不足,充分体现此方法的优越性。近年来不断发展成熟的色谱-光谱联用技术使得色谱分离和光谱鉴定成为一个连续的过程,它集色谱的高效分离与光谱的强鉴定能力于一体,分析快速方便,具有其他药物生物转化产物检测及结构分析方法所不可比拟的优点。丁黎等[2]人通过收集给药后大鼠胆汁,以液相/二级管阵列检测器/质谱检测器联用(LC/DAD/MSD)技术为基础,确定了盐酸非洛普的Ⅱ相生物转化产物。
2 微透析取样研究法[3,4]
微透析取样研究法是20世纪60年代中期发展起来的在体药物生物转化研究方法,此后的20年间进展不大,到80年代中期才有了长足的发展。微透析取样法最初主要用于研究脑内神经递质的释放。
微透析取样装置主要由微透析探针和微量取样泵组成。长4~10mm的再生纤维透析膜固定在一根微径导液管上构成探针,外径一般300μm左右,取样窗口4~10mm;透析膜前有保护头,可除去相对分子质量>50×103的分子。其原理如下:微型泵将灌注液泵入探针,灌注液与细胞外液组成完全一致时,透析膜不再发生水和离子交换,只有小分子物质按浓度剃度原理进、出探针所埋入的生理环境。进入膜内腔的位灌注液,透出膜内腔的为透析液。
微透析取样研究法可在清醒、自由活动状态下的动物体内多个器官以及同一器官多个位点连续取样的实时在线分析;可连续跟踪体内多种化合物随时间的变化;取样无需匀浆过程,可真实代表取样点化合物的浓度,且样品因不含蛋白质、酶等大分子物质,可不经预处理直接用于测定;用于研究药物生物转化,可维持实际生理条件,消除了传统药物生物转化研究中因组织均匀化破坏细胞隔室造成对生物转化研究结果的影响,并可获得有关药物生物转化中间过程的信息,而传统方法只能了解药物的最终产物,不能反映其中间过程。此外,微透析取样研究法还具有能埋入动物体液或组织中、对周围环境损伤很小的特点。由于取样少,不会造成小动物失血过多而死亡,因此实验可以在同一动物身上进行,从而避免了个体差异对试验结论准确性的影响。
随着各种类型微透析探针出现和商品化,以及微量快速、灵敏的分析检测手段的不断完善,微透析取样技术结合色谱分析已成为药物生物转化研究的强有力手段。
3 药物肝脏生物转化研究法
肝脏含有大部分的生物转化活性酶,而且具有很高的血流量,是药物生物转化最重要的器官。目前,肝脏生物转化的体外研究方法中有肝微粒体法、肝细胞体外温孵法、肝脏灌流技术、肝组织切片法、基因组P-450酶系、微透析技术等。
3.1 肝微粒体法[3]
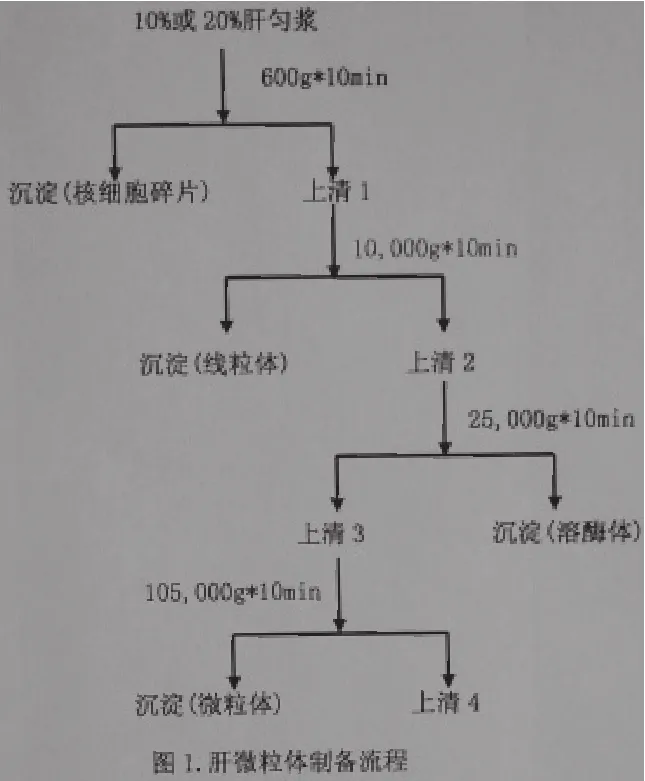
肝微粒体法有在体和离体两种方法。前者多首先用腹腔注射苯巴比妥钠来诱导肝细胞色素P-450后再给予动物待研究药物,通过测定原型药物和其生物转化产物在正常动物和给药动物血清和组织中的分布来研究药物,通过测定原型药物和其生物转化产物在正常动物和给药动物血清和组织中的分布来研究药物生物转化。后者是由制备的肝微粒体辅以氧化还原型辅酶,在模拟生理温度及生理环境条件下进行生化反应的体系。此法制备简单,生物转化时间短,易于重现,方便大量操作以积累生物转化样品供结构研究;同时,该方法可用于对药酶的抑制及体外生物转化清除等方面的研究,因而应用较为普及。目前利用此法研究确定了抗焦虑新药[5]AF-5的两个主要生物转化产物;结合整体动物实验,还基本阐明一叶 碱[6]在大鼠体内生物转化的途径。广泛应用的肝微粒体制备流程[3]如图1所示。
3.2 肝细胞体外温孵法
肝细胞体外温孵法同肝微粒体法相似,即以制备的肝细胞辅以氧化还原型辅酶,在模拟生理温度及生理环境条件下进行生化反应的体系,适于研究蛋白及mRNA水平药物代谢酶诱导及酶活性,在评估药物生物转化过程中药物间的相互作用时,该方法得到广泛的应用。但肝细胞制备技术较复杂,目前以胶原酶灌注技术为主[7],且体外肝细胞活性仅能维持4h,不利于储存和反复使用。
3.3 离体肝灌流法
离体肝灌流法与肝微粒体法、肝细胞体外温孵法相比,一方面保留着完整细胞的天然屏障和营养液的供给,因而能在一段时间内保持肝脏的正常生理活性和生化功能;另一方面,具有离体系统的优点,能够排除其他器官组织的干扰,可控制受试物质的浓度,定量地观察受试物质对肝脏的作用。
Alexandra等[8]利用离体大鼠肝脏一过式灌流方法研究一种新的抗癌药BR(苯甲酰胺核糖核苷)的体外代谢,分别以Wistar大鼠与TR2大鼠进行实验,灌流过程中每隔5rnin取样1次,监测BR及其代谢物,结果表明,Wistar大鼠灌流液中只有BR及其去氨基产物BR-COOH通过色谱检测出来,而BAD(苯甲酰胺腺嘌呤双核苷酸)未检出TR2大鼠,灌流液的检测结果与Wistar大鼠几乎相同,但在BR与BR-COOH的检出量上,TR2大鼠组低于Wistar大鼠组18%~23%。同时,应用Wistar大鼠分离肝细胞,对不同浓度的BR(0~3mmol/L)进行了温孵实验,通过检测,BAD仍然无法检出。通过对BR的离体肝灌流与肝细胞体外温孵实验结果比较,均发现BAD低于检测限,未检出,这说明BAD这种活性的代谢产物在大鼠肝脏中代谢率很低,BR-COOH为其主要的代谢途径,故可推测,BR在人体的癌症治疗中,主要代谢生成为BR-COOH。当前,离体肝灌流亦应用于对药物的药动学参数进行考察。Christian等[9]运用该方法考察了药物CPT~11在胆汁中的排泄、清除速率及AUC等药动学参数,取得了较好的结果。离体肝灌流法具有器官水平的优势,兼备体外实验和整体动物实验的优点,更适于定量研究药物体外代谢行为和特点,并能解决在其他的体外肝代谢模型和整体动物实验中不能得到满意解决的难点,在药理学和毒理学的研究中已受到广泛的重视,但其对实验设备及技术有一定的要求,一定程度上限制了其应用。
3.4 肝组织切片法
该方法的优点在于可以保留所有的肝药酶及细胞器的活性,对于某些药物生物转化研究来说,有时采用肝组织切片技术比肝微粒体孵育更好.但由于该技术需要切片机等特殊的设备,因此近年来已经很少被采用。Harris用肝切片技术研究了紫杉醇的生物转化,得到了3个产物,且与紫杉醇的肝微粒生物转化产物相同,说明了这一技术在药物生物转化研究上的可行性。
3.5 体外纯化酶系统模拟法
由于肝脏中药物生物转化主要是由P-450酶系统催化反应的,故可以通过纯化的P-450同工酶、P-450混合酶来模拟体内肝脏中酶系统,与药物底物温孵培养,来进行药物生物转化研究。
4 药物胃肠道生物转化研究[3]
胃肠道是口服药物的必经通道,近来随着人类对肠道菌不断认识,胃肠道作为药物生物转化的重要部位越来越引起研究者的重视。药物在胃肠道各种酶的作用下可发生生物转化,酶主要包括两部分,一部分是消化道上皮细胞中产生的酶,主要是一些结合酶,另一部分就是消化道菌从产生的酶,主要以分解或还原反应为主,其种类比肝脏还多。胃肠道的不同部位具有不同的菌群众特点,如消化道下部主要是厌氧菌,因而也就有不同生物转化特征。
与肝脏相比,肠内菌群在药物生物转化的类型及功能上均有其独特之处。肝脏对药物兼有分解与合成的功能,多数药物经肝脏生物转化后相对分子质量增大,极性增强而易于从体内排除,主要表现为解毒作用;肠内菌群则几乎全为分解反应使药物相对分子质量减小,极性减弱,脂溶性增强,往往伴有药效及毒性作用的增强。从某种意义上说,肠内菌群对药物的生物转化可视为肝脏的补充或对抗。
4.1 药物的胃液生物转化研究[3]
在正常饲养条件下饲喂大鼠,绝食过夜,在厌氧条件下按35mg/mL剂量腹腔注射苯巴比妥钠进行麻醉。再开腹、取胃。将胃内容物全部洗出,黏附在胃壁上的内容物用生理盐水洗下,与胃内容物合并,放入温孵培养管内,用厌氧稀释液定容,37℃预温卵培养一段时间(一般为30min)。然后再加入一定浓度的待研究转化药物,再在37℃培养一段时间或定时取样分析。此法适合研究胃内酶类的药物结构转化。
4.2 药物的肠液生物转化研究[3]
在厌氧条件下按上述方法(胃液的生生转化研究)处理大鼠或小鼠,取出肠液,用厌氧稀释液稀释后在厌氧培养基内厌氧预温孵培养一段时间(一般为30min)。然后再加入一定浓度的待研究转化药物,再在37℃培养一段时间或定时取样分析。此法适合研究肠内细菌的药物生物转化,适合大规模制备转化产物。对研究多细菌或混僵细菌或肠内菌丛的药物转化尤为合适。
4.3 肠内菌生物转化研究方法
4.3.1 全粪便温孵法
该法目前应用最广泛的胃肠道生物转化研究方法,由于肠道内需氧菌只占肠道菌丛的极少部分,其绝大多数的厌氧菌是药物生物转化的主要角色,因此,粪便温孵法主要就是制造适合厌氧菌生长的厌氧环境和营养条件,在此条件下,加入药物与细菌混合、温孵,然后检测药物原型成分和生物转化产物的种类和数量。使便出的厌氧菌存活下来的简单而实用的方法[3]是:取一塑料袋,充满二氧化碳气(置换掉氧气)。挤压出来后,再次充满二氧化碳气,反复数次,尽量将空气排尽。然后装入粪便(由于粪便部分不同,菌丛亦不同,因此要使用全便)。用手挤压使之均质化。取均质化的粪便2g,加入19mL厌氧菌稀释液,培养,作为粪便菌液。
4.3.2 单一菌种温孵法[3]
即用单一菌种与药物共同进行厌氧培养,然后检查药物生物转化情况的方法。目前,公认的、有代表性的肠道菌有20多种,利用它们与药物一同进行温孵,结果发现不如肠道混僵菌降解药物明显,但利用单一菌种降解药物的条件易于控制,有利于有用的药物生物转化产物的工程化生产以及新的菌种的发现。
4.3.3 简单的大肠菌丛培养法
此法操作同简单的结肠菌群培养研究法,只是操作对象是大肠内容物而已。
4.3.4 肠菌酶法
肠菌酶法即把由肠菌中分得的酶作用于药物,间接地研究肠道菌对药物作用的方法。
4.3.5 结肠菌丛研究法[3]
4.3.5.1 简单的结肠菌群培养研究法
在正常饲养条件下饲喂大鼠,绝食过夜。在厌氧条件下按35mg/mL剂量腹腔注射苯巴比妥钠进行麻醉。再开腹、取结肠。将结肠内容物全部洗出,黏附在结肠壁上的内容物用厌氧菌稀释液洗下,与结肠内容物合并,放入温孵培养管内,用厌氧稀释液定容,37℃温孵培养一段时间或定时取样分析。
此法的结肠菌所致的药物转化接近于真实情况,在中药成分的肠内细菌代谢或生物转化研究中被广泛应用。
4.3.5.2 人结肠菌群体外模型法
现已建立不受宿主影响、适合研究微生物相互作用、细菌对药物转化活性的厌氧性连续培养系统。该系统的细菌菌丛在主要菌种、菌种多样性等方面与接种粪便菌丛类似。但目前关于此方法的报道较少,体外模型法虽具有可控性等特点,但在研究哺乳动物及微生物等的酶所致外来化合物活化、毒性和药效方面却明显不足。
4.3.5.3 人结肠菌丛在体模型法/无菌动物法
即取人粪便20%悬浮液1mL(相当于细菌数为5×1010)给予健康成年无菌动物(一般采用大鼠),饲养在无菌隔离器内。研究表明,人结肠菌丛酶的活性与定植在无菌大鼠的人肠内菌丛酶的活性基本没有区别。因此,此实验系统是一个相当好的模型。口服或静脉给予的药物经肝肠循环进入肠道内的药物都有可能被肠内细菌所转化,从而在动物组织或整个动物内分泌中发现的生物转化产物实际上是药物的肠内细菌转化产物。因此,利用无菌动物研究药物的肠内细菌生物转化具有重要意义。
此外,将口服药物给予无菌动物,然后测定动物组织或血中的药物含量或生物转化产物,可排除药物经肠内细菌生物转化的可能(对照组动物应该是同种类的普通动物)。与同种类的悉生动物配合应用可判断肠内细菌转化药物的种属特异性或生物转化的连锁性。如儿茶酚类化合物由肠内菌生物转化是利用悉生动物得到证明的[3]。给普通大鼠服用多巴胺,尿中有3-对羟基苯乙酸和酷胺排出,在无菌大鼠尿内未发现这两种物质。这一结果与给予患者服用L-多巴后在服用新霉素导致3-1对差基苯乙酸和酷胺在尿中排出降低的结果是一致的。柴胡皂苷-b1是中药柴胡主要的抗炎有效成分之一,它的药物作用机制是通过无菌动物、悉生动物、普通动物联合应用揭示的。
[1]车庆明,黄新立,李艳梅,等.黄芩苷的药物代谢产物研究[J].中国中药杂志,2001,26(11):768.
[2]丁黎,张正行,倪沛洲,等.LC/DAD/MSD技术研究大鼠胆汁中盐酸非洛普的II相代谢产物[J].药学学报,2001,36(6):40.
[3]杨秀伟,王多佳.中药成分代谢分析[M].北京:中国医药科技出版社,2003:160.
[4]余自成,陈红专.微透析技术在药物代谢和药代动力学研究中的应用[J].中国临床药理学杂志,2001,17(1):76.
[5]张金兰,刘颖,周同惠.微透析取样技术在药物代谢研究中的应用及前景[J].药学学报,2001,36(7):528.
[6]李晓海,张金兰,周同惠.左旋一叶 碱的代谢转化[J].药学学报,2002,37(4):288.
[7]王楠.缺血后处理对大鼠移植肝脏缺血再灌注损伤和细胞凋亡的保护作用[J].中国药理学,2005,10(2):26-27.
[8]Alexandra S,Birgit H.Metabolism and disposition of the novel antileukaemic drug,benzamide riboside,in the isolated per fused rat liver[J].Life Sci,2001,69(21):2489-2502.
[9]Christian F,Marie-Christine H,Pierre G.Hepatic extraction,meta bolism,and biliary excretion of irinotecan in the isolated Per fused rat liver[J].J Pharmaceu Sci,2001,90(6):722.
