复方甘草酸苷片的质量标准研究
2010-07-30陈传莹
陈传莹 单 亮 李 强
复方甘草酸苷片(商品名:美能)是由甘草酸单铵盐、甘氨酸、DL-蛋氨酸组成的复方制剂,于1948年在日本上市,现主要用于治疗慢性肝病,改善肝功能异常[1],疗效确切,临床应用多年。从传统中药材甘草中可提取得到甘草酸,再经成盐可制备得甘草酸单铵盐,长期以来被广泛应用于医药、食品和化妆品等领域,对其临床以及其他用途的安全性检验已获得FDA的认可[2],国家标准中规定甘草酸单铵盐的含量为73.0%。为保证本制剂批间质量的一致性和安全性,进行质量标准考察实验。
1 仪器与试药
1.1 仪器
岛津(泵LC-10AT;检测器SPD-10A)HPLC,浙大N-2000色谱工作站;色谱柱:Kromasil 100A C18柱,规格250mm×4.6mm(Dikma公司生产);ZRS-8G智能溶出试验议(天津大学无线电厂)。
1.2 供试样品
复方甘草酸苷片(规格:甘草酸单铵25mg、甘氨酸25mg、蛋氨酸25mg;批号:20041215、20041219、20041223)。
1.3 对照品
甘草酸单铵(批号:20040811,由甘草酸单铵原料精制而成,含量为99.05%,有关物质为0.57%)。
1.4 复方甘草酸苷片上市样品
复方甘草酸苷片(规格:甘草酸单铵25mg、甘氨酸25mg、蛋氨酸25mg;进口药品注册证号:H20030184;生产批号:2004018;生产单位:日本美能发源制药公司(Minophagen Pharmaceutical Co.,Ltd)。
2 含量测定
2.1 甘草酸苷
2.1.1 色谱条件
色谱柱:Kromasil 100A C18柱,规格250mm×4.6mm(Dikma公司生产);以2%的醋酸-乙腈=65∶35为流动相;检测波长为254nm;流速:1.0mL/min;进样量20μL[3,4]。
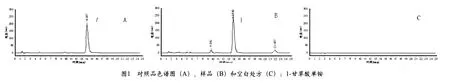
2.1.2 测定方法
取本品20片,研细,精密称取适量(约相当于甘草酸苷25mg),置50mL量瓶中,加水溶解后并稀释至刻度,摇匀,放置30min后,滤过,取续滤液作为供试品溶液;另取经105℃干燥至恒重的甘草酸单铵对照品(以甘草酸苷计)适量,精密称定,同法制成每1mL中约含500μg的溶液作为对照品溶液,精密量取上述两种溶液各20μL,注入液相色谱仪,记录色谱图及峰面积,按外标法以峰面积计算即得,色谱图见图1。
2.1.3 标准曲线
取甘草酸单铵对照品以甘草酸苷计适量,用水制成每1mL中各含80、160、320、480、800μg的溶液,分别量取20μL,注入液相色谱仪,记录色谱图,以进样浓度(C)为横坐标,甘草酸单铵峰峰面积(S)为纵坐标,计算直线回归方程,绘制标准曲线。结果表明,在76.8~796.2μg/mL范围内,线性关系符合要求。
2.1.4 溶液稳定性试验
照含量测定项下方法配制供试品溶液,于室温下自然放置,分别于0、2、4、8、12h进样,测定甘草酸苷峰面积,计算日内溶液的稳定性。RSD为0.9%,供试品溶液在12h内基本稳定。
2.1.5 重现性试验
取同一批号样品,分别称取适量(约相当于甘草酸苷25mg)5份,精密称定,置50mL量瓶中,加水溶解并稀释至刻度,摇匀,滤过,续滤液作为供试品溶液,照含量测定项下的方法测定。RSD为2.30%,本法的重现性符合要求。
2.1.6 加样回收率
按处方量的80%、100%、120%称取甘草酸单铵(以甘草酸苷计)对照品各两份,精密称定,分置100mL量瓶中,并同时称取处方量的空白辅料分置量瓶中,加水溶解并稀释至刻度,摇匀,滤过,取续滤液作为供试品。另精密称取甘草酸单铵对照品(以甘草酸苷计)适量,同法溶解并稀释成每1mL中约含500μg的溶液作为对照品溶液。照含量测定方法测定,按外标法以峰面积计算回收率[5]。结果平均回收率为98.74%,RSD为0.9%,符合要求。
2.1.7 三批样品及上市样品含量测定
取本品及上市样品各20片,除去包衣后,精密称定,研细,精密称取适量(约相当于甘草酸苷25mg),置100mL量瓶中,加水适量,振摇使溶解,并加水稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;另取经105℃干燥至恒重的甘草酸单铵对照品(以甘草酸苷计)适量,精密称定,同法制成每1mL中约含500μg的溶液作为对照品溶液,分别量取供试品溶液与对照品溶液各20μL注入液相色谱仪,记录色谱图,按外标法以峰面积计算,即得[6]。本品3批复方甘草酸苷片及市售复方甘草酸苷片的含量测定,结果见表1。

表1 含量测定结果
参照以上结果,将复方甘草酸苷片的含量限度订为”本品含甘草酸苷(C42H62O16)应为标示量的90.0%~110.0%”。
2.2 蛋氨酸
2.2.1 测定法
取本品20片,精密称定,研细,精密称取适量(约相当于蛋氨酸25mg),置250mL碘瓶中,加水25mL使溶解,再加碘化钾4g,磷酸盐缓冲液(磷酸氢二钾61g,磷酸二氢钾20.4g,加水溶解并稀释至500mL,pH=7.0)5mL,精密加入碘滴定液(0.1mol/L)5mL,密塞,摇匀,在暗处放置30min,用硫代硫酸钠滴定液(0.1mol/L)滴定,至近终点时,加淀粉指示液,继续滴定至蓝色消失,并将滴定液的结果用空白试验校正。每1mL的硫代硫酸钠滴定液(0.1mol/L)相当于7.461mg的C5H11NO2S 。
2.2.2 重现性试验
精密称取本品适量(约相当于蛋氨酸25mg)6份,分别置100mL量瓶中,照含量测定方法测定含量。RSD为0.50%,重现性符合要求。
2.2.3 回收率
取蛋氨酸约20、25、30mg各两份,精密称定,同时称取处方量除蛋氨酸外其他成分,分置100mL量瓶中,照含量测定方法测定,计算回收率。平均回收率为99.78%,RSD为0.75%,回收率符合要求。
2.2.4 三批样品及上市样品的含量测定
取样品及上市样品,照含量测定方法测定含量,结果见表2。

表2 含量测定结果
参照以上结果,将本品的蛋氨酸含量限度订为:“含蛋氨酸(C5H11NO2S)应为标示量的90.0%~110.0%。”
2.3 甘氨酸
2.3.1 测定方法
精密称取本品适量(约相当于甘氨酸25mg),置100mL量瓶中,加入1mol/L盐酸溶液5mL,放置15min,加水至刻度,摇匀,滤过,精密量取10mL,加甲基红指示液1滴,用氢氧化钠滴定液(0.1mol/L)滴定至黄色,再加中性甲醛溶液(对酚酞指示液显中性)10mL,振摇,放置10分钟,用氢氧化钠滴定液(0.1mol/L)滴定,近终点,加酚酞指示液1mL,继续滴定至溶液呈橘红色,并将滴定液的结果用空白试验校正。每1mL的氢氧化钠滴定液(0.1mol/L)相当于7.507mg的C2H5NO2。
2.3.2 重现性试验
精密称取本品适量(约相当于甘氨酸25mg)6份,分别置100mL量瓶中,照含量测定方法测定含量,RSD为0.39%,重现性符合要求。
2.3.3 回收率
取甘氨酸约20、25、30mg各两份,精密称定,同时称取处方量除甘氨酸外其他成分分置100mL量瓶中,照含量测定方法测定,计算回收率为99.64%,RSD为0.29,符合要求。
2.3.4 三批样品的含量测定
取样品及市售复方甘草酸苷片,照含量测定方法测定含量,结果见表3。

表3 含量测定结果
参照以上结果,将本品的甘氨酸含量限度订为:“含甘氨酸(C2H5NO2) 应为标示量的 90.0%~110.0%。
3 讨 论
本试验提供了一个可行的测定及评价复方甘草酸苷片质量标准的方法,建立了在同一系统使用性条件下对复方甘草酸苷片中3种主成分进行含量测定,操作简便、准确、重复性好,各组分分离完全,可有效控制复方甘草酸苷片的质量。三组分含量测定结果表明:实验药品的处方合理,工艺稳定,含量符合《中国药典》2005版的要求。
[1]He GX.Clinical therapeutic observation of Kushenin Plus compound Glycyrrhizin in the treatment of chronic type B hepatitis China[J].J Chin Mater Med,2008,33(4):443-444.
[2]Qu ZT,Xiang ZB.Advances in pharmacological action of glycyrrhizin[J]. Lishizhen Med Mater Med Res,2007,18(10):2568.
[3]Tian L,Gao XL. Study on the dissolution of compound Glycyrrhizin tablets[J]. Chin JMAP,2009,26(6):471-474.
[4]Fu YH.Determination of ammonium glycyrrhizinate in compound glycyrrhizin injection by HPLC[J]. Chin Tradit Patent Med,2006,28(6):913-914.
[5]Li YF,Li ZH,Zhu ZH.HPLC determination of glycyrrhizic acid in Chenxianglubailu tablets[J].Chin J Pharm Anal,2008,28(2):304-305.
[6]Chen CY,Shan L,Li Q. Determination of dissolution of compound Glycyrrhizin tablets by HPLC[J].Chin JMAP,2009,26(7):598-601.
