增殖细胞核抗原PCNA在大鼠缺血再灌注脑组织中的表达
2010-07-21陕西中医学院附属医院麻醉科咸阳712000安小亮
陕西中医学院附属医院麻醉科 (咸阳 712000) 安小亮 王 瑞
对脑缺血后神经元损伤机制研究中,DNA损伤和 DNA修复是近年来的热点。很多研究者发现,脑缺血后不仅发生神经细胞的坏死,在缺血周围,也即所谓半暗带区可产生 DNA损伤,由此可以诱导凋亡。
为了修补损伤、保证复制的真实性,生物体内有完善的机制来调控 DNA复制到损伤修复的功能转换。那么,PCNA在神经系统损伤后 DNA修复中担任何种角色?目前已知的 PCNA最重要的功能是其在核酸代谢中的作用:PCNA作为 DNA多聚酶δ(Polδ)的辅助蛋白,是 DNA复制合成必不可少的物质[1]。许多研究者做了大量这方面的工作。发现 PCNA在其中起了重要作用。有研究者设计实验,用紫外线照射 1周龄的小鼠海马脑片,造成海马细胞损伤,发现 PCNA在CA3区锥体细胞中表达增高,该实验结果提示,PCNA在神经系统中非增生细胞中的表达与 DNA的损伤修复密切相关[2]。国内徐广润等设计光化学法诱导老龄大鼠局灶性脑缺血实验,发现缺血后 2h,PCNA表达降低,但 24h后在缺血周边区有所增强[3]。对大鼠进行缺血预处理后,PCNA阳性细胞在脑缺血区表达,与假手术组相比明显上调。提示在局灶性脑缺血再灌注过程中,PCNA参与了脑缺血后神经细胞对 DNA损伤的修复过程,PCNA蛋白的表达变化可以影响 DNA损伤的修复过程,受损神经元的功能恢复与 DNA损伤的修复程度相关。本研究主要观察大鼠在不同程度的脑缺血再灌注后,PCNA的表达改变极其与凋亡的时相与空间关系,探讨 PCNA蛋白在脑缺血再灌注后DNA损伤修复中的作用。
材料与方法
1 材 料
1.1 实验动物:健康清洁雄性 SD大鼠,体重 250~300g,来自西安交通大学医学院动物中心.
1.2 水合氯醛(批号:20090613)上海五联化工厂。多聚甲醛液(批号:20090723)上海迈瑞尔化学技术有限公司。
1.3 550E高清晰彩色图文分析计算机系统,购自德国莱卡.
2 实验方法
2.1 SD大鼠全脑缺血模型的建立:SD大鼠 60只,同等条件下常规饲养 1周。按照 Dulsinelli和Brierly方法,采用 4-VO法建立全脑缺血再灌注损伤模型。 IR组:第 1日大鼠以 10%水合氯醛 0.36ml/100g腹腔注射麻醉,麻醉后仰卧固定,颈部正中切口,经胸锁乳突肌后气管旁进入,显露双侧颈总动脉并分离,双侧颈总动脉留置穿线备用,缝合颈部切口。改俯卧位固定于手术台上,保持大鼠头前倾约 30度,同时用橡皮栓住鼠尾给以轻度的牵拉力,使颈椎伸直便于观察。枕骨下第一颈椎水平正中切口,逐层分离皮下筋膜及钝性分离肌肉,注意严密止血,仔细分离两侧第一颈椎横突,暴露第一颈椎横突上的翼小孔,翼小孔下有两侧椎动脉通过,用烧红的探针插入翼小孔,烧灼双侧椎动脉,使之永久闭塞。操作轻柔、仔细,避免损伤脊髓及枕后三角区神经。之后逐层缝合皮下及皮肤。单笼放置,保持室温于 20~25℃,并用 60W的白炽灯持续照射至清醒,期间用数字电子测温器间断测定鼠肛温,防止体温下降。密切观察其苏醒过程,注意保持鼠呼吸道通畅,直至清醒活动。
第2日(24h后)动物活动后以同样方法麻醉,仰卧位固定,剪开切口缝线,沿昨日留置线再次游离暴露双侧颈总动脉,以橡皮筋从双侧颈总动脉下方穿过并提拉,阻断血供 6min,注意避免过度牵拉及夹闭颈内静脉,期间密切观察其生命体征变化,可见大鼠瞳孔散大、眼球苍白、嘴唇发绀,呼吸急促(颈总动脉阻断2min内瞳孔不散大者予以剔除)。松开橡皮筋予以血液再灌注后,逐层缝合,单笼放置。将鼠置于 20~25℃的室温中密切观察其苏醒过程,期间注意保持鼠呼吸道通畅,直至清醒活动。 PO组除不凝断椎动脉和阻断双侧颈总动脉外,操作完全同 IR组。
2.2 标本制备 :所有实验大鼠分别于再灌注后2h、6h、 12h、 24h、 48h、 72h定点时间给予 10%水合氯醛 0.36ml/100g腹腔注射麻醉后,用加有肝素的 PBS液 100 ml快速灌注心脏,见灌注成功的大脑整体呈均匀的瓷白色。在视交叉后 1 mm和 4 mm处各切一刀取中间小块脑组织,将组织块在 4%多聚甲醛液中浸泡,4℃保存 3d后制备成 5M厚海马薄片。
2.3 PCNA免疫组织化学染色:用免疫组化SABC法染色,按说明书操作。
2.4 凋亡细胞原位检测(TUNEL法)
2.5 显微镜观察以及阳性判断:①HE染色,在高倍镜(40×10)下观察海马 CA1区神经元细胞形态结构的改变。②免疫组织化学染色抗原表达,切片中显示胞核染色为棕褐色颗粒的细胞为 PCNA免疫组化阳性细胞,表达强度以灰度值表示,细胞核或细胞浆无着色为阴性。③TUNEL染色,切片中显示细胞核有明显的黄棕色颗粒或斑片为阳性细胞,即凋亡细胞,定量分析方法为:光镜下计算凋亡指数。凋亡指数(Apoptosis index,AI)计算方法:每只动物随机两张切片,每张切片观察 CA1,分别计算各区凋亡细胞数和总细胞数。 AI=凋亡细胞数 /总细胞数×100%。
2.6 采用德国 Leica-550E高清晰彩色图文分析计算机系统对阳性结果进行半定量测定,把选出阳性物质赋予棕黄色,得出二值图,并测出灰度,取平均值。灰度值越高代表表达水平越低。
结 果
1 HE染色结果 PO组高倍镜下细胞形态完整,排列整齐,结构清晰,胞核蓝染,核膜完整,核仁明显 (图 1);IR组于再灌注 6h可见 CA1区部分细胞开始出现形态变化,胞体皱缩或肿胀,24h时大量细胞出现形态变化,48h时出现严重改变,细胞间质水肿明显,细胞周围间隙增宽,神经元数目减少,排列紊乱,分布不均,核膜界限不清,结构模糊(图 2),至 72h细胞数量明显减少。
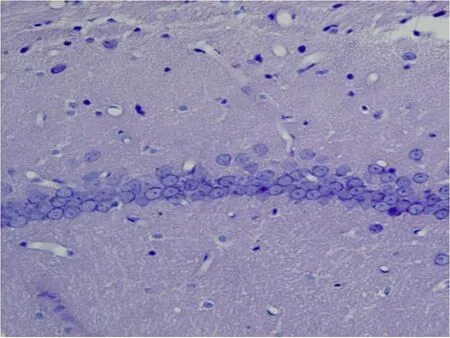
图1 PO组48h 海马CA1区 HE染色(×400)
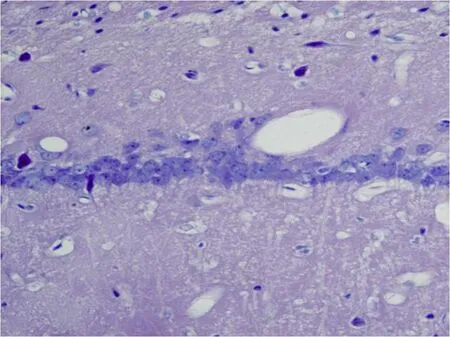
图2 IR组48h 海马CA1区 HE染色 (×400)
2 TUNEL法检测细胞凋亡结果 PO组 CA1区仅可见少量凋亡细胞(表 1);IR组中 CA1区 2h可见散在的凋亡细胞,缺血再灌注后 6h CA1区凋亡细胞开始增加,24~48h为高峰,至 72h明显减少(P<0.05,表 1,图 3)。
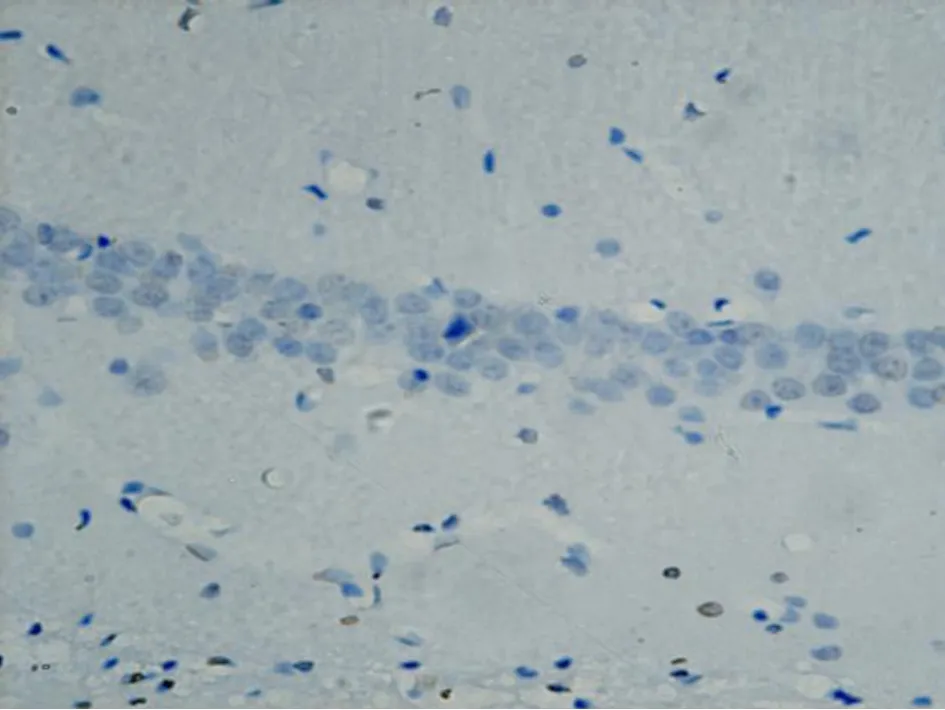
图3 PO组48h 海马CA1区 TUNEL染色(× 400)
3 全脑缺血再灌注后 DNA修复相关蛋白PCNA的表达 已有多项研究证实 PCNA在 DNA修复机制中具有重要作用,可能也参与了脑缺血以后神经元 DNA损伤的修复。本研究检测大鼠全脑缺血再灌注后缺血区海马 CA1区脑组织 PCNA的表达,作为大鼠全脑缺血再灌注后神经元 DNA的修复的观察指标。 PCNA蛋白在 PO组各时间点于 CA1区均见表达,呈棕褐色位于细胞核内(表 2,图 4);IR组于再灌注后 2h在海马 CA1区即可见表达下降,再灌注后 6~24h组明显下降,之后持续低表达(P<0.05,表 2,图5)。
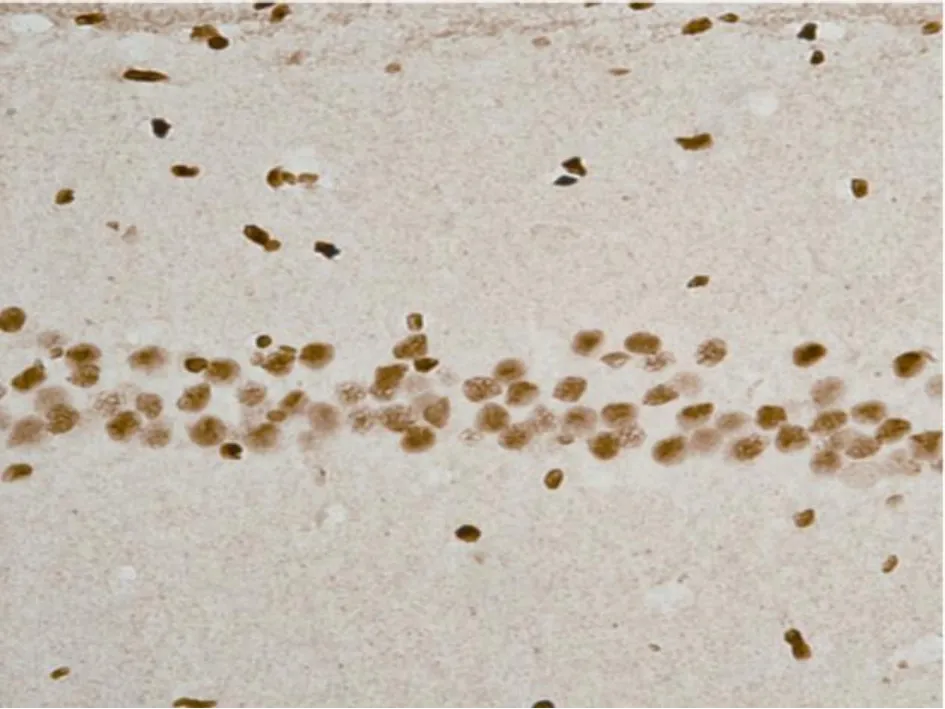
图4 PO组24h CA1 PCNA的免疫组化染色(× 400)
表1 SD大鼠缺血再灌注后各时点 CA1区凋亡指数的变化(,%)

表1 SD大鼠缺血再灌注后各时点 CA1区凋亡指数的变化(,%)
注:与 PO组比较 P<0.05
组别 2h 6h 12h 24h 48h 72h PO 0.24± 0.50 1.50± 0.66 1.51± 0.65 1.57± 0.78 2.13± 0.50 1.66± 0.62 I R 2.55± 0.37 14.43± 4.26* 29.25± 6.09* 41.35± 3.28* 38.93± 7.35* 21.35± 5.08*
表2 SD大鼠缺血再灌注后各时点 CA1区 PCNA灰度值(,%)
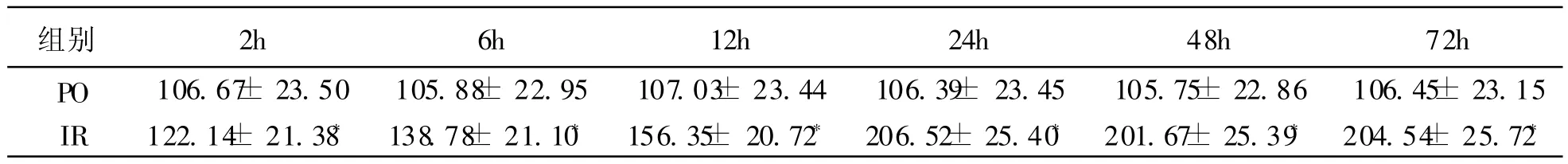
表2 SD大鼠缺血再灌注后各时点 CA1区 PCNA灰度值(,%)
注:与 PO组比较 P<0.05
组别 2h 6h 12h 24h 48h 72h PO 106.67± 23.50 105.88± 22.95 107.03± 23.44 106.39± 23.45 105.75± 22.86 106.45± 23.15 IR 122.14± 21.38* 138.78± 21.10* 156.35± 20.72* 206.52± 25.40* 201.67± 25.39* 204.54± 25.72*
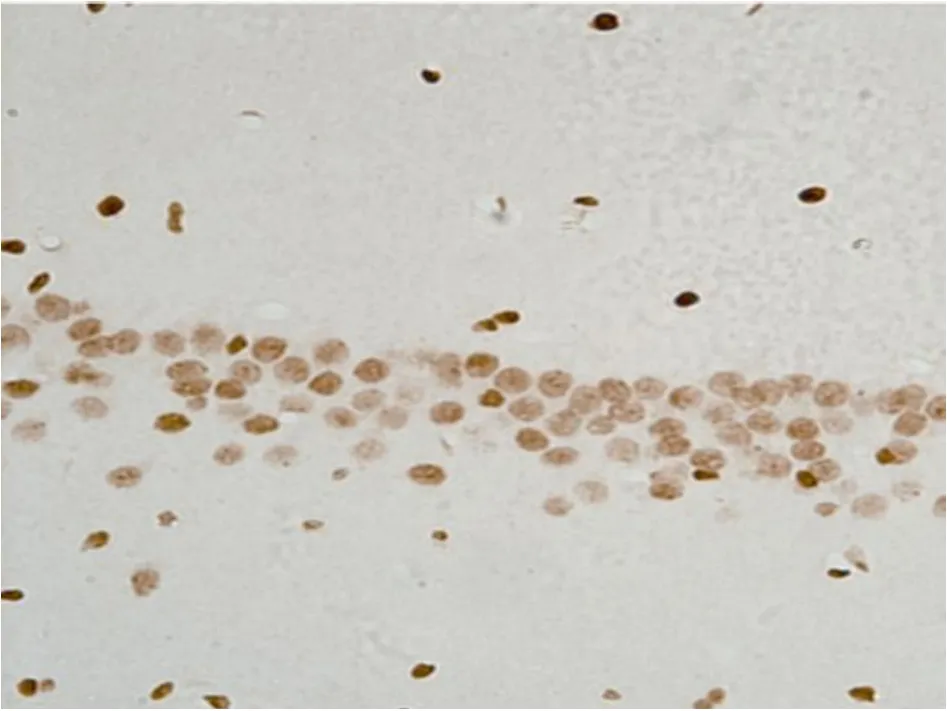
图5 IR组 24h CA 1 PCNA的免疫组化染色(×400)
讨 论
与脑缺血再灌注损伤中的众多因素都可以引起DNA损伤,DNA损伤直接关联到细胞结构与功能的恢复,是脑缺血再灌注损伤的关键。增殖细胞核抗原(PCNA)是一种细胞周期调节蛋白,其合成水平反映了细胞增殖率及 DNA合成率,并与多种细胞周期调节因子密切相关。
研究表明,DNA的损伤与修复在缺血神经元的死亡机制中发挥重要的作用,对 DNA损伤修复的失败是触发缺血神经细胞凋亡的重要机制之一[4],在急性脑缺血时,其氧供和能量代谢发生障碍,并在早期有一个活性氧(ROS)产生的高峰,通过氧化应激、游离自由基引起蛋白、脂质和核酸的破坏。核酸的破坏可导致基因表达异常和神经元死亡,在生理条件下,ROS能被抗氧化物和抗氧化酶中和,但当某些氧化应激反应的强度超过抗氧化机制的防御能力时,就可导致氧化性DNA的损伤;这时体内的 DNA修复机制启动(主要包括碱基切除修复通路和核酸切除修复通路),当修复成功时细胞存活,如果 DNA的损伤不能得以修复时,可启动调控细胞凋亡的基因,导致细胞凋亡。
本实验采用免疫组化法观察缺血后不同时间海马CA1区 PCNA表达的变化发现:在 PO组及 IR组的不同时间,大鼠海马 CA1区神经细胞均有不同程度的表达。IR组再灌注 6h PCNA的表达明显下降,至 24h达到高峰,并持续低表达至 72h,而与此同时,反映神经元 DNA损伤的凋亡细胞数也相继明显增加,至 24~48h达到高峰;二者之间呈现明显的一方表达减弱另一方凋亡细胞数增加的负相关趋势,这反映脑缺血再灌注之后 DNA受到损伤的同时,作为参与修复DNA碱基损伤重要因子的 PCNA的表达却明显下降,并且本实验中 PCNA表达的低谷还要早于凋亡细胞数的高峰出现,提示包括 PCNA在内的细胞内DNA修复系统也同时受到损害,PCNA的修复能力和修复速度都有一定的局限性,可能受很多因素影响;DNA损伤不能及时得到修复或者不能完全修复,最后就可能造成整个细胞的不可逆损伤。以上与何洪波等[5]的研究接近一致。
综上所述,增殖细胞核抗原 PCNA主要在缺血再灌注后早期即 24h前损伤未积累到严重程度时执行抗凋亡的作用,对损伤神经元 DNA进行修复。提示我们如果能阻止或延迟脑缺血后 PCNA蛋白的减少,将可能提供一些治疗机会以降低神经元的损害。因此,今后研究方向可以考虑采取某些干预措施来阻止或延迟脑缺血后 PCNA的减少,或研究能促进 PCNA蛋白表达的药物,这些方法为临床防治提供新的思路,将可能在脑缺血损伤中发挥重要的神经保护作用。
[1] 余 芬,袁秀珠.慢性脑缺血大鼠海马中 APE、PCNA的表达与神经细胞凋亡.山东医药,2009,49(33)∶279
[2] Maga G,Hübscher U.Proliferating cell nuclear antigen(PCNA):a dancer with many partners[J].J Cell Sci,2009,116(15):3051-3060.
[3] 徐广润,张 ,杨 渊.老龄大鼠局灶性脑缺血后 DNA修复蛋白:增生细胞核抗原表达的研究.卒中与神经疾病,2000,7(3):129-131
[4] Adkins DL,Voorhies AC,Jones TA.Behavioral and neuroplastic effects of focal endothelin-1 induced sensorimotor cortex lesions[J].Neuroscience,2004,128(3):473-486.
[5] 何洪波,周华东,陈曼娥,等.大鼠局灶性脑缺血再灌注后增殖细胞核抗原对神经功能缺损的影响.中国临床康复,2004,8(22):4484
