妊娠相关血浆蛋白A定量测定方法的建立*
2010-07-21李灵俊陈淑莲李向东彭学静李会强王学谦
李灵俊 陈淑莲 李向东 彭学静 李会强 王学谦
妊娠相关血浆蛋白A(pregnancy-associated plasma protein A,PAPP-A)是1974年由 Lin等首次从孕妇血清中分离出的一种来源于胎盘组织的糖蛋白,在外周血中以PAPP-A/proMBP异构聚合体的形式存在[1]。PAPP-A是孕早期筛查唐氏综合征的敏感指标[2],在心血管疾病的诊断和预后判断方面也具有一定价值,研究显示PAPP-A参与血管的修复过程及动脉粥样硬化损伤的进展,并与斑块的不稳定性和破裂密切相关[3]。本文采用生物素化牛血清白蛋白-链霉亲和素微孔板间接包被法[4],将标记有生物素的抗PAPP-A抗体作为捕获抗体,结合抗原;标记有辣根过氧化物酶的抗PAPP-A抗体作为检测抗体,即形成微孔板-生物素化抗体-抗原-酶标抗体的复合物,建立外周血PAPP-A定量酶联免疫测定方法。
1 材料与方法
1.1 主要材料与仪器 PAPP-A酶免测定试剂盒(美国DRG 公 司 ,EIA-2397,96T,LOT:46K128); 单 克 隆 抗 体PAPP-A(10E1)0.5 g/L,PAPP-A(10E2)2.0 g/L,芬兰 Hytest公司,4℃保存;96孔酶标反应板(美国Costar公司);辣根过氧化物酶(horseradish peroxidase,HRP)、生物素(biotin,B)、链霉亲和素(streptavidin,SA)、牛血清白蛋白(BSA)、四甲基联苯胺 (3,3′,5,5′-tetramethylbenzidine,TMB) 均购自美国Sigma公司,规格分别为 P8125-50 kU、B4639-1 mg、40945-1 mg、A7030-500 g、T4444-100 mL。血清标本分别为 2009 年4—5月取自天津市王顶堤医院的8~14周孕妇血清60份;2008年12月取自天津市中心妇产科医院的孕晚期(≥37周)孕妇血清50份,分装,-20℃冻存,孕周以末次月经确定。酶标分析仪(DNM-9602,北京普朗新技术有限公司);洗板机(EL×50,美国 BioTek Instruments公司);自动包被机(B2080905,北京楠华科技开发有限公司、北京拓普分析仪器有限责任公司)。
1.2 方法
1.2.1 酶标反应板的制备 取生物素化牛血清白蛋白(BBC,浓度为 10 g/L),用包被缓冲液稀释1∶3 000,每孔 150 μL,室温过夜。弃除包被液,用BBC稀释液洗涤2次,每孔150 μL,每次 10 min。加入链霉亲和素,工作浓度为 1∶4 000,每孔150 μL,室温2 h。弃除包被液,甩干,加入封闭缓冲液,每孔250 μL,室温2 h。甩干备用。
1.2.2 生物素化抗体的制备 将待偶联的抗PAPP-A抗体以适当浓度溶解于0.1 mol/L碳酸氢钠溶液(pH=9.5)中充分透析,期间换液数次;将活化生物素以适当浓度(通常为20 g/L)溶解于二甲基甲酰胺(DMF)中。将生物素缓慢、逐滴加到搅拌中的抗体溶液中,在室温下搅拌1 h。在4℃下用0.1 mol/L,pH=7.4 的磷酸盐缓冲液(PBS)透析 24 h,其中换液数次,充分除去未结合的游离生物素,以1∶1的比例加入贮存液,分装,4℃保存。通过实验测试工作浓度为1∶4 000。
1.2.3 酶标抗体的制备 采用改良过碘酸钠法标记。抗PAPP-A抗体于0.3 mol/L碳酸盐缓冲液中冷藏透析过夜;取出透析后抗体加入已活化的HRP,避光,搅拌,反应1 h。于平衡液(0.01 mol/L的PBS)中冷藏过夜透析酶结合物粗品。取出已透析酶结合物,上样于已平衡好的Sephadex G-200凝胶柱,用平衡液洗脱,收集,即为纯化的酶标志物。用0.45 μm的滤膜过滤除菌,以1∶1的比例加入贮存液,分装,4℃放置备用。经实验测试工作浓度为1∶4 000。
1.2.4 标准品的制备 孕晚期混合孕妇血清,以所购试剂盒进行测定,确定血清标本浓度,使用标准品稀释液配制系列标准品,浓度分别为 50、25、10、5、2.5、1 、0 mg/L。
1.2.5 操作步骤 血清标本按1∶16稀释,生物素化抗体及酶标抗体最佳工作浓度均为1∶4 000。根据生物素-链霉亲和素酶联免疫吸附试验(ELISA)放大检测系统[5]结合本文,操作步骤如下:BBC微孔板内加入10 μL标准品、待测样品,同时加入100 μL生物素标记抗PAPP-A抗体,37℃水浴反应30 min后洗板甩干;每孔加入100 μL酶标记抗PAPP-A抗体,37℃水浴反应30 min;加入显色液A、B各50 μL,避光,室温反应15 min,加入终止液50 μL,立即以630 nm作为参考波长,测定450 nm处的吸光度(A450)。DRG试剂盒测定按说明书进行。
1.3 方法学鉴定实验
1.3.1 灵敏度 对0 mg/L标准品进行10次重复测定,计算其吸光度(A)值的均值(x)、标准差(s),用标准曲线反算出其x+2 s对应的浓度值,即为本试剂盒的灵敏度。
1.3.2 准确度 采用回收实验测定。向2份已知不同浓度标准血清中分别加入2份不同浓度的临床血清标本,测定其PAPP-A含量,计算回收率。回收率=(测定值-原PAPP-A浓度)/加入PAPP-A浓度×100%。
1.3.3 稳定性 将试剂盒放置37℃温箱,分别于第0、3、5、7天取出,进行检测,通过标准曲线变化观察其稳定性。
1.3.4 精密度 用3份正常人血清配制成低、中、高浓度质控血清,每个质控血清平行做10孔,在同一块酶标板中测定它们的浓度,测批内变异;采用相同方法分别于不同酶标板中测定它们的浓度,测批间差异,观测其精密度。变异系数(CV)=s/x×100%。
1.3.5 特异性 配制1 mg/L PAPP-A标准品,测定其A值,作为对照。同样,于标准品稀释液中分别加入绒毛膜促性腺激素(β-HCG)、泌乳素(PRL)、甲胎蛋白(AFP)、雌二醇(E2)等,观察各物质达到同样A值的加入量,计算交叉反应率(交叉反应率=各物质加入量/PAPP-A量×100%)。
1.3.6 2种方法测定结果的比较 分别采用本文所建立方法和美国DRG公司试剂盒对30份早孕血清进行检查,采用相关性分析对2种检测方法的测定结果进行比较,以观察这2种方法是否有差异,若2种方法无差异,说明相关性较好。
1.4 统计学方法 采用SPSS 10.0统计软件包进行直线相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 测定方法的灵敏度 同时测定10次0 mg/L标准品,用标准曲线反算出其A值的x±2 s对应的浓度值,得出该方法的灵敏度为0.31 mg/L。
2.2 准确度 回收实验结果示其回收率均在95%以上,说明此方法具有很好的准确性,见表1。
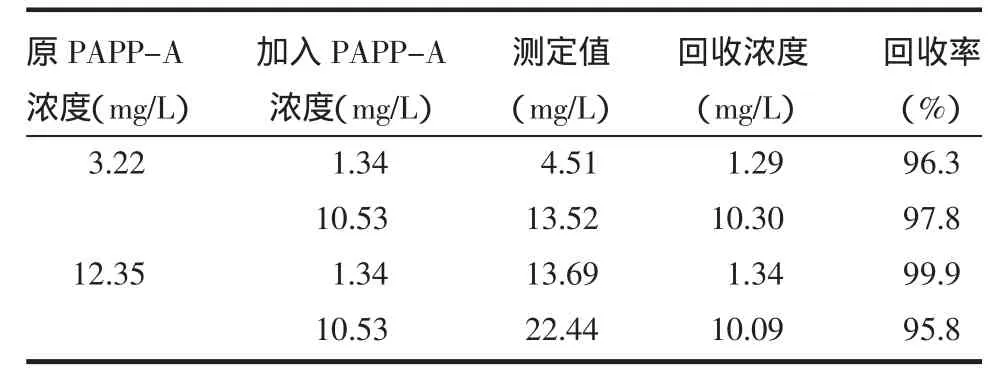
表1 不同浓度标本的回收率
2.3 稳定性 稳定性实验显示,在37℃温箱中放置3 d与0 d无明显变化,5 d后标准品A值均有所下降,但线性良好,不影响测定,说明试剂盒的稳定性良好。放置7 d后,最大A值较低,且线性较差,见图1。

图1 试剂盒稳定性
2.4 精密度 低浓度检测结果的CV不大于10%,高浓度和中浓度检测结果的CV在10%左右,说明实验方法具有良好的重复性,见表2。

表2 不同浓度血清的批内与批间变异
2.5 特异性 用本方法检测 β-HCG、PRL、AFP、E2达到1 mg/L的PAPP-A相同A值所需加入量及交叉反应率,见表3。

表3 试剂盒交叉反应率
2.6 2种方法测定结果的比较 2种方法测定30份标本,以美国DRG公司试剂盒所测得PAPP-A浓度为X轴,本文方法测定浓度为Y轴,绘制散点图,见图2。对2个变量进行相关性分析,r=0.982(P <0.01);回归方程为:Y赞=2.286 1+1.026 9 X。本文方法与美国DRG公司试剂盒方法高度相关,该方法可用于人外周血PAPP-A含量的测定。

图2 DRG公司试剂盒所测结果与本文方法测定结果相关散点图
3 讨论
PAPP-A是从孕妇血清中分离出来的大分子糖蛋白,作为孕早期筛查唐氏综合征的一种单项血清标志物,其测定具有特别重要的意义[6]。目前国内用于定量测定人体外周血PAPP-A含量的国产试剂盒较少,主要依赖国外进口。测定方法有金标法、ELISA、时间分辨、化学发光等。金标法属定量或半定量的方法,灵敏度、特异性较后三者低,后两者准确性及特异性较高,但速度慢,且设备昂贵,成本相对较高,不易在基层医疗机构推广使用[7]。直接包被微孔板ELISA法虽操作简单、成本低廉,特异性较强,但仍需进一步提高其灵敏度。而本文采用生物素化牛血清白蛋白-链霉亲和素间接包被微孔板,牛血清白蛋白来源方便包被方式简单;亲和素可预包被在微孔板内,然后再将生物素化抗体包被于孔内,从而解决了一些抗体不易包被的难题。有研究表明,通过这种间接包被模式可最大限度减少包被抗体的空间位阻效应,提高抗体的利用效率,减少其用量,降低实验成本[8]。同时,这种包被模式具有较好的稳定性,可延长酶标反应板的效期,在此基础上建立的人外周血PAPP-A含量ELISA测定法操作直接简便、费用低廉,筛查范围广,灵敏度较高,值得推广使用。
综上,本文采用间接包被技术所建立的人外周血PAPP-A固相酶联免疫测定方法灵敏、可靠、稳定性好,与国外同类试剂的测定结果之间相关性较高,可望替代同类进口试剂盒进行PAPP-A含量测定、联合β-HCG检测及超声胎儿颈半透明度测量用于孕早期唐氏综合征的筛查。同时,作为易损斑块有价值的标志物,测定PAPP-A可望对急性冠脉综合征患者的危险度分层提供有效的帮助。
[1] 徐龙芳,张新安,朱佩强.PAPP-A在孕早期唐氏综合症筛查中的应用[J].临床和实验医学杂志,2006,5(10):1632-1633.
[2] 付小国,王素媚,王燕华.孕早期血清AFP、β-HCG、PAPP-A联合检测的产前筛查意义[J].中国优生优育,2009,15(2):108-110.
[3] Sean CH,Robert DS,Conover CA.Genetic deletion of pregnancyassociated plasma protein-A isassociated with resistance to atheroscler otic lesion development in apolipoprotein E-deficient mice challenged with a high-fat diet[J].Circ Res,2007,100(12):1696-1702.
[4] 房国祥,吴云娟,王书侠.应用生物素-链霉亲和素放大ELISA系统检测抗环瓜氨酸肽抗体[J].临床检验杂志,2009,27(1):20-23.
[5] 祝军,张景海.生物素-亲和素ELISA法对ANEPⅢ寡核苷酸适配子亲和力的定量测定 [J].细胞与分子免疫学杂志,2007,23(6):580-582.
[6]闫卫东,张霞.21-三体综合症及其产前筛查的研究现状和发展方向[J].生物学通报,2005,40(9):17-19.
[7] 唐宁,唐柳巧.酶联免疫吸附试验在产前筛查中的应用[J].实用医技杂志,2007,14(2):173.
[8] 孔令青,李勇,高洪.生物素-亲和素标记技术[J].动物医学进展,2008,29(4):100-102.
