米曲霉利用农业废弃物产木聚糖酶的条件优化
2010-07-17李勇如李秀婷孙宝国宋焕禄吕跃钢宋红霞
李勇如, 李秀婷, 孙宝国, 宋焕禄, 吕跃钢, 宋红霞
(北京工商大学 化学与环境工程学院/食品添加剂与配料北京市高校工程研究中心, 北京 100048)
随着木聚糖酶在实际生产中的应用越来越多,巨大的经济效益和社会效益促使人们越来越关注木聚糖酶的研究及工业化生产. 目前研究发现可以产生木聚糖酶的微生物来源广泛、种类多,已报道的能产木聚糖酶的微生物有细菌以及霉菌等[1]. 有关研究发现米曲霉能够产生木聚糖酶,但是对于米曲霉产木聚糖酶的深入研究还较少,也较少有关于米曲霉产木聚糖酶培养条件的报道. 目前木聚糖酶在食品、饲料等对酶安全性要求高的工业中应用非常广泛. 米曲霉是一种安全性高,无致病性,应用成熟的微生物菌株,在国内工业化酿造加工中应用非常广,如酱油酿造,酿酒,制曲等;也可用于生产各种酶制剂、有机酸、糖化饲料、益生素等[2]. 米曲霉发酵加工的产品及食品对人类或动物具有一定的保健功效[3]. 如能提高米曲霉产木聚糖酶的能力,一方面可以减少生产成本;另一方面可以对其发酵产生的木聚糖酶进行深入研究并能够比较放心的应用于食品、医药、饲料等工业加工中. 另外,利用木聚糖做碳源进行液体发酵来生产木聚糖酶,酶的生产成本较高[4]. 我国具有丰富的玉米芯、甘蔗渣、小麦麸、秸秆,棉籽壳等富含半纤维素类自然资源的农林废弃物,长期以来未受到充分重视和开发利用. 如能将其用于木聚糖酶的生产,不仅可以取得巨大的经济效益,还可以处理农林废料,变废为宝,保护环境,加快农业发展,在一定程度上解决三农问题,提高我国农业可持续发展的能力. 本文在液体发酵条件下对实验室保藏的菌株米曲霉M-9,利用农业废弃物产木聚糖酶的条件及特点进行了探讨.
1 材料与方法
1.1 菌 株
米曲霉(Aspergillusoryzae)M-9,运用透明圈法从王致和集团公司提供的米曲霉沪酿3.042的曲精中筛选分离而来,以PDA斜面培养基30~32 ℃恒温培养并保存.
1.2 试 剂
桦木木聚糖:购于Sigma公司;玉米芯:购自北京郊区;其他试剂均为国产分析纯.
1.3 仪 器
可见分光光度计,棱光技术有限公司;恒温摇床,中科院武汉科学仪器厂.
1.4 菌种培养
菌种保藏斜面培养基(各成分含量为质量分数):玉米芯木聚糖1%、土豆20%、琼脂2%. 121 ℃下灭菌20 min.
平板培养基(各成分含量为质量分数):玉米芯木聚糖1%、 琼脂2%、 酵母浸膏0.3%、 蛋白胨0.5%、NaNO30.2%、KH2PO40.6%、MgSO4·7H2O 0.05%、FeSO40.01%、 KCl 0.01%. 121 ℃下灭菌20 min.
发酵产酶培养基(各成分含量为质量分数):玉米芯木聚糖2%、酵母浸膏0.8%、蛋白胨1%、NaNO30.2%、KH2PO40.4%、MgSO4·7H2O 0.05%、FeSO40.005%、KCl 0.05%. 121 ℃下灭菌20 min.
摇瓶发酵培养:250 mL锥形瓶装液量50 mL,接入1 cm2见方的平板培养基上生长4 d的孢子,30 ℃条件下200 r/min培养,取样备用.
1.5 木聚糖酶活力的测定
木聚糖酶活力的测定参照DNS法[5]:0.1 mL适当稀释的酶溶液,加入到0.9 mL用0.05 mol/L、pH值为5.3柠檬酸钠缓冲液配制的浓度1%桦木木聚糖底物溶液中,55 ℃反应5 min,加入1 mL DNS溶液终止反应后在540 nm测定吸光度值,同时以木糖标准液(10 μmol/ mL)作标准曲线. 木聚糖酶的活力单位(U)定义为:在上述条件下,每分钟水解木聚糖生成1 μmol木糖所需要的酶量.
1.6 蛋白质含量的测定
蛋白定量采用Lowry方法[6],以牛血清蛋白为标准.
2 结果与讨论
2.1 碳源对菌株产酶的影响
2.1.1碳源种类对菌株产酶的影响
碳源是影响高效生产木聚糖酶的关键因素之一,它在微生物生长过程中为机体提供维持生命活动所必需的能源物质,并在产木聚糖酶过程中作为诱导底物. 图1是以几种糖类作为碳源对菌株M-9产生木聚糖酶的影响情况. 由图1可知,米曲霉在发酵过程中检测到的木聚糖酶活力很低,说明尽管米曲霉能够利用实验中的几种单糖或多糖进行细胞生长,但这些碳源却不宜于诱导菌株木聚糖酶的合成及分泌,抑或是这些碳源在菌株生长产酶过程中起了抑制作用. 木聚糖酶的诱导是复杂的,诱导水平也因微生物的不同而相差很大[7]. 从图1还可看出,纤维素、乳糖和木糖对菌株M-9产木聚糖酶起到了一定的诱导作用,约为葡糖糖、蔗糖和麦芽糖诱导水平的2~4倍. Smith和Wood[8]研究发现,葡萄糖几乎对木聚糖酶的诱导不起作用,而木糖却具有一定的诱导效果.

图1 碳源对菌株酶活力的影响Fig.1 Effect of various carbon sources on xylanase production
2.1.2不同来源木聚糖对菌株产酶的影响
很多底物可以诱导微生物细胞产生木聚糖酶并分泌到胞外,其中诱导效果较好的是各种来源的木聚糖[9]. 图2考察了不同来源木聚糖对菌株产木聚糖酶活力的影响. 从图2可看出,玉米芯水不溶性木聚糖的诱导效果最好,木聚糖酶活力为458.10 U/mL,而玉米芯水溶性木聚糖诱导产木聚糖酶能力较差,这主要是由于玉米芯水不溶性木聚糖的组成、结构和性质比较有利于诱导菌株M-9合成分泌木聚糖酶. 燕麦全溶性木聚糖的诱导效果较差,菌株M-9产生的木聚糖酶活力仅为99.95 U/mL.
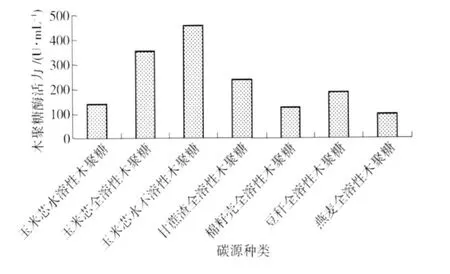
图2 不同来源木聚糖对菌株酶活力的影响Fig.2 Effect of different xylans on xylanase production
2.1.3不同农业废弃物对菌株产酶的影响
采用玉米芯、麦皮、麸皮、甘蔗渣、棉籽壳、豆杆、稻壳作为单一碳源进行菌株产木聚糖酶的发酵试验,比较不同碳源对产酶的影响,结果如图3. 图3结果显示,玉米芯为碳源时,发酵产木聚糖酶活力显著高于其他种类的农业废弃物,酶活力达到360.81 U/mL. 玉米芯、棉籽壳等的产酶效果明显优于葡萄糖、蔗糖等碳源,废弃物中含有的大量纤维素和半纤维素对木聚糖酶的产生有一定诱导作用,其中木聚糖含量较高的玉米芯粉作碳源时产酶效果最好. 翟倩等[10]研究得到玉米芯粉诱导菌株产木聚糖酶活性226.53 U/mL. 由于不同种类的农业废弃物所具有的木聚糖的化学结构和性质及含量不同,微生物利用的程度不同,因而菌株利用农业废弃物产木聚糖酶的能力存在差异. Battan等[11]认为,高活性木聚糖酶的产生可能是纤维质原料中除木聚糖外的成分诱导并分泌了其它半纤维素酶,而这些酶与木聚糖酶协同作用的结果. 实验表明尽管木聚糖的诱导效果好于农业废弃物,但本实验中玉米芯粉作碳源时菌株产木聚糖酶活是玉米芯水不溶性木聚糖作为碳源时的78.8%,说明玉米芯对菌株M-9产木聚糖酶也能起到良好的诱导作用,该菌株能较好地利用农业废弃物.

图3 农业废弃物对菌株酶活力的影响Fig.3 Effect of agricultural wastes on xylanase production
2.1.4碳源质量分数对菌株产酶的影响
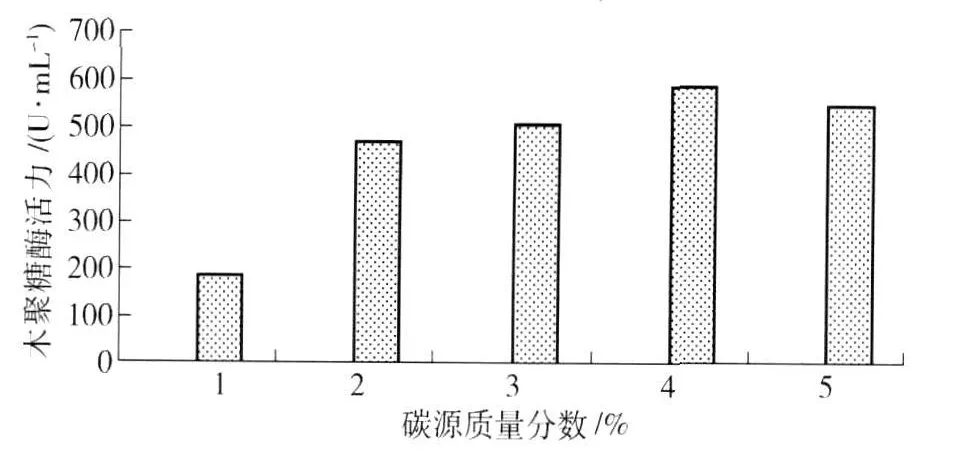
图4 碳源质量分数对菌株酶活力的影响Fig.4 Effect of concentration of carbon source on xylanase production
考察不同玉米芯碳源质量分数对菌株产酶能力的影响,实验结果如图4. 从图4可知,当碳源质量分数达到4%时,木聚糖酶活力达到最高(586.80 U/mL);随后,碳源质量分数增加,木聚糖酶活力反而开始下降. 当碳源质量分数较低时,培养基营养不充足,不利于菌体生长繁殖及产酶;碳源质量分数过高,固形物过多,影响通氧量,引起细胞溶氧不足,不仅影响微生物的生长,而且不利于原料的高效合理利用. Battan等[11]报道,BacilluspumilusASH木聚糖酶的活力随着碳源质量分数的增大(0.25%~2.0%)而提高,并随着碳源质量分数进一步加大而减小,这是由于碳源在摇瓶发酵过程中形成了较厚的悬浮物,使得碳源混合不均匀而不利于微生物利用.
2.1.5碳源粒度对菌株产酶的影响
碳源种类和质量分数确定后,考察碳源粒度对菌株产木聚糖酶活力的影响,实验结果如图5. 从图5可以看出,随着碳源粒度的减小,产木聚糖酶活力逐渐增高,在200目时达到最大值663.49 U/mL. 碳源粒度的大小是影响菌株向胞外分泌酶的重要因素,因为较小的粒度拥有较大的比表面积[12],则菌株与诱导物结合的面积相对较大,利于菌株发酵产酶,木聚糖酶产量相对较高. 但碳源粒度过小,菌株发酵产生木聚糖酶的量也有一定程度的下降.
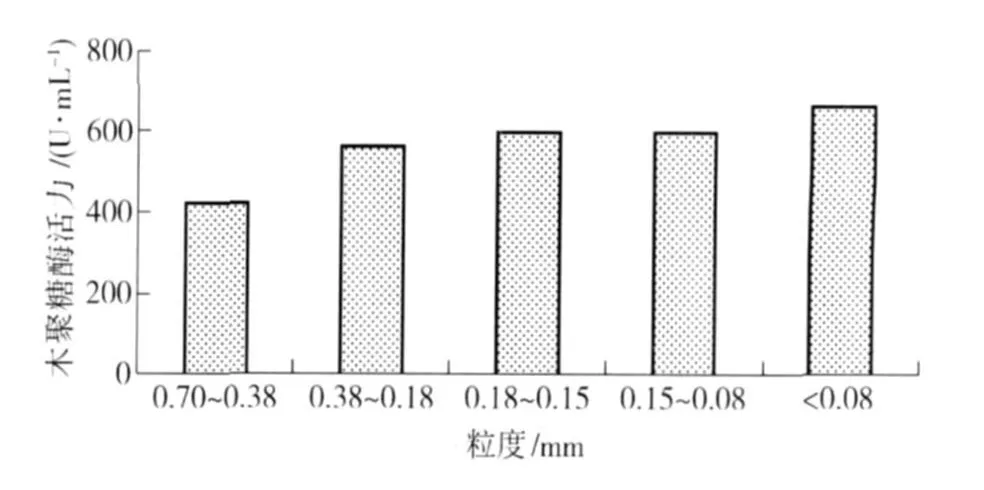
图5 碳源粒度对菌株酶活力的影响Fig.5 Effect of partical sizes of carbon source on xylanase production
2.2 氮源对菌株产酶的影响
2.2.1氮源种类对菌株产酶的影响
酶诱导物和酶蛋白质前体物质共同调控木聚糖酶的合成,其中酶诱导物主要是可利用的碳源,而酶蛋白质的前体主要来自于氮源,氮源和碳源的类型和性质会影响酶的合成和分泌. 最佳碳源确定后,以不同的有机氮源和无机氮源作为唯一氮源,质量分数仍为2.0%,来考察氮源对木聚糖酶合成的影响,结果如表1. 由表1可知,菌株利用两种铵盐所产木聚糖酶活力都很低,这是因为铵盐被分解利用使发酵液的pH值大幅下降,改变了菌株生长的缓冲体系,而不利于菌株的生长和产酶. 在有机氮源中,以酵母提取物为氮源时菌株所产木聚糖酶活性最高,酶活力达780.33 U/mL. 大豆蛋白胨次之. 氮源对微生物产酶的影响比较复杂,对不同微生物的作用不同. Battan等[11]认为微生物利用有机氮源产木聚糖酶情况比用无机氮源好得多. 不过也有报道无机氮源也能利于某些微生物产木聚糖酶,如Xu等[13]研究发现,无机氮源更有利于Pseudomonassp. WLUN024产生并分泌木聚糖酶.
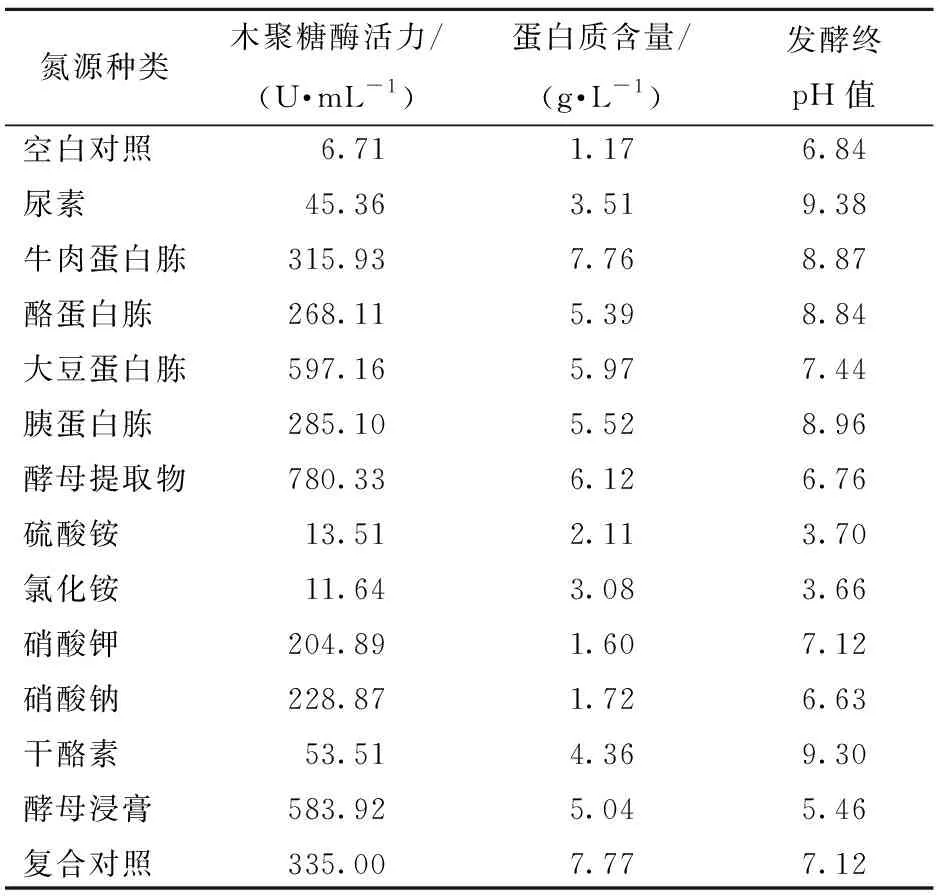
表1 氮源种类对菌株酶活力的影响Tab.1 Effect of various nitrogen sources on xylanase production
2.2.2复合氮源对菌株产酶的影响
选择最适的两种氮源,改变复合氮源比例,考察复合氮源对菌株产酶的影响,结果如表2. 试验结果表明:酵母提取物:大豆蛋白胨质量比为3∶2时,产木聚糖酶活力达到最高为738.45 U/mL.
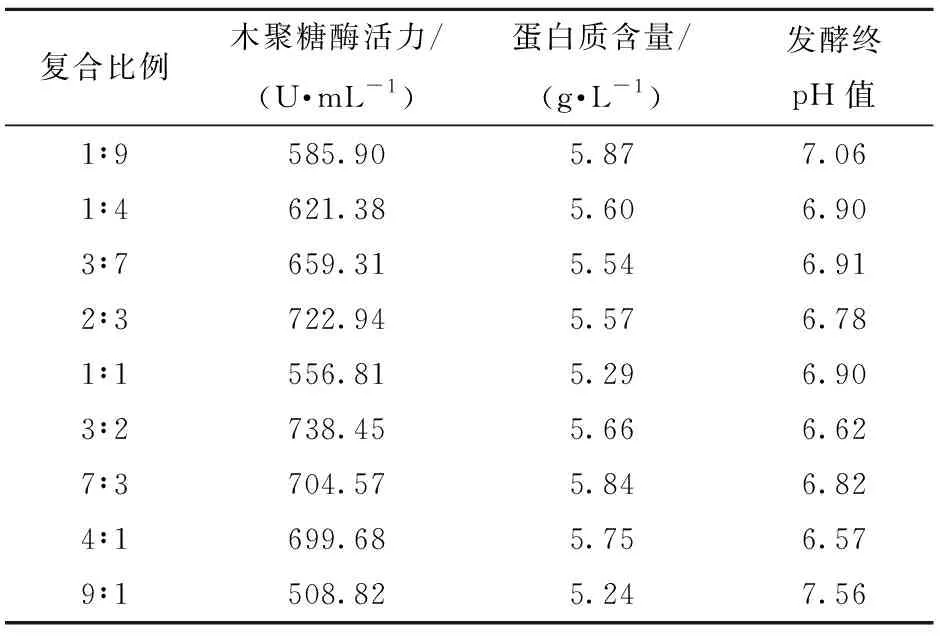
表2 复合氮源对菌株酶活力的影响Tab.2 Effect of compound nitrogen sources on xylanase production
2.3 培养基初始pH值对菌株产酶的影响
由于微生物对生长环境的酸碱性要求不同,因而培养基初始pH值对菌株产酶的影响很大,发酵过程中选择适宜的pH值非常重要. 在优化碳氮源的基础上,以1 mol/L HCl或NaOH调节培养基初始pH值范围为4.5~8.0,培养基初始pH对菌株产酶的影响如图6. 从图6可以看出,当初始pH值为7.5时,菌株的木聚糖酶活力达到最高,为775.78 U/mL;之后,pH继续升高,酶活下降较快,pH值为8时的酶活是pH值为7.5时的65.6%. 当培养基的初始pH值变化时,组成型的糖苷酶与透过酶活性中心的氨基酸的解离状态会发生改变,影响这些酶的活性以及质膜和细胞膜的通透性,木聚糖酶基因的转录受到阻遏,酶的合成受到影响[14]. 李秀婷等[15]报道,在米曲霉固态发酵产酶条件及酶活力研究中米曲霉产生木聚糖酶的最佳培养基初始pH值范围属于中性偏碱,这与本实验结果类似.
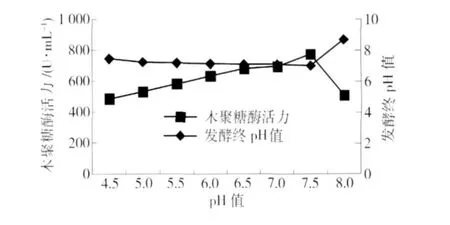
图6 初始pH值对菌株酶活力的影响Fig.6 Effect of the initial medium pH on xylanase production
2.4 培养温度对菌株产酶的影响

图7 培养温度对菌株酶活力的影响Fig.7 Effect of cultivation temperature on xylanase production
上述条件优化后,采用不同温度对菌株进行摇瓶发酵培养,考察不同温度对菌株M-9产酶的影响,结果如图7. 由图7可知,菌株在30 ℃培养时,木聚糖酶的产量达到最高,木聚糖酶活力为775.78 U/mL. 温度为25 ℃或35 ℃时,酶活力也较高,分别是最高酶活力的77.2%和64.6%. 在45 ℃培养时,酶活仅为最高酶活的12.5%,此时观察发酵液发现,菌体生长稀疏,三角瓶壁附着的菌丝体较少. 过高的温度会造成细胞内的活性物质发生变性,严重抑制微生物的代谢循环.
2.5 转速对菌株产酶能力的影响
在碳氮源、pH值、温度都确定的条件下,通过调节不同的转速,考察转速对菌株M-9产酶的影响,结果见图8. 由图8可知,当转速控制在200 r/min时,菌株产木聚糖酶能力最强,产生的木聚糖酶活力达到775.78 U/mL. 较低转速条件下(160 r/min)菌株酶活力为最高值的17.5%;较高转速条件下(240 r/min),酶活力为最高值的27.8%. 当转速较小时,发酵液中溶氧量不足,抑制了菌丝的生长,不利于菌株产木聚糖酶;当转速较高时,菌丝受到的剪切力作用过大,菌丝体过于短小细碎,菌丝生长受到一定影响,导致酶产量下降[16]. 摇床转速对菌株木聚糖酶的产生具有较大影响.
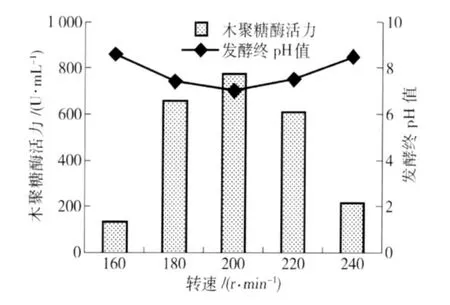
图8 转速对菌株酶活力的影响Fig.8 Effect of rotation rate on xylanase production
2.6 添加表面活性剂对菌株产酶的影响
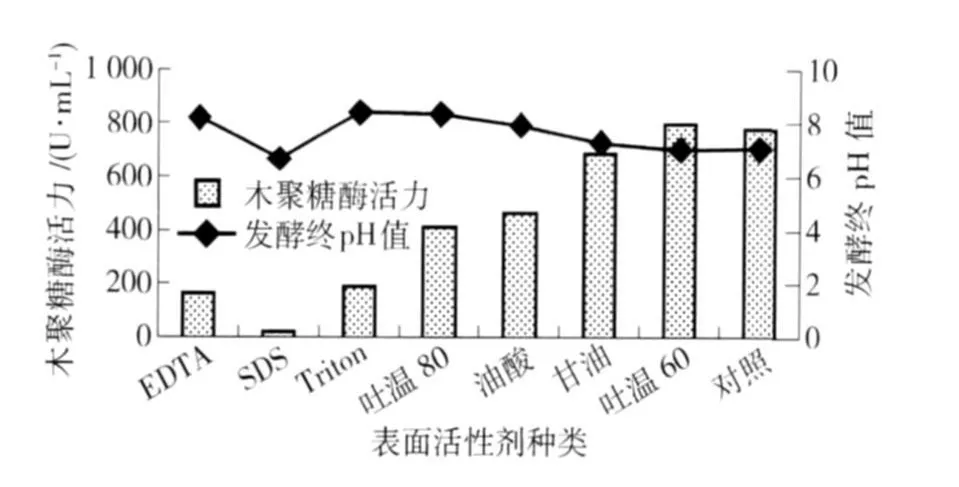
图9 添加表面活性剂对菌株酶活力的影响Fig.9 Effect of various additives on xylanase production
在碳氮源、pH值、温度、转速都确定的条件下,考察添加不同种类表面活性剂(0.2%)对菌株M-9产酶的影响,结果如图9. 由图9可知,吐温60的添加促进了木聚糖酶的产生,酶活力是对照的102.6%. 表面活性剂乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、聚乙二醇辛基苯基醚(Triton X-100)的添加对菌株产木聚糖酶起了较强的抑制作用,酶活力分别为对照的20.7%,2.2%和24.1%. Battan等[11]在BacilluspumilusASH的培养基中添加体积分数为0.2%的橄榄油,木聚糖酶活力提高到原来的2倍,并认为这类物质改变了细胞膜的通透性,从而促进了木聚糖酶的胞外分泌.
2.7 优化后米曲霉菌株M-9的产酶曲线和生长情况
在最佳条件下,米曲霉菌株M-9液体摇瓶发酵产木聚糖酶的历程如图10. 在发酵过程中,观察发现发酵液在第1天以后变得黏稠,而酶活力低,说明菌株还处于生长期,第2天粘稠度增大,酶活力也提高,在第3天酶活迅速升高,在第5天酶活力达到顶峰,为795.93 U/mL,第6天略有下降. 在此过程中,发酵液中蛋白含量随着发酵时间的延续发生相应的变化,其趋势与木聚糖酶的变化基本一致:发酵液的蛋白含量随酶活力的上升而增加.
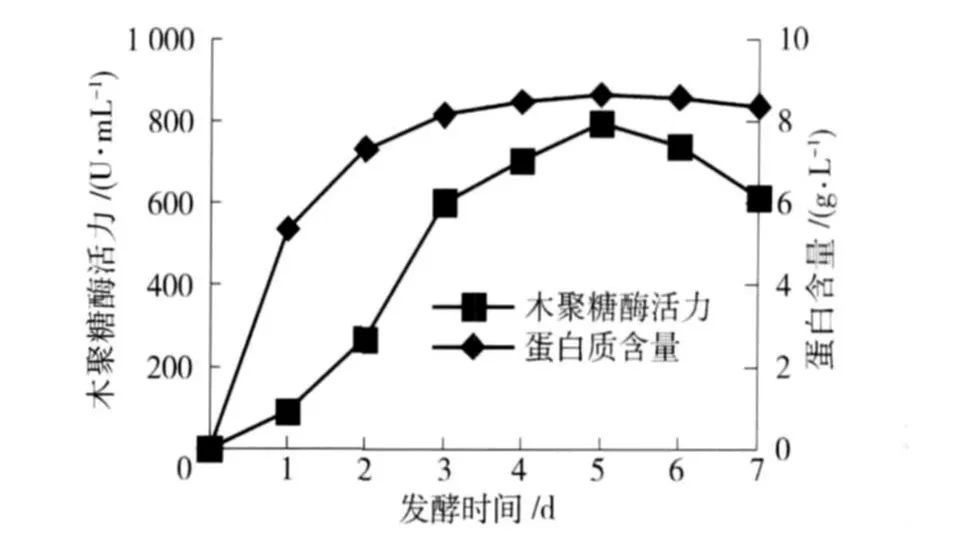
图10 产酶过程曲线Fig.10 Fermentation time course of xylanase production
发酵条件优化后,菌株产酶提前一天达到最高酶活,表明优化后的培养条件比较适宜菌株M-9产木聚糖酶,优化后酶活力为795.93 U/mL,是优化前酶活力的2.2倍.
3 结 论
本论文研究了菌株M-9产木聚糖酶的培养条件,分别对其生长所必需的碳源、氮源、培养温度和培养基初始pH值等条件进行了优化. 由实验得出,菌株M-9利用农业废弃物发酵产木聚糖酶的最佳培养条件为:最适碳源为粒度小于0.08 mm的玉米芯粉质量分数4%,最适复合氮源是质量分数1.2%的酵母提取物与0.8%的大豆蛋白胨,最适培养基初始pH值为7.5,最适培养温度为30 ℃,最佳转速为200 r/min. 添加质量分数0.2%的吐温60对菌株产酶有促进作用. 在优化后的最适产酶条件下培养5 d,木聚糖酶活力达到795.93 U/mL. 优化后酶活795.93 U/mL是优化前酶活力的2.2倍.
