降低烘烤花生致敏性的蛋白酶筛选
2010-07-17丛艳君薛文通
丛艳君, 薛文通
(1.北京工商大学 化学与环境工程学院, 北京 100048;2.中国农业大学 食品科学与营养工程学院, 北京 100083)
1986年叶世泰等在我国常用食品致喘40例分析中指出,花生等油料作物位居食物过敏原的前列[1]. 流行病学研究显示,约有3%的过敏反应由食物诱发,危及生命的过敏反应中有1/5是由花生引起[2]. 随着全球化进程,食品的生产、流通和消费方式呈现国际化,花生过敏将成为各国共同关注的问题. 我们前期研究工作表明:Ara h1和Ara h3系列蛋白为花生主要过敏原[3]. 探索花生脱敏方法对于保障消费者安全和指导企业开发低过敏食品均具有重要的意义.
致敏蛋白质与过敏反应相关的仅为其部分抗原决定基(数个至数十个氨基酸组成) ,因此掩盖、破坏和去除此类基团、使引起过敏的抗原决定基不再为免疫系统识别是开发低过敏性花生蛋白的关键[4]. 酶技术以其高效、反应温和、可控等优点广泛地应用于植物蛋白修饰中. 国内用于蛋白质水解研究的酶大多是微生物蛋白酶,对动植物蛋白酶的使用相对较少. 本研究的目的是降低烘烤花生蛋白的致敏性,即破坏花生过敏原的抗原决定簇,着眼于实际生产,在酶系的选择过程中以工业化生产的食品级酶类为主,探索单酶水解或多酶顺序水解对花生致敏性的影响,筛选降低烘烤花生致敏性的最佳用酶.
1 材料与方法
1.1 材料
花生购于北京市种子公司;碱性蛋白酶Alcalase,复合蛋白酶Protamex,固体木瓜蛋白酶Papain(S),中性蛋白酶Neutrase,风味蛋白酶Flavorzyme,胃蛋白酶Pepsin,Protease M均购自丹麦诺维信公司;花生过敏患者血清由北京大学第三医院友情提供.
1.2 仪器设备
BIO-RAD550型酶标仪, IO-RAD公司;HZS-H型水浴振荡器,哈尔滨市东联电子技术开发有限公司;PSH500A型生化培养箱,中国重庆银河实验仪器有限公司.
1.3 实验方法
1.3.1烘烤花生的制备及花生蛋白的提取[5]
以花育品种为试材,实验室自制花生制品. 170 ℃烘烤20 min制备烘烤花生.
花生仁用磨粉机磨成粉,按10 mL/g比例加入正己烷,于4 ℃振荡过夜脱脂,然后4 ℃离心10 min(12 000 g),取沉淀风干得脱脂花生粉.
脱脂花生粉,按m/v为1∶20比例加入20 mmol/L磷酸缓冲溶液(1 mol/L氯化钠,pH 7.8),4 ℃振荡提取4 h,,然后于4 ℃离心(14 000×g,10 min),取上清液,4 ℃透析48 h之后冻藏备用.
1.3.2酶活力的测定
采用福林-酚试剂法[6]. 首先绘制酪氨酸标准曲线;然后测定蛋白酶活力,即以酪蛋白为底物,加入适当稀释的酶液,再加入碳酸钠溶液和稀释的福林-酚试剂,保温显色20 min后,在660 nm波长下测定吸光度值,对照标准曲线,计算酪氨酸含量.
1.3.3蛋白质水解度的测定[7]
蛋白质水解度(Degree of hydrolysis, DH)的计算公式如下.
DH=(氨态氮/总氮)×100%
总氮测定采用凯式定氮法, 氨态氮的测定采用甲醛滴定法
1.3.4单酶水解
参照厂家提供的蛋白酶最适反应条件,选定底物浓度为5%,充分搅拌后,用恒温水浴箱保持恒温,加入蛋白酶. 水解过程中,不断搅拌并加入0.1 mol/L NaOH溶液调整pH值保持基本恒定,水解后取样,所取样品迅速煮沸3 min使酶失活,冷冻干燥后备用. 各种蛋白酶对花生蛋白的水解条件见表1,在所选蛋白酶的最适条件下,底物质量浓度为0.05 g/mL,E:S为3 000 U/g蛋白质,水解时间为8 h.
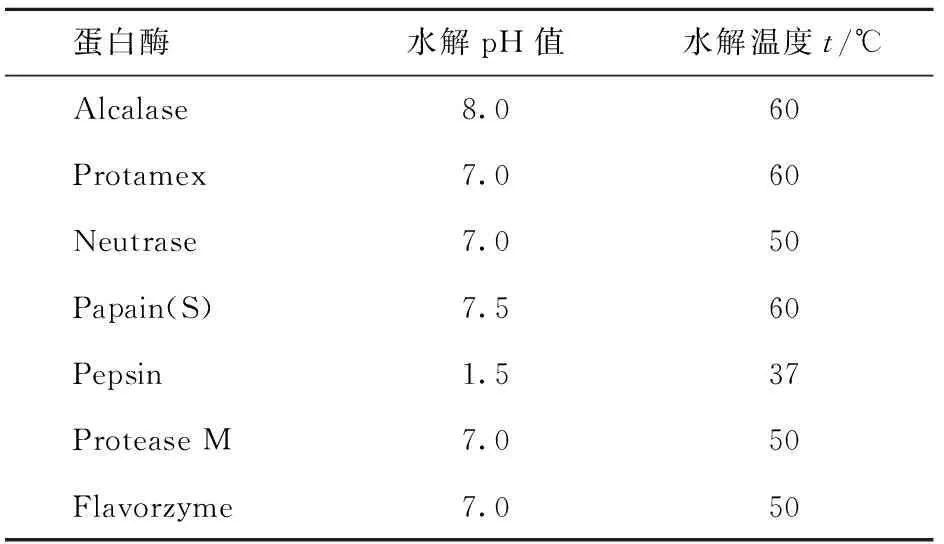
表1 各种蛋白酶对花生蛋白的水解条件Tab.1 The hydrolysis conditions of each emzyme to peanut protein
1.3.5双酶分步水解
在单酶水解结果的基础上,选用能降低烘烤花生致敏性的蛋白酶两两组合,先将花生蛋白溶液调至第一种酶的水解条件,水解5 h后,调至第二种酶的水解条件,加入第二种酶,3 h后取样(共水解8 h). 把所取样品迅速煮沸3 min使酶失活,冷冻干燥后备用.
1.3.6SDS-PAGE[8]
花生蛋白水解物用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析,所用条件为分离胶浓度12.5%,浓缩胶浓度4.5%,胶联度3.6%,进行垂直电泳,单板恒流10 mA,样品溶液先与等体积上样缓冲液混合,沸水浴加热5 min后,花生蛋白提取液5 μL(提取液质量浓度为1 g/L)上样;电泳后的分离胶用考马斯亮蓝R-250染色显现蛋白带,以低分子量蛋白做标准.
1.3.7酶联免疫实验
采用间接酶联免疫法(ELISA)测定花生蛋白酶解液致敏性强弱[9].
用包被液(50 mmol/L pH值为9.6的碳酸盐缓冲液)将花生蛋白稀释成10 μg/mL浓度,每个样品做三个平行;将收集的花生患者血清(一抗)和辣根过氧化物酶标记鼠抗人IgE(二抗)用封闭液稀释,然后显色反应,终止后在450 nm波长下读取OD值. 以TBS-Tween孔为对照,以吸光度值反应致敏性的变化.
2 结果与分析
2.1 单酶水解结果
除风味蛋白酶(Flavorzyme)外,其它的蛋白酶水解到一定时间,水解度随时间变化曲线趋于平缓,见图1. Alcalase、Protamex、Neutrase和Protease M 4种微生物蛋白酶活性较高,水解到7个h水解度才保持恒定,而木瓜蛋白酶(Papain S)水解到2 h后水解度就开始呈下降趋势,胃蛋白酶(Pepsin)在整个酶解过程中水解度都较低. 7种蛋白酶中,风味蛋白酶水解程度最深,8 h水解度为8.9%,Alcalase蛋白酶次之为7.4%.
蛋白致敏性越低, OD值越低. 7种蛋白酶在各自实验室最优酶解条件下,致敏性变化情况见图2. 由图2可见,胃蛋白酶的水解物致敏性最高,木瓜蛋白酶水解物致敏性也较高,4种微生物蛋白酶水解物IgE结合能力较低,其中Alcalase蛋白酶致敏性最低,另外风味蛋白酶水解物致敏性也较低. 方差分析表明,不同蛋白酶水解花生蛋白致敏性差异显著(p<0.05).
Alcalase活性较高,水解8个小时,花生蛋白致敏性降低了34.5%,风味蛋白酶活性也较高,水解8小时,花生致敏性降低了32.1%.
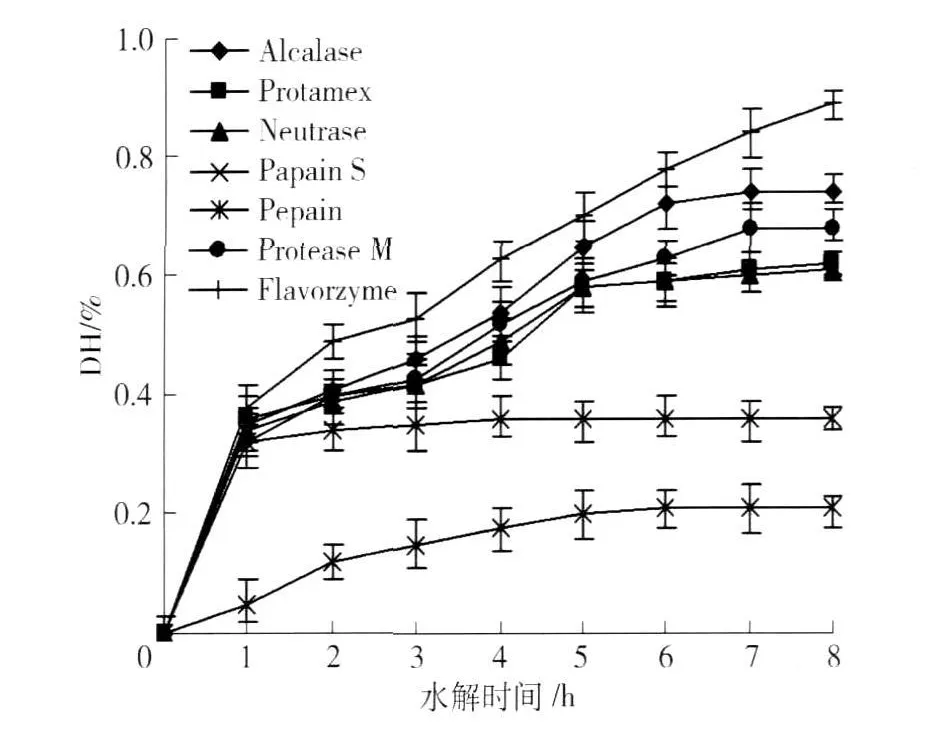
图1 花生蛋白酶水解过程中水解度的变化Fig.1 DH of peanut protein during hydrolysis
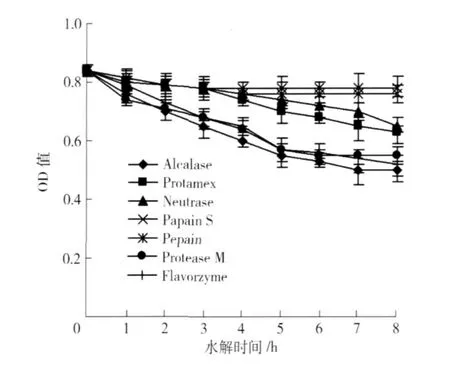
图2 花生蛋白酶水解过程中致敏性的变化Fig.2 Allergenicity of peanut protein during hydrolysis
2.2 双酶水解结果
双酶组合水解对花生蛋白质水解度的影响见图3. 由图3可知,水解8 h后,Alcalase和风味蛋白酶组合水解花生蛋白水解度最高,其次为Alcalase和protease M蛋白酶组合,水解度最低为风味蛋白酶和蛋白复合酶(Protamex)的组合.
双酶组合水解物致敏性对比情况见图4. 由图4可知,双酶组合水解产物致敏性差异显著(p<0.05),Alcalase和风味蛋白酶组合水解致敏性最低为0.49,风味蛋白酶和复合蛋白酶、Alcalase和复合蛋白酶此两组组合水解物IgE结合能力最高为0.56.
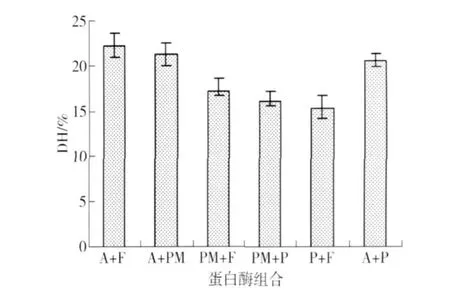
图3 双酶水解对水解度的影响Fig.3 DH of peanut protein hydrolyzed by two enzymes A为Alcalase F为flavorzyme PM为protease M P为protamex
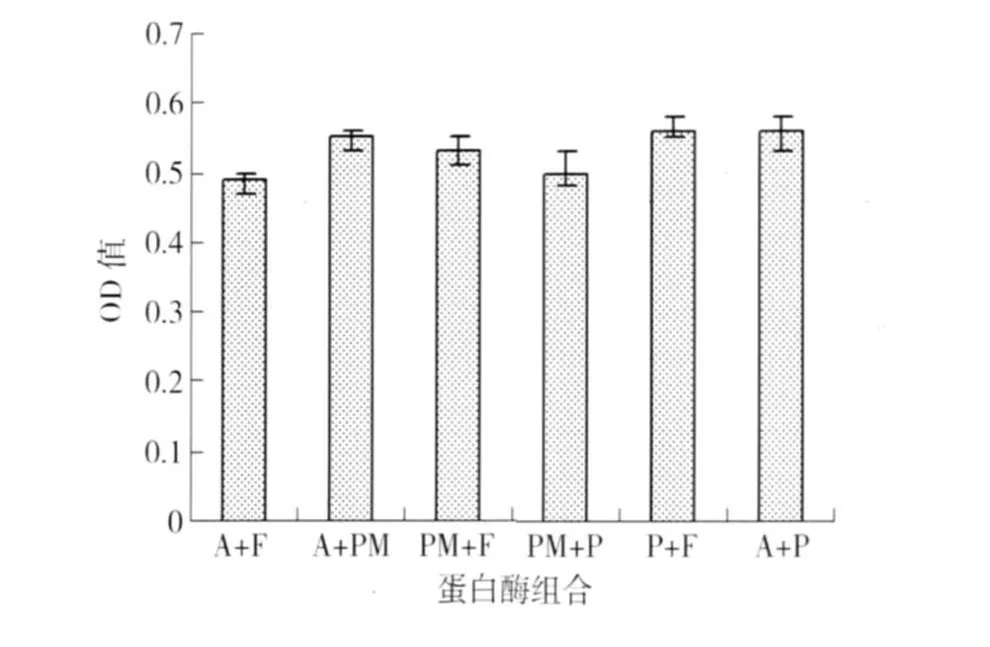
图4 双酶组合水解产物致敏性Fig.4 Effect of various hydrolyzates on the allergenicity of peanut protein
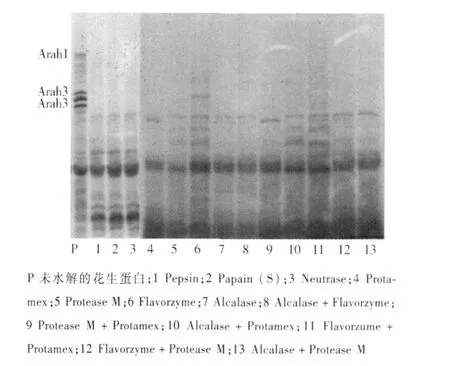
P 未水解的花生蛋白;1 Pepsin;2 Papain (S);3 Neutrase;4 Protamex;5 Protease M;6 Flavorzyme;7 Alcalase;8 Alcalase+Flavorzyme;9 Protease M+Protamex;10 Alcalase+Protamex;11 Flavorzume+Protamex;12 Flavorzyme+Protease M;13 Alcalase+Protease M
2.3 蛋白酶水解花生蛋白电泳图谱分析
单酶和双酶组合水解花生蛋白电泳图谱见图5,除第6泳道风味蛋白酶部分水解Ara h1和Ara h3外,其它泳道Ara h1和Ara h3均已水解完全.
3 讨论与结论
Nondlee等[10]研究表明烘烤花生IgE结合能力高于原料花生. 花生在烘烤过程中蛋白发生了复杂的反应产生新的致敏物质而增强了致敏性[11],即热处理的方法可能会引入新的抗原. 因此探索降低烘烤花生脱敏方法具有重要的现实意义.
Chung等[12]研究表明,过氧化物酶(peroxidase, POD)可通过引起花生过敏原Ara h1和Ara h2的聚合反应而降低花生蛋白的致敏性. 过氧化物酶是氧化还原酶的一种,催化从底物移去电子,并转给过氧化氢反应,产生氧化的供体,在蛋白质方面,主要表现为引起蛋白质的聚合. 从食品科学角度,酶催化后产物的加工特性和感观特性也是重要的考虑因素,因此,本研究主要选取食品级的蛋白酶作为花生脱敏的工具酶.
不同的蛋白酶具有不同的水解特异,所用酶的种类及酶解条件的不同,会导致酶解产物及抗原性的降低也有所不同. Vieths等[13]模拟胃液对焙烤的花生蛋白进行酶解反应,结果发现经胃蛋白酶处理2h后,几个IgE结合片断被SDS-PAGE免疫印迹所识别. Astwood等[14]研究表明,Ara h1经胃蛋白酶水解80min后仍可保持高稳定性. 本研究所选胃蛋白酶催化部位是Tyr-, Phe-羧基端和氨基端及Leu-,Arg-羧基端,从理论上可以降解过敏原的作用表位,但是胃蛋白酶水解物的抗体滴度值最高,其原因可能有以下几个方面:一方面胃蛋白酶是外肽酶,不能水解分子内肽键,分子内的抗原决定簇位点得以保存,从而不能有效降低花生的抗原性;另一方面花生蛋白主要抗原决定簇位于分子内部,即使是在蛋白结构热变性的情况下,蛋白酶仍不能有效的催化底物;再有由于蛋白经过水解,蛋白质分子构象发生改变,隐蔽于原分子内部的部位裸露于蛋白质分子表面,产生新的抗原决定部位,反而增强了其抗原性,证实了Haddad等[15]的研究. 一般认为,致敏原是一些耐热耐消化的蛋白质,具有抵抗胃肠道酶解的作用,胃蛋白酶催化花生蛋白水解物致敏性降低幅度较低,有力的证明了这一结论.
内肽蛋白酶水解蛋白质的实质就是将底物蛋白质的肽键断裂,释放出小肽,在初始阶段,断裂的肽键数目很多,敏感性肽键快速断裂,水解速度很快,表现在Alcalase,Protamex,Protease M,Neutrase,木瓜蛋白酶前6个小时水解度增加较快,而水解肽浓度升高,又反过来抑制水解速度,表现为后两个小时,水解度增加较慢. 外肽蛋白酶不能水解分子内肽键,分子内大量的抗原位点得以保存,所以风味蛋白酶和胃蛋白酶不能有效降低花生蛋白的抗原性.
双酶组合酶解花生蛋白水解度明显高于单酶水解物,但是抗体滴度值差异不大,这与酶的特异性有关,只有将抗原抗体结合的抗原决定簇打断,才能真正实现降低花生致敏性. 患者血清中的IgE抗体是由未被完全消化的致敏蛋白免疫产生的,当患者产生了IgE抗体后其抗体会与抗原表位结合,即使致敏蛋白被水解,只要还有残存的2个以上的表位(10kDa)即可与之结合而诱发疾病[4].
加热和酶解有可能产生隐位而提高过敏原的致敏性[16]. 本研究所选的蛋白酶没有出现提高过敏原致敏性的现象,这可能与底物蛋白结构的复杂性和蛋白酶催化底物的特异性有关.
Jost等研究表明,水解度与水解产物过敏性之间没有相关性[17]. 沈小琴[18]也得出同样的结论,即水解度和抗原抑制率没有一定的相关性,水解度高时,抗原抑制率不一定高,而水解度低时,抗原抑制率也不一定低. 本研究对不同蛋白酶水解花生蛋白的水解度和抗体滴度值做相关分析,未得出规律的相关性,因此,水解度和抗体滴度值之间无相关性.
在单酶、双酶筛选试验基础上,综合考虑蛋白水解的工艺复杂性及成本,本研究认为Alcalase单酶水解方法为降低烘烤花生致敏性的最佳方案.
