MAP30 全长基因的克隆及在巴斯德毕赤酵母中的高效表达研究
2010-07-13朱振洪杨威威葛立军万海同
朱振洪,杨威威,葛立军,万海同
MAP30 全长基因的克隆及在巴斯德毕赤酵母中的高效表达研究
朱振洪,杨威威,葛立军,万海同
310053 杭州,浙江中医药大学生物工程学院生物与制药工程教研室
研究毕赤酵母中高效表达全长 MAP30 蛋白及其生物活性。
根据 GeneBank 公布的 MAP30 全序列设计特异性引物,以苦瓜基因组为模板,PCR 扩增 MAP30 全长基因,将该基因插入 pPIC9k 载体中,经I酶切线性化后,电转化至 GS115 细胞,再通过 G418 筛选,最终获得了高拷贝重组 GS115 菌株。重组菌株在甲醇诱导下,SDS-PAGE 分析表达的特异性条带,运用Pharmacia VDS 图像分析软件进行条带密度扫描,得到各条带的扫描曲线图,计算出同一泳道目的蛋白条带峰面积相对于整个曲线所占的百分比,即蛋白纯度,并根据蛋白纯度和上清蛋白总量(Lowry 法)计算出发酵上清液中目标蛋白含量。纯化时首先用 75% 的饱和硫酸铵盐析,然后用 Phenyl Sepharose 6 FF 疏水层析,再用 CM-sepharose FF 阳离子层析。采用 MTT 法检测MAP30 蛋白对人胃癌细胞株 SGC7901 的抑制作用。为验证重组 MAP30 蛋白结构的正确性,采用 Edman 降解法分析末端 8 个氨基酸。
重组菌株在甲醇诱导下,SDS-PAGE 分析可见相对分子质量 32 000 的特异性条带,重组蛋白占上清液总蛋白的 67%;发酵液经硫酸铵沉淀、疏水和阳离子交换层析后,目的蛋白总回收率为 32.4%。MTT 法检测结果表明,重组 MAP30 蛋白具有明显的抑制人胃癌细胞 SGC7901 的活性,IC50为 30mg/ml。端的 8 个氨基酸测序进一步证实与理论一致。
重组 MAP30 蛋白在毕赤酵母中正确表达,表达产物具有抑制肿瘤细胞的活性。
苦瓜; 核糖体蛋白质类; 毕赤酵母; 基因表达
MAP30(momordica anti-HIV protein of 30 kD)是 1990 年 Lee-Huang 等[1]首次从苦瓜()果实和种子中分离得到的单链核糖体失活蛋白。MAP30 基因没有内含子,全长 861 bp,编码 286 个氨基酸,理论相对分子质量为 32 000,如果切除端 23 个氨基酸的引导肽,则 MAP30 蛋白为 263 个氨基酸,相对分子质量变为 30 000。其 51 ~ 53 位的 Asn-Leu-Thr 是连接糖基化位点。MAP30 的二级结构含有 8 个 α 螺旋和9 个 β 折叠,其端和端分别富含 β 折叠和 α 螺旋[2]。MAP30 具有抗病毒、抗肿瘤和抗微生物等多种生物学活性[3],尤其对 HIV 有显著的抑制作用,重组蛋白也具有与天然蛋白相同的功能和活性,MAP30 可以特异地抑制受病毒感染的细胞和肿瘤转化细胞,诱导凋亡,但对正常细胞没有毒副作用[4-5],因此具有巨大的临床应用价值。
由于从植物中直接提取 MAP30 蛋白成本高、工艺复杂,所以采用基因工程手段生产重组 MAP30 蛋白是有效途径。大肠杆菌表达系统尽管操作方便,但表达产物易形成无活性的包涵体,不利于分离纯化[6-7]。巴斯德毕赤酵母()利用甲醇作为唯一碳源,既具有原核表达系统良好的可操作性,又有真核表达系统的许多优点,如蛋白质的加工、翻译后修饰等,该系统可进行细胞外分泌表达,表达量高,是外源基因理想的表达系统。本研究通过设计特异性引物,克隆 MAP30 全长基因,通过在巴斯德毕赤酵母中表达蛋白,测定抑制肿瘤细胞的活性,为该重组蛋白进一步的开发应用奠定基础。
1 材料与方法
1.1 主要试剂和仪器
广东长身品种新鲜苦瓜选购于杭州市庆春路世纪联华店;质粒 pPIC9、pPIC9K,大肠杆菌 Top 10,酵母 GS115 细胞均为浙江中医药大学生物与制药工程实验室保存;人胃癌细胞系 SGC7901 由浙江大学生物化学研究所生物制药实验室赠送;限制性内切酶I、R I、H I、I 及酶、高保真酶、T4 DNA 连接酶等均为加拿大 MBI Fermentas 公司产品;G418 购自美国 GIBCO 公司;蛋白胨及酵母抽提物为英国 Oxid 公司产品;YNB 购自美国 Difco 公司;D-生物素、D-山梨醇购自德国 Sigma 公司;PCR 产物纯化试剂盒、DNA 胶回收试剂盒等购自北京博大泰克公司;RPMI-1640、胎牛血清购自美国 GIBCO 公司、胰蛋白酶等购自德国 Sigma 公司;其余为国产分析纯。凝胶成像系统为 Pharmacia VDS 系统,电泳系统为美国 Bio-rad 公司产品;Phenyl Sepharose 6 FF 和 CM-Sepharose FF 树脂购自美国Pharmacia 公司
1.2 方法
1.2.1 引物设计 根据 GeneBank 中 MAP30 蛋白全长序列,设计了 1 对特异性引物。上游引物:5’CCGAAAAGAATGGTGAAATGCTTAC TACTT 3’,引入I限制性酶切位点(划线部分)。下游引物:5’ CGTCAATTCACAAC AGATTCCC 3’,引入RI限制性酶切位点(划线部分)。引物均由上海生工生物工程技术服务有限公司合成。
1.2.2 MAP30 基因的扩增 采用改良 SDS 法[8]从新鲜苦瓜表皮中提取基因组总 DNA,以总 DNA 作为模板,加入与混合酶(4:1),PCR 扩增MAP30 基因。PCR 反应体系为:10 倍缓冲液(不含 Mg2+)5ml,MgCl2(25 mmol/L)3ml,dNTP(2 mmol/L)3ml ,引物(3 mmol/L)各 2ml,DNA 聚合酶(5 U/ml)1ml,模板 DNA 5 ng,用无菌双蒸水补足至体积至 50ml。PCR 反应条件为:94 ℃预变性 3 min ;(94 ℃ 1 min,51 ℃ 45 s,72 ℃1 min)共 30 个循环,72 ℃保温 7 min。用 1.0% 琼脂糖凝胶电泳检测 PCR 结果,并使用 DNA 胶回收试剂盒分离纯化 PCR 产物。
1.2.3 MAP30 基因的测序 PCR 产物经过RI +I内切酶消化后直接连接到 pPIC9 载体(RI+I双酶切)片段上,CaCl2法转化感受态细胞Top10,随机挑选若干菌落培养,双酶切初步鉴定后,送上海博亚生物技术有限公司测序,测序所用引物为 pPIC9 通用引物[5’ AOX1Primer(855-875),3’ AOX1 Primer(1327-1347)]。测序结果通过 NCBI 网站上的Blast 软件比对。
1.2.4 pPIC9K-MAP30 重组载体的构建 将 MAP30 和a-因子基因一起酶切下来,连接至pPIC9K 载体上(HI +RI双酶切),连接产物经 CaCl2法转化感受态细胞Top 10,在含氨苄青霉素(100mg/ml)LB 平板上初步筛选。然后通过质粒小量抽提、酶切鉴定等获得到有外源基因插入的阳性克隆。
1.2.5 酵母细胞的转化、筛选与鉴定 按 Invitrogen 公司操作手册,首先将重组载体经I 酶切线性化后,再采用电转化方法(1500 V,25mF,200W,4 mS)转入 GS115 感受态细胞中,转化产物涂 MD 平板,30 ℃培养 3 ~ 5 d,观察菌落生长情况。将 MD 平板上长出的 His+转化子,用涂布棒刮下后用无菌水稀释至吸光度(600)值为 0.01,然后涂细胞至含不同 G418 浓度(0.25、0.5、1.0、1.5、2.0、3.0、4.0 mg/ml)的 YPD 平板上,30 ℃中再培养 3 ~ 5 d,观察各平板菌落生长情况。挑选抗性平板上生长良好的菌落,然后采用菌落 PCR 方法,用原引物进行 PCR 扩增,鉴定出含有外源基因插入的重组酵母菌株,命名为 GS115/pPIC9K-MAP30,并通过 MM 平板确定其表型(Mut+or Muts)。
1.2.6 重组酵母的诱导表达
⑴表达方法:挑取若干重组酵母单菌落于 YPD 培养基中活化后,接种于缓冲的甘油复合培养基(BMGY)中,30 ℃振荡培养 16 ~ 20 h 至600为 2 ~ 6,离心2 500´,5 min 收集菌体,换用 BMMY 培养基诱导表达,每隔 24 h 补加甲醇至终浓度为 1.0%,连续表达4 d,分别于 24、48、72、96 h 离心收集上清液,SDS-PAGE 分析蛋白,筛选表达量最高的菌株。
⑵目的蛋白纯度的测定:取 50ml重组酵母的发酵上清液,高速离心8 000´,5 min,去杂质,再加等体积的 2 倍蛋白上样缓冲液,100 ℃煮沸后,取 20ml 进行 sds-page,考马斯亮蓝 R-250 染色,运用Pharmacia VDS 图像分析软件扫描条带密度,得到各条带的扫描曲线图,计算出同一泳道目的蛋白条带的峰面积相对于整个曲线所占的百分比,即蛋白纯度(%)。
⑶上清液中目的蛋白含量的测定:首先采用Lowry 法[9]定量测定发酵上清液中总蛋白浓度。总蛋白含量(mg)´目的蛋白纯度(%)= 发酵上清液中目标蛋白含量。
1.2.7 重组 MAP30 蛋白的分离纯化
⑴初步纯化:离心8 000´,10 min,收集发酵上清液,首先采用不同饱和浓度(20%、40%、50%、75%)的硫酸铵盐析,通过 SDS-PAGE 电泳检测沉淀后目的蛋白纯度,获得硫酸铵最佳饱和浓度。盐析后的沉淀用 10 mmol/L 磷酸盐缓冲液(pH 7.4)复溶后,直接用 Phenyl Sepharose 6 FF 疏水层析树脂分离纯化,上样缓冲液为:10 mmol/L磷酸盐缓冲液(pH 7.4)+ 1 mol/L (NH4)2SO4,洗脱缓冲液为:10 mmol/L磷酸盐缓冲液(pH 7.4)。
⑵精细纯化:将疏水层析洗脱蛋白调 pH 至 7.4,再用 CM-sepharose FF 阳离子层析柱分离纯化,上样缓冲液为:10 mmol/L 磷酸盐缓冲液(pH 7.4),洗脱缓冲液为:10 mmol/L 磷酸盐缓冲液(pH 7.4)+ 1 mol/L NaCl。收集洗脱峰透析除盐。
1.2.8 重组 MAP30 蛋白的鉴定及抑制肿瘤活性的测定 首先将纯化后的样品转至 PVDF 膜,送上海基康生物技术公司进行端测序。采用 MTT 法[10]检测重组蛋白对人胃癌细胞株 SGC7901 的抑制作用。由于该重组蛋白是溶解在10 mmol/L 磷酸盐缓冲液(pH 7.4)中,所以样品稀释液和空白对照组均采用10 mmol/L 磷酸盐缓冲液(pH 7.4)。首先在 96 孔培养板中接种 2´104细胞/孔,每孔 100ml,CO2细胞培养箱中培养 24 h 后吸出培养液,加入含不同稀释度的样品,同时设立空白对照组,每浓度设 5 个复孔。培养 48 h 后,每孔加入 20ml MTT(5 mg/ml),震荡混匀后,继续孵育 4 h,小心弃去上清液,加入 150ml DMSO,振荡 10 min,在酶标仪上波长 490 nm 处测其值,计算细胞抑制率。其公式为:细胞抑制率(%)=(1-实验组值/对照组值)× 100%。剂量和效应关系用Origin 6.1 软件进行回归分析并求出半抑制率(IC50)。
2 结果
2.1 MAP30基因的扩增和测序
根据特异性引物,运用 PCR 扩增获得 860 bp 左右的目的条带,与预期的相对分子质量一致(图 1)。该基因经I 与RI 双酶切,被克隆至 pPIC9 载体,所获得的基因序列通过比对发现,与GeneBank(AF284811)的核苷酸同源性达 99.88%,翻译后氨基酸的同源性达 100%。整个基因编码区为 861 bp。

M:标记物(lDNA/EcoR I + Hind III);1:PCR 产物
Figure 1 Amplification of MAP30 gene by PCR
2.2 pPIC9K-MAP30 重组表达载体的构建
从含氨苄青霉素的平板上挑选阳性克隆,经质粒抽提,H I 和R I 双酶切鉴定,切出约 1100 bp大小的片段(图 2),与 MAP30 及a-因子融合基因理论值之和大小一致,证实外源基因已克隆到毕赤酵母 pPIC9K 载体上。

M:标记物(lDNA/EcoR I + Hind III);1 ~ 2:重组 pPIC9K-MAP30 质粒;3:pPIC9K-MAP30 质粒经Sac I单酶切;4:pPIC9K-MAP30 质粒经BamHI + EcoR I酶切
Figure 2 Identification of recombinant plasmid pPIC9K- MAP30 by restriction digestion
2.3 电转化及重组酵母菌的筛选与鉴定
重组表达载体 pPIC9K-MAP30 经I 酶切线性化后,电转化毕巴斯德赤酵母菌 GS115,在 MD 培养基平板上长出700 个左右 His+转化子,上述转化子通过含 G418 不同浓度的 YPD 平板上筛选,最后在含 2.5 mg/ml G418 的 YPD 培养基上获得 6 个高抗性菌株。菌落 PCR 显示该菌株都有外源目的基因的插入(图 3)。

M:标记物((lDNA/EcoR I + Hind III);1:PCR 产物的阳性对照;2 ~ 7:6 个不同的单菌落的 PCR 产物
Figure 3 Identification of positive clones by PCR
2.4 重组 GS115 酵母菌的诱导表达
经过 MM 和 MD 平板鉴定,所获得的菌株为 His+/MutS型。按 MutS型菌株的表达操作方法,将重组菌株通过摇瓶培养进行甲醇诱导表达,取不同时间点的上清液进行 SDS-PAGE 分析(图4)。结果显示:诱导后上清液中在相对分子质量 32 000处有目的条带出现,与理论分子量相符。表达量占酵母总分泌蛋白量的67%,结合 Lowry 法测得上清液总蛋白,计算出目标蛋白表达水平为 910 mg/L。进一步研究显示,在甲醇诱导 24 h 后就能检测到表达产物,随着时间的延长,表达量不断提高,至 96 h 表达量达到最高。
2.5 表达产物的分离纯化
通过不同硫酸铵饱和浓度的分级沉淀,发现75% 饱和浓度盐析效果最佳,既可以去掉一些杂蛋白,又可以对产物进行浓缩。然后经过疏水和阳离子交换两步层析,重组蛋白总回收率为 32.4%,重组蛋白纯度达 96%,纯化数据如表 1 所示。
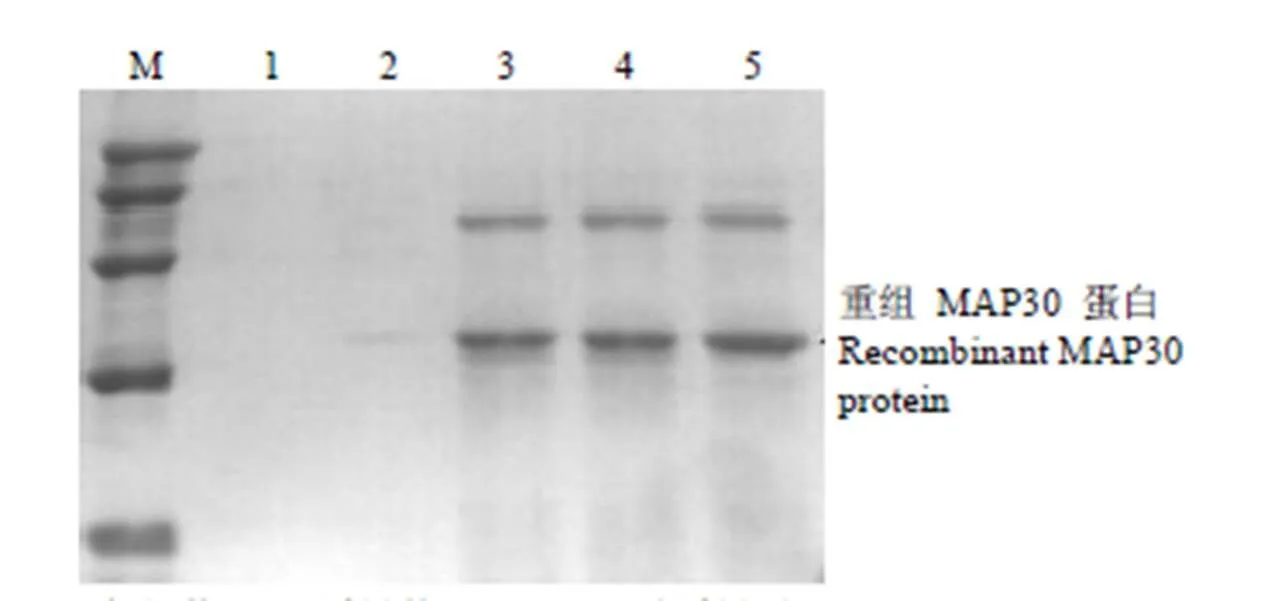
M:标记物;1:诱导前;2 ~ 4:甲醇诱导后 24、48、72、96 h
Figure 4 SDS-PAGE analysis of expressing suspension
2.6 N端氨基酸测序及产物活性初步鉴定
端氨基酸测序结果表明,重组全长 MAP30 蛋白端8个氨基酸为 VKCLLLSF,与理论值完全相符,证实该重组蛋白在巴斯德毕赤酵母中获得正确表达。
将不同浓度重组 MAP30 加入 96 孔细胞,48 h 后观察细胞形态变化,倒置显微镜下显示未处理的SGC7901 细胞生长良好,而实验组随药物浓度的增加,细胞萎缩明显,离壁变圆,细胞胞质突起,核仁减少,细胞皱缩,染色质凝聚,并可见单独存在的凋亡细胞(图 5)。通过 MTT 检测细胞生长抑制活性,发现不同浓度(6.25、12.5、25、50、100、200、400mg/ml)对胃癌细胞 SGC7901 的抑制率分别为:8.64%、11.7%、32.5%、89.1%、92.2%、93.27%、93.5%。随着 MAP30 浓度的升高,对 SGC7901 细胞增殖的抑制效果愈加明显(图 6),上述数据经 Origin 6.1 软件计算 IC50为30mg/ml。
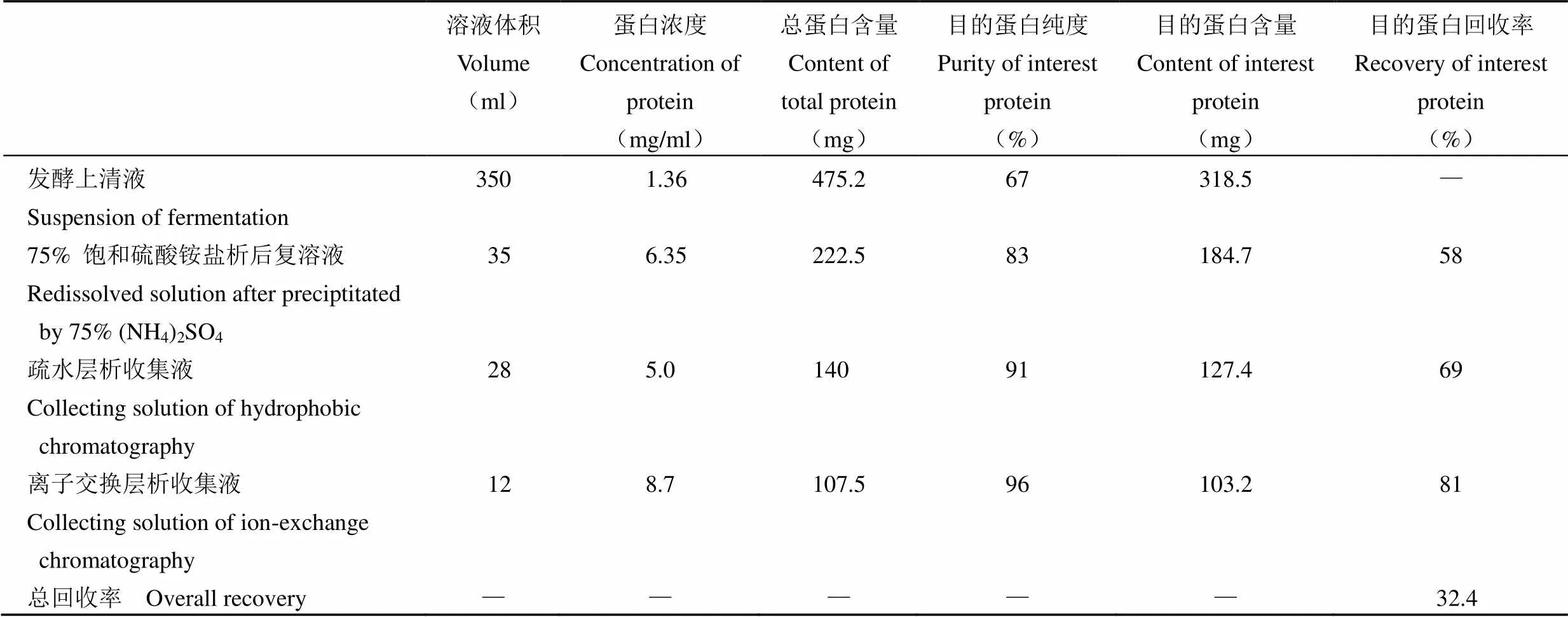
表 1 重组 MAP30 蛋白纯化效果
注:“—”:无
Note: “—”indicate non
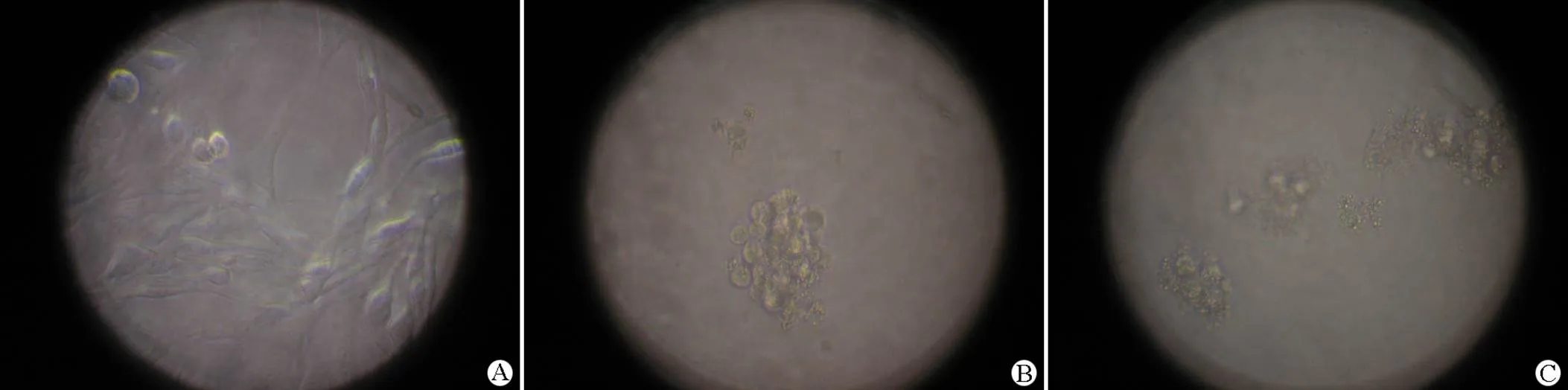
图 5 重组 MAP30 作用于胃癌细胞 SGC7901 的相差显微照片× 200(A:正常的胃癌SGC7901 细胞;B:胃癌 SGC7901 细胞经 50 mg/ml 的重组 MAP30 蛋白作用 48 h;C:胃癌 SGC7901 细胞经 100 mg/ml 的重组 MAP30 蛋白作用 48 h)
Figure 5 Phase-contrast microscope photos of SGC7901 cells treated by recombinant MAP30 × 200. A: Normal control of SGC7901; B: SGC7901 treated with recombinant MAP30 at the concentration of 50mg/ml; C: SGC7901 treated with recombinant MAP30 at the concentration of 100mg/ml.
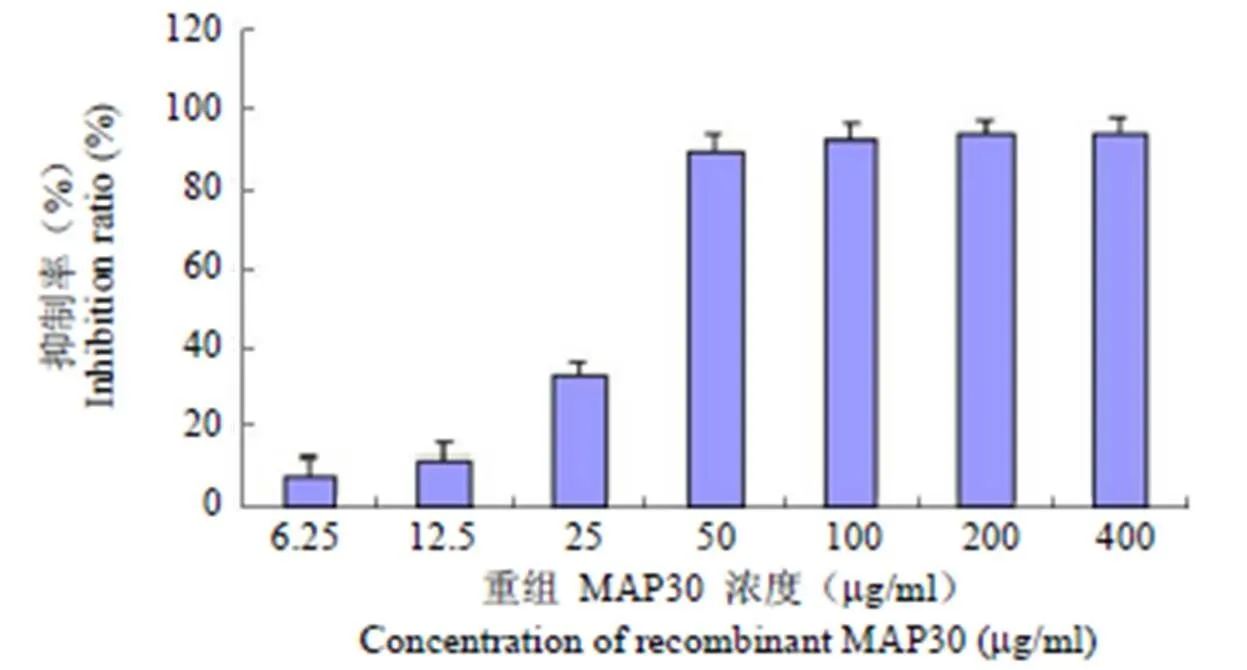
图 6 重组 MAP30 对胃癌细胞 SGC7901 的抑制活性
Figure 6 Inhibitory activities of recombinant MAP30 in SGC7901 cells
3 讨论
本研究结果表明,重组 MAP30 蛋白对人胃癌细胞 SGC7901 具有明显抑制作用,且呈剂量依赖性,IC50为 30mg/ml。而李春阳等[11]提取的天然 MAP30 对胃癌细胞 SGC7901 的 IC50为18mg/ml,说明重组 MAP30 比天然提取的蛋白活性稍低。而与林育泉等[12]运用大肠杆菌表达的重组 MAP30 相比,毕赤酵母表达的重组 MAP30 活性明显高。Arazi等[13]利用植物表达载体将 MAP30 基因转入到其他葫芦科植物中,在这些植物的果实中成功表达了 MAP30 蛋白。巴斯德毕赤酵母系统属真核高效表达系统,利用其表达重组 MAP30 蛋白具有产量高、纯化工艺简单、产物活性好和成本低的优势。本研究构建的重组菌株在摇瓶中的目标蛋白产量为 910 mg/L,经过 3 步纯化后蛋白纯度为 96%,总回收率达 32.4%,下一步该菌种将在7 L发酵罐中进行一系列发酵参数的优化,使目的蛋白表达量进一步提高,为产业化开发奠定了基础。
从传统中药和植物资源中寻找新的药物是今后一个重要的发展方向,而植物蛋白具有多方面的生物活性,如天花粉蛋白(TCS)是从葫芦科植物栝楼的块根中提取蛋白,具有较好的抗肿瘤活性。另外从丝瓜种子中获得的丝瓜毒素,从大戟科的多花白树种子中获得的 GAP31 蛋白等,都具有抗病毒、抗肿瘤等活性。重组 MAP30 成功表达为该药物的进一步研究提供了良好的基础,例如将重组 MAP30 蛋白与单克隆抗体、激素、生长因子等进行交联,制成免疫毒素在肿瘤、艾滋病治疗及骨髓移植等方面有着令人鼓舞的前景。另外 MAP30 蛋白抗肿瘤机制除了使肿瘤细胞核糖体失活而抑制蛋白合成外,还可使超螺旋 DNA 松弛断裂而拓扑失活,影响 DNA 的复制与转录以及抑制癌基因的过度表达。但是研究发现 MAP30 对肿瘤细胞的毒性远高于正常细胞,说明 MAP30 对这 2 种细胞之间存在不同的细胞信号途径,因此对于 MAP30 作用于肿瘤细胞的信号途径需要进一步研究,为其临床应用提供依据。
[1] Lee-Huang S, Huang PL, Huang PL, et al. Inhibition of the integrase of human immunodeficiency virus (HIV) type 1 by anti-HIV plant proteins MAP30 and GAP31. Proc Natl Acad Sci U S A, 1995,92(19):8818-8822.
[2] Wang YX, Jacob J, Wingfield PT, et al. Anti-HIV and anti-tumor protein MAP30, a 30 kDa single-strand type-I RIP, shares similar secondary structure and beta-sheet topology with the A chain of ricin, a type-II RIP. Protein Sci, 2000, 9(1):138-144.
[3] Bourinbaiar AS, Lee-Huang S. The activity of plant-derived antiretroviral proteins MAP30 and GAP31 against herpes simplex virus in vitro. Biochem Biophys Res Commun, 1996, 219(3):923-929.
[4] Arazi T, Lee Huang P, Huang PL, et al. Production of antiviral and antitumor proteins MAP30 and GAP31 in cucurbits using the plant virus vector ZYMV-AGII. Biochem Biophys Res Commun, 2002, 292(2):441-448.
[5] Sun Y, Huang PL, Li JJ, et al. Anti-HIV agent MAP30 modulates the expression profile of viral and cellular genes for proliferation and apoptosis in AIDS-related lymphoma cells infected with Kaposi`s sarcoma-associated virus. Biochem Biophys Res Commun, 2001, 287(4):983-994.
[6] Lee-Huang S, Huang PL, Sun Y, et al. Inhibition of MDA-MB-231 human breast tumor xenografts and HER2 expression by anti-tumor agents GAP31 and MAP30. Anticancer Res, 2000, 20(2A):653-659.
[7] Fan JM, Zhang Q, Xu J, et al. Inhibition on Hepatitis B virus in vitro of recombinant MAP30 from bitter melon. Mol Biol Rep, 2009, 36(2):381-388.
[8] Yang L, Zhang JH, Sun HY, et al. Study on apricot genomic DNA extraction by modified SDS method. Chin Agric Scie Bull, 2008, 24(4):69-71. (in Chinese)
杨丽, 张俊环, 孙浩元, 等. 基于改良SDS法的杏基因组DNA提取. 中国农学通报, 2008, 24(4):69-71.
[9] Yav P, Yang Q, Wang HZ, et al. Comparison of Lowry's modified assay with Bradford's dye-binding assay for determining proteins in earthworm extract. J Shanxi Med Univ, 2006, 37(1):9-11. (in Chinese)
闫萍, 杨琦, 王惠珍, 等. 改良Lowry法和Bradford法测定蚯蚓提取物中蛋白质含量的比较. 山西医科大学学报, 2006, 37(1):9-11.
[10] Zhu YQ, Lu GH, Xu YF. Study of the pharmic sensitivity on the gastric carcinoma cell line MGC-803 by oxymatrin. Chin Pharm Bull, 2006, 22(10):1278-1279. (in Chinese)
朱艳琴, 鲁光华, 徐玉芳. MTT法检测体外培养人胃癌细胞株MGC-803对苦参素注射液的药物敏感性. 中国药理学通报, 2006, 22(10):1278-1279.
[11] Li CY, Jia WX, Zhang XM, et al. Study of apoptosis of SGC7901 cell induced by momordin. Sichuan J Cancer Control, 2001, 14(1):1-4. (in Chinese)
李春阳, 贾文祥, 张雪梅, 等. 苦瓜蛋白诱发胃癌细胞SGC7901凋亡的研究. 四川肿瘤防治, 2001, 14(1):1-4.
[12] Lin YQ, Zhou Pen, Zeng ZM. Cloning, expression and the anti2tumor activity of recombinant MAP30 in Escherichia coli. China Biotechnol, 2005, 25(5):60-66. (in Chinese)
林育泉, 周鹏, 曾召绵. 苦瓜MAP30蛋白基因克隆、表达及其抗肿瘤活性研究. 中国生物工程杂志, 2005, 25(5):60-66.
[13] Arazi T, Lee Huang P, Huang PL, et al. Production of antiviral and antitumor proteins MAP30 and GAP31 in cucurbits using the plant virus vector ZYMV-AGII. Biochem Biophys Res Commun, 2002, 292(2):441-448.
Research on cloning and expression of overall length MAP30 gene in pichia pastoris and bioactivity assay
ZHU Zhen-hong, YANG Wei-wei, GE Li-jun, WAN Hai-tong
Author Affiliation: College of bioengineering, Zhejiang Chinese Medical University, Hangzhou 310053, China
In order toefficiently express overall length MAP30 gene and study the bio-activity of recombinant MAP30.
The specific primers were designed according to MAP30 gene sequence in GeneBank. Then full length sequence of MAP30 gene was amplified by PCR with the genome DNA template of Momordica charantia. After sequencing analysis, it was cloned into pPIC9K vector. The vector linearized byI was transformed into pichia pastoris GS115 by electroporation. Multi-copy inserts was screened by resistance against G418.The multicopy recombinant was induced expression with methanol. Total protein quantity was measured by Lowry method, and purity of target protein was tested by scan of the SDS-PAGE, then the content of recombinant protein in pichia culture medium could be calculated by multiplying total protein (mg) and target protein purity (%). Three purification steps were adopted. Firstly, the supernatant was salted out by 75% (NH4)2SO4, then hydrophobic chromatography was used by Phenyl Sepharose FF, finally Ion-exchange chromatography was adopted through CM-Sepharose FF. The bio-activity assay was carried out with gastric carcinoma cell line SGC7901 by MTT method. Protein-terminal sequence was also analyzed by Edman degradations method.
SDS-PAGE showed that MAP30 was successfully expressed, the molecular weight is 32 kD. Content of recombinant protein was as much as 67% total protein in pichia culture medium. After three steps purification, overall recovery is about 32.4%. Anti-tumor assay showed that it can inhibit SGC7901 cell line. The dose required for 50% inhibition (IC50) were 30mg/ml. Sequence of eight amino acid at-terminal was in complete accord with theoretic sequence.
Recombinant MAP30 was successfully expressed in pichia pastoris, and it has inhibition of tumor cells.
Momordica charantia; Ribosomal proteins; Pichia; Gene expression
ZHU Zhen-hong, Email: zhenhongzhu@yahoo.com.cn
10.3969/cmba.j.issn.1673-713X.2010.02.006
浙江省教育厅资助项目(Y200805653)
朱振洪,Email:zhenhongzhu@yahoo.com.cn
2009-11-23
